对鱼的放电器官的乙酰胆碱受体进行的研究,使我们对大脑内的神经元相互间怎样通信有更深入的洞察。

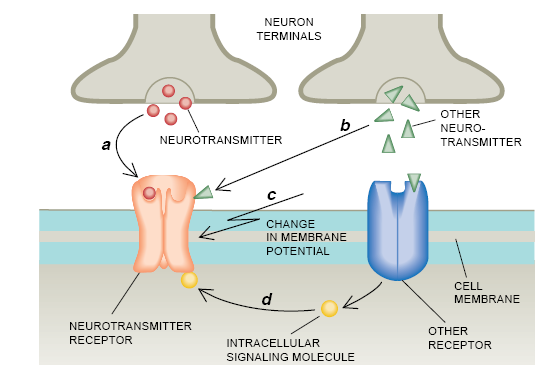
早在1904年,英国科学家T. R. Elliot就曾正确地提出,神经元(神经细胞)相互之间和与其他类型细胞之间进行的不是电性的,而是化学性的通信。他指出,沿着受激的神经元传播的动作电势(电脉冲)起动受激细胞释放出化学物质(现在叫神经递质)。反过来。被释放的化学物质又可能引发另一个细胞吸收或放出所选择的离子。神经递质以此改变通过这第二个细胞膜的电荷流动而得以产生一个新的脉冲。
从那时起,研究人员已经鉴定出大约50种神经递质并且已经了解到单个的神经元也许能分泌这些神经递质中的几种。研究人员还努力搞清楚神经递质,特别是脑内的神经递质究竟是怎样调节受其影响的细胞里的离子运输,从而产生脉冲的。
后一个问题的答案来得比较晚,但是在过去的25年里,在巴黎巴斯德研究所我的实验室以及其他一些实验室里的研究已经取得了巨大的进展。我们已经确定,突出于细胞膜上的神经递质受体在介导化学信号转化电活性的过程中起着关键的作用。我们已经开始阐明某些主要的受体怎样完成这一复杂任务的。已经发现。这些分子组成了相当大的一族神经递质受体。这些受体被称为控制神经递质出入的离子通道。
有关这方面的许多知识都得之于70年代和80年代利用最初从一种放电鱼的发电器官上分离到的一个受体进行的深入研究。但是研究人员在此之前几十年就已经开始解开关于脉冲借助化学物质传递之谜。在这方面牛津大学的John Newport Langley作出了开创性的贡献。他在1906年提出,机体的组织有接受药物的受体。就这样,他提供了关于神经递质如何发挥其功能的第一批重要的线索。
Langley根据他的设想深入研究箭毒是怎样杀死其受害者的。在着手这方面的研究后,就了解到箭毒能引起窒息、阻止运动神经诱导呼吸肌的收缩。但是,他迫切想知道,箭毒是作用于神经呢,还是肌肉。为了找到答案,他把大剂量的烟碱(一种通常能引起收缩的物质)直接放在取自小鸡的骨骼肌条上(在运动神经通常连接的部位)。肌肉条随即进行收缩。然后他使用了箭毒,后者阻止了烟碱的作用。Langley得出的结论是,箭毒直接和肌肉组织发生相互作用:肌肉组织在其表面呈现一种能和烟碱或箭毒相结合的“特别容易兴奋的成分”,即“感受性物质”。
现在神经生物学家都知道烟碱和箭毒能和专门结合神经递质乙酰胆碱的受体分子的一个部分相偶合。被结合的烟碱起着激动剂的作用:它模拟天然产生的物质——乙酰胆碱的刺激效应。与此相反,被结合的箭毒则是与其相抗争的拮抗剂:它不发送刺激信号,同时也阻止乙酰胆碱和烟碱去这样做。
尽管受体概念如此卓越,但是科学界在长达数十年中均未能识得其真正的价值。产生疑问的部分原因在于科学家缺少分离受体的手段。此外,他们一直很难想象,某种化学物质和细胞表面的受体分子的结合是怎样影响细胞膜内穿过通道的离子流的。
直到60年代中期,在作为攻读博士学位的研究生的我从理论上解决了这一概念上的难题后,上述疑问才开始消失。几年前,对血红蛋白和各种酶进行的结构研究已经指出这些分子包含着相互分隔的几个能和其他物质相结合的位点。我和我的导师Jacques Monod和Francois Jacob以及他们的同事Jeffries Wyman推测,某些酶也许能通过变构的方式.即间接地被激活,通过这种方式在某个位点上的结合作用会在没有附加能源的任何帮助下影响另一位点的行为。我们估计,某种物质粘附到某个酶上的一个对位位点,可能把构象变化扩展到整个酶,从而使远处的某个位点能作用于一种物质(由酶转化的物质)。
我在我的学位论文中简要地指出神经递质的受体可能也是以上述方式发挥其功能的。它们也许既有神经递质结合位点,也有一个与它分开的能形成离子通道的区。神经递质粘附到结合位点上可能会引起分子构象变化。这一变化的结果定会打开分子的通道。为了评价这一想法的价值,我的同事和我必须细致地分析某种受体的组成情况。为此,我需要大量的受体。遗憾的是,当时还没有分离到受体,因此这项工作就成了我们的当务之急。David Nachmansohn在他脱离纳粹德国以后所得的研究结果启发了我们对受体的选择。在30年代末,Nachmansohn和他的同事们在巴黎大学证明乙酰胆碱不仅能促使放电鱼的肌肉收缩,而且还能使它的发电器官产生电流。此外,这些器官还为研究人员提供了两个特别方便的条件:其结构细胞(叫做发电细胞)很大,因此比较容易处理,而且其数量以十亿计,这说明发电器官藏有大量的乙酰胆碱受体分子。
考虑到这些方便条件,我们决定分离电鳗(Electrophorus electricus)发电器官里的乙酰胆碱受体。首先,我们必须分解该器官里的电细胞以便取得能进行化学分析的制备物。Michiki Kasai(现在在大阪大学工作)和我因此得以利用其放电的组织。然后我们从电细胞的受神经支配区的膜上分离出微米大小的片断。Langley用肌肉组织进行的研究提示我们在神经支配区里将可发现大量的受体。这些膜片断具有特别有用的特性:可以把它们密集在能装满放射性标记的钠离子(Na+ )和钾离子(K+)的微囊里。
正如我们所预料到的那样,如果把受体的功能性拷贝放入这些微囊后,在这些微囊的悬浮液里加进乙酰胆碱后明显地改变了出入微囊的离子流——和完整的电细胞对乙酰胆碱作出反应后发生的情况完全一样。此外,和变构机制的早期设想相一致的是,为了产生反应不需要另外供应能源。
但是,我们仍然需要有一种方法能把受体和膜里其他物质区别开来。在这种情况下,确认膜上分子种类的唯一方法是对瞄准它并和它紧密结合的物质进行放射性标记。当我们正苦于找不到合适的寻靶物质时,得到了国立台湾大学的李庆元(译音)的帮助。
1970年春,李庆元正好来访问我们实验室,带来了他对蛇毒的结构和作用的研究项目。有些蛇,如金环蛇(Bungarus multicinctus)和眼镜蛇的咬啮是致命的,因为这些蛇的毒液含有像箭毒一样的毒性分子,能阻断运动神经的信号输送。在这些分子里有α毒素。据李庆元报导,取自金环蛇的α-金环蛇毒几乎能不可逆地抑制乙酰胆碱对进化上晚出现的脊椎动物肌肉的作用。后来我认识到 a-金环蛇毒也许能提供我们为鉴定我们取自电鳗的微囊上的乙酰胆碱所需的特异性。我们感到高兴的是,李庆元提供的毒素正合乎我们的需要。
我们终于能够着手纯化受体的工作了。不久就发现它是一种蛋白质。1974年,我们的研究小组和另外几个研究小组都取得了成功。我们的研究小组利用亲和色谱法达到了这一目的。我们制成了箭毒的结构类似物端部的臂可以触到的一种不溶性小珠,然后我们把这些小珠浸在已经溶解在去垢剂里以分离其结构分子的微囊膜里,游离的受体分子结合到类似物上,而溶液的其余部分则飘浮掉了,然后我们就提纯小珠上箭毒类似物的拷贝,这样—来,受体分子就优先结合到附加的类似物上面脱离开珠子。我们使形成的受体和类似物的复合体通过只有箭毒物质可透过的膜,就去掉了类似物而获得了纯净的受体。
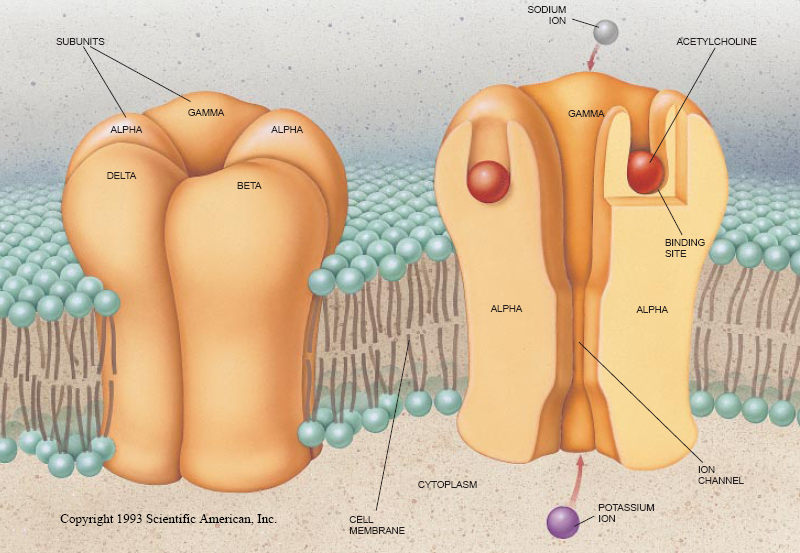
我们急于想知道有关所取得的这些受体的结构情况,就把样品送交巴黎Jacques Monod研究所的Jean Cartaud去用电子显微镜进行观察。他发现由上往下看时,这种受体很像中间凹下去的蔷薇花饰。哥伦比亚大学内外科医学院的Arthur Karlin和加州理工大学的Michael Raftery进行的另一些分析揭示了整个分子是由5根蛋白链(亚单元)构成的:2根分子量相同的α链和3根分子量不同的分别称之为β,γ和δ的链。此外,Karlin还证明,α亚单元的主要功能是识别乙酰胆碱。(现在已经清楚,为了打开离子通道,这两根链的每一根上的结合位点都被占据。)
这些结果引起了我们的兴趣。它们表明,每一个亚单元都可能形成蔷薇花饰的一个“花瓣”,而中间的凹处可能是通向横跨膜的离子通道之胞外入口。为了检验这一想法,我们需要更多的数据,但是在此我们必须先解决一个麻烦的问题。我们能否确信受体分子还含有一个离子通道而不仅仅只是结合乙酰胆碱的位点呢?

1974年,我的同事Gerald L.Hazdblauer和我认真地解决了这个问题,其方法是把取自纯化的微囊提取物的蛋白质整合进封装放射性标记的钠离子或钾离子的脂膜。正如假设的确实存在通道的情况下所能预料到的那样,乙酰胆碱的结合起动了离子流,而α-金环蛇毒素和箭毒的结合则阻断了离子流的交换。后来我们又用纯化的受体本身肯定了这一研究结果。因此,到1980年,我们和另外几个研究小组已经证明这种纯蛋白确实含有化学传递电子信号所必需的一切结构因素,即乙酰胆碱结合位点,离子通道和结合其活性所需的机制。
为了解决关于乙酰胆碱受体如何起作用的更深入一步的问题,我们必须破译出其结构氨基酸的序列。这样的信息可以为我们提供线索去了解,当一个蛋白质仅仅是一串氨基酸时适于其自身折叠的外形,而了解折叠后的结构则可为我们提供有关该结构中不同区域功能的线索。
70年代末引入的自动编序法和基因工程技术为这项研究提供了方便条件。1979年,我在Jacques Monod研究所的同事Anne Devillers-Thiery,Donny Strosberg和我搞清楚了欧洲电鳐(Tropedo marmorata)的乙酰胆碱受体中α亚单元一端最前面的20个氨基酸的序列。接着,Raftery和Leroy E.Hood 及他们在Caltech的同事彻底搞清楚了加利福尼亚电鳐(T.californica)的上述氨基酸序列并作了更深入的研究。当他们确认了紧靠α,β,γ和δ等亚单元的氨基末端54个氨基酸后,意外地发现了惊人的相似性:在这4个亚单元里有35-50%的序列是相同的,即同源的。
分子生物学家把这种同一性解释为决定这些亚单元的氨基酸序列的基因是在进化过程中两次复制(并经历随之而来的变更)的某些祖先基因的后裔。同源性进一步表明,全部亚单元相互间相似,因此可能确实围绕着—根中轴准对称地排列,而形成在电子显微镜下见到的蔷薇花饰上的花瓣。
到1983年已有了更完整的认识,京都大学的Shosaku Numa和他的同事们解释了加利福尼亚电鳐受体的先是α,然后是β,γ和δ等亚单元的全部序列。另外三个实验室(其中包括我的实验室)也确定了加利福尼亚电鳐γ亚单元的序列并补充提出了欧洲电鳐γ的亚单元的序列。接着,Numa公布了人体肌肉上乙酰胆碱受体中所有亚单元的序列。这种肌肉受体原来和电细胞的受体几乎没有什么区别。
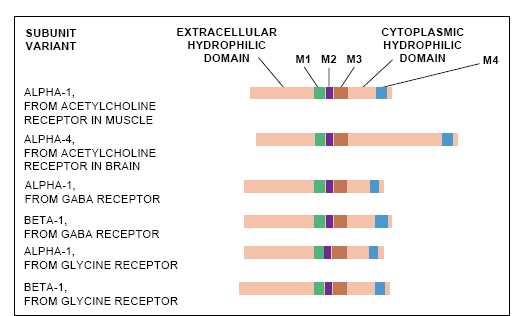
上述研究结果使研究人员在确定有关折叠的亚单元的结构以及这些亚单元怎能密切配合的问题上处于极为有利的地位。科学家们为了预测折叠的蛋白质的结构,往往要仔细地研究不是富含亲水性氨基酸就是富含疏水性氨基酸区段的线状氨基酸序列。亲水性物质都会被水吸引,如细胞质里或充满细胞的液体里的那些物质,而疏水性物质则趋向于结合另一些疏水性组织,如形成细胞膜的脂类。
每一个已经编序的亚单元都在其氨基末端一侧以大的亲水区为起点并包着4个分开的约20个氨基酸的疏水性片断。这些疏水性区域,从最靠近长的亲水区开始,分别被称之为M1,M2,M3和M4。这样的排列表明每个亚单元链都要穿过细胞膜4次,以致所有4个疏水区都横跨细胞膜(见图3)。
至少在一个模型里,大的亲水区伸入到了细胞外空间。α亚单元(主要的功能是抓住乙酰胆碱)上的这个亲水区处于这样的地位,必将能够起到神经递质结合位点的作用。看来有理由进一步推测来自这5个亚单元里的每个亚单元的跨膜片断都和另一些亚单元里的对应片断相结合而形成离子通道。同样的片断如果一起环绕蔷薇花饰的中轴,就可能形成这样的离子通道。
后来的研究肯定了这一情况,还补充了重要的细节。更直接的是,确定了亚单元蛋白的序列使研究人员得以消除有关脑中乙酰胆碱受体作用的模糊观念。麻烦来自某些这类受体对蛇毒的反应。
到80年代初,研究人员知道对烟碱敏感的乙酰胆碱受体存在于高等脊椎动物的脑里。但是, α-金环蛇毒看来能够抑制某些受体的功能,但不能抑制另一些受体的功能。这就使神经生物学家们困惑不解了。此外,叫做金环蛇毒的金环蛇的毒素看来能吸附到脑里的某些受体上去,但又不能吸附到另一些受体上去。(这一情况确实比较复杂,脑里还有另一类受体.叫做蕈毒受体。本文不准备讨论这类受体。它们和烟碱类受体极不相同,是由一个蛋白质形成的而且不包含离子通道。这类受体是通过像G蛋白这样的细胞内介质发挥其作用的。)
圣迭戈Salk生物学研究所的James W.Patrick和Stephen F.Heinemann和他们的同事以及日内瓦大学的Marc Ballivet利用他们在电细胞和肌肉亚单元结构方面的知识破译了脑亚单元的氨基酸序列后,上述疑问就澄清了。这些研究人员推测,脑亚单元的氨基酸序列可能和电细胞及肌肉的相类似,尽管脑的某些受体的行为与电细胞及肌肉中受体的行为略有不同。如果这些蛋白质是相似的,那么决定其氨基酸序列的基因也应该是相似的。如果真是这样,那就可望借助于DNA杂交技术分离出脑亚单元的基因,从而揭示相应亚单元的氨基酸序列。
DNA杂交技术利用了基因的最明显的特征。基因是由两股核苷酸(DNA的模块)组成的。取自基因的一股会迅速与取自同一基因或极近缘基因的另—股结合,即杂交。研究人员知道这—特点。因此希望能够从得之于脑的较大的DNA库中取得大脑亚单元基因:利用由真正引导合成电细胞或肌肉亚单元的那些核苷酸顺序组成的“鱼钩”来“钓取”大脑亚单元基因。发现了7种α-单元(每一种都编了号)是在脊椎动物(包括人)的脑里产生的。还发现了3种非α类型的β亚单元,通常被归入β亚单元。这一多样性表明,大脑受体之所以对蛇毒有不同的反应是因为有一个或几个亚单元的氨基酸序列略有不同。
接着进行的研究证明迄今为止鉴定出的大多数亚单元基因的蛋白质产物都能够在活细胞里产生功能性受体,只要细胞至少能制造一个α和一个非α变体。导致这一结论的实验往往是把这些基因注入取自蛙的卵母细胞(即不成熟的卵)的核中。其结果是,卵母细胞制造蛋白质机构把基因转录成信使RNA,并把这种RNA输送到细胞质,再把它转译成特定的蛋白质。这些蛋白质然后相互结合成5组而产生受体。
蛙卵母细胞产生的许多受体的进化还证明,在受体里用另一种亚单元置换一种亚单元确实能改变这一受体的某些特性。例如,神经性金环蛇毒素能抑制对由β-2和α-3或α-4亚单元组成的乙酰胆碱亚单元的反应,但是这种毒素不能干扰由β-2和α-3亚单元组成的分子的活性。
大约就在烟碱的乙酰胆碱受体的异质性被发现的同时,研究人员也正在了解另外4种神经递质受体的结构和作用方式。在这项研究工作开始时,几乎没有人想到γ-氨基丁酸(GABA)和甘氨酸的受体和乙酰胆碱受体有很多相同之处。烟碱的乙酰胆碱受体毕竟是以打开阳离子(正电荷离子)可通过的通道的方式来激活细胞的。与此相反,GABA和甘氨酸的受体却会促进阴离子氯(Cl-)的输送:氯化物阴离子流入细胞会抑制电脉冲的产生,从而能抵消兴奋性受体的效应。
尽管如此,在80年代进行的研究揭示了甘氨酸和GABA受体是由多种亚单元组成的。这本身并不引人注目。但是,使人惊奇的是,海德堡大学的Hernrich Betz和英国剑桥医学研究协会的Eric A.Barnard分别确定了甘氨酸和GABA受体的完整序列,并且发现其亲水区和疏水区的分布情况和烟碱乙酰胆碱受体的非常相似。
换句话说,已经开始看到GABA和甘氨酸受体中的亚单元和烟碱乙酰胆碱受体的一样,4次穿过细胞膜。还有迹象表明,GABA和甘氨酸的完整的受体既带有神经递质的结合位点。也带有离子通道最近的研究表明,有些5-羟色胺的受体也有与此相类似的结构。这些受体和乙酰胆碱受体一样,控制着横穿膜的阳离子输送,因此是兴奋性受体。
上述受体间的结构相似性可以说明为什么神经生物学家现在把乙酰胆碱、GABA、甘氨酸和5-羟色胺等的受体组成了一族在遗传上和结构上都是近缘的控制神经递质出入的离子通道。(最常见的神经递质谷氨酸的受体可能和上述受体是远缘的。它们包含一个神经递质结合位点和一个离子通道,但是结构不同。)还有证据表明,控制神经递质出入的离子通道是变构蛋白质。正如理应在变构分子中可见到的那样,神经递质结合位点和离子通道之间所测算出的距离很大:约30埃(A)。
和在乙酰胆碱受体中发现的情况一样,这一族的其他成员的亚单元有多种变体。因此,脑内某一部分的GABA受体在脑的其他部分也许会具有某些不同的特性。例如,被工业化地区的居民作为安定药大量使用的苯二氮䓬类只有加强某些GABA受体的抑制作用。苯二氮䓬类是与远离GABA结合位点的另一个位点相结合而起到这一作用的。
随着控制神经递质出入的离子通道中每个亚单元对每个变体的行为所产生的精确影响被揭示,药物学家们必须能够设计出可以选择性地抑制或增强这些效应的药物。而这些药物本身也许会有助于改善一些使人衰弱的疾病,包括抑郁症,因中风而引起的组织损伤,也许还有阿尔滋海默症。
当然,要设计这类药物,研究人员需要更全面地了解受体的结构。他们需要知道在结合神经递质,引导离子流出入细胞和在不同的情况下调节受体功能等方面起决定作用的是哪些特定的氨基酸。获取这方面信息的一种行之有效的方法叫做亲和力标记法。某种能干扰受体分子的可示踪的模型能不可逆地结合那个靶子。因此,被结合的物质会显示出构成该结合位点的氨基酸。
在1988-1990年间,我的同事Michael Dennis、Jeome Giraudat、Jean-Luc Galzi和我揭示了有关乙酰胆碱结合位点的许多方面,其方法是用化合物P-(N,N一二甲基)氨基氟硼酸重氮苯(简称DDF)标记来鉴定电鳐受体中的氨基酸。我们了解到,有几种芳香氮基酸(带有环侧链的氨基酸)是DDF结合作用必不可少的。因此我们确定了由Karlin在电鳐受体里辨认出的一对半胱氨酸的结合作用。被标记的氨基酸分布在氨基末端区的大的亲水性区的三个不同的区域里。这样就搞清楚是这些氨基酸合起来形成一种负电荷的杯状物,使乙酰胆碱的正电荷部分得以进入其中。
更令人鼓舞的是,我们陆续证明了这些氨基酸确实在受体的功能中起着关键的作用。我们会同日内瓦大学医学中心的Daniel Bertrand用取自鸡脑的完全由 α-7亚单元组成的受体证明了这个观点。(对于形成受体必需既有α亚单元又要有β亚单元的规律来说,这个受体是个例外。)在电鳐受体里用DDF标记的氨基酸的生气勃勃异性变异(是由所谓的位点引导的诱变引发的)能明显地抑制 α-7受体对乙酰胆碱的反应。
总起来说,亲合力标记研究和诱变研究都肯定α-亚单元的大的亲水区是暴露给细胞外环境的。它在那里准备接受由神经末梢释放的乙酰胆碱并打开运输离子的通道。
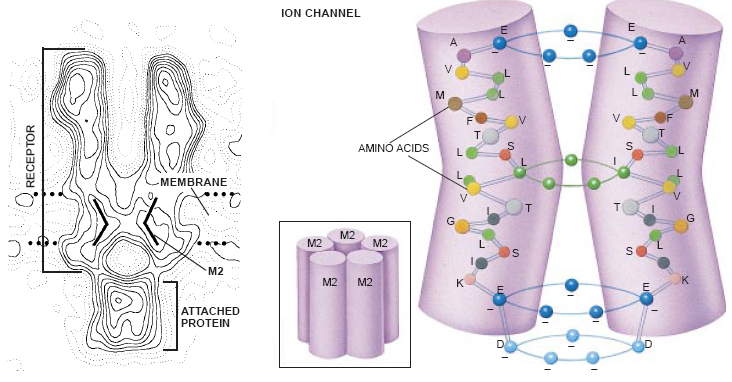
亲合力标记法还描述了电鳐受体里离子通道的结构。到1985年末,困难的分析使我们确信氯丙嗪能粘附至少是一个亚单元一δ链的通过膜的M2疏水区上的氨基酸。这项研究以及柏林大学的Ferdinand Hucho和他的同事们所作的类似的报告都表明,通道的内壁是由5个M2部分形成的,每个亚单元提供一个M2部分。
当时在格丁根Max Planck生物物理化学研究所工作的Numa和Bert Sakmarm肯定了这种可能性。他们通过位点引导的诱变至少确定有3个负电荷的氨基酸(特别是谷氨酸)环参与输送离子使其穿过通道。每个环都位于和细胞表面平行的平面上并且是由5个氨基酸构成的(由每个亚单元的M2片断提供)。一个环停留在膜的细胞表面(在通道的顶部),第二个环(叫做中介环)位于通道的底部,第三个环直接位于第二个环下面之细胞质里。
假如GABA、甘氨酸和5-羟色胺等受体中疏水性亚单元的分布相当于乙酰胆碱受体中疏水性亚单元的分布,那么我们就希望知道它们的M2片断是否也在这些受体里形成通道。它们的确如此,即使这些受体输送的是负电荷离子而不是正电荷离子也如此。电荷偏向性差异的原因显然恰恰在于几个氨基酸的差异。当的研究小组和我的研究小组把取自GABA受体的3个M2氨基酸(包括产生介导环的那个M2氨基酸)转化成α-受体后,这几个变化就把α-7受体的通道从阳离子输送器转化成阴离子输送器。
不管一个受体带有一条运输阴离子还是阳离子的通道,它的主要功能总是在对神经递质发出的信号起反应时打开那个通道。它们通过改型,看来能增强或减弱其对神经递质起反应的准备程度。它们通过此种方式能调节对外来信号起反应的受体库并从而影响信号传递的效应。
当我的助手们和我开始考虑几位研究者多年来指出的一种现象时,就意识到受体可能具有这种调节能力。受体对高度浓缩的乙酰胆碱(如通常由神经元输送的乙酰胆碱)的不连续脉冲作出的反应和对连续得到的低浓度乙酰胆碱(如在许多实验中提供的乙酰胆碱)作出的反应是不同的。
被激奋的神经元在突触(连接神经元的专性的接合点)处不连续地突发性分泌高浓度的乙酰胆碱。在单个脉冲过程中分离出的分子进入突触的空隙(把相互通信的细胞分开的空间),其中有许多分子是从被激奋的突触前细胞走向突触后细胞表面上的受体。在正常情况下,大多数受体分子对神经递质的亲合力是弱的。因此,在乙酰胆碱结合受体并促使其打开通道后,受体会立即放松其对神经递质的控制,后者随即被降解。受体在被结合的几毫秒时间里恢复到它关闭的,未被结合的状态而准备好再次反应。
与上述情况相反,如果受体不断地得到乙酰胆碱,那么受体分子就会丧失反应能力。它们在最初开放其离子通道后,即缓缓地形成“脱敏”构型达数秒钟或数分钟之久。这就是说,它们活跃地结合乙酰胆碱,但是保护关闭的通道,因而不输送离子。甚至低浓度的乙酰胆碱也会被这些关闭通道的受体控制住较长的时间,而在此期间受体不能对新的信号作出反应。
因此,乙酰胆碱受体看来至少能接受三种可以互相转换的状态。这三种状态使受体对神经递质的亲和力和其传递信号的效率各有差异。除了高亲和力状态,通道保持关闭的“脱敏”状态外,还有亲和力弱的静止(但可被激活)状态;在此状态下通道是关闭的,但是如果两个α-亚单元都突然被乙酰胆碱结合,通道极容易被打开。这种亲和力弱的,通道开放的情况是第三种状态。所有这三种状态都是自发地转换的,但其速度和有乙酰胆碱存在时不同。
引导位点的诱发帮助搞清楚了导致脱敏化的过程:这一过程显然涉及亮氨酸。在我的研究小组进行的亲合力标记研究中,氯丙嗪标记了离子通道中央附近无电荷的亮氨酸的环。当Bertrand的研究小组和我的研究小组用较小的无电荷的氨基酸置换这个环中的亮氨酸后,创造出了一个受体,这个受体在和乙酰胆碱紧密结台这一点上相似于正常的脱敏受体。但是它的通道是固定在打开状态的。这一结果意味着,当受体处于脱敏构型中时,亮氨酸环会锁住离子通道。
我的助手们和我一直在思考有机体拥有能适应多种状态的受体究竟会给它带来什么好处。当然,脱敏机制能够防止带有受体的细胞在对危险性的高量乙酰胆碱起反应时不致被过度激奋,但是我相信还有另一种解释。
1982年,我的同事Thierry Heidmann和我进一步提出,乙酰胆碱受体缓慢地改变其构型的能力可能更经常的是起着增强或减弱在突触处传递信号的效率。这样一来,这类受体可能参与学习。由于Donald O.Hebb引导的,许多理论家都主张学习依赖于把信号传过连接两个同时被激活的神经元的突触的效率。
我们的假设还远未得到证明,但这是可能的。如果适应多种状态的能力对调节信号传递来说是重要的,那么这种灵活性也将出现在其他的神经递质受体里。研究人员证明GABA、甘氨酸以及5-羟色胺等的受体也能够接受脱敏的构型。
对于受体可能调节突触效率这一点来说,其他受体里的状态变化并非唯一的证明。这些分子处于特别良好的位置上而得以控制任何特定时刻所必需的反应程度。它们在穿透细胞膜时,就接触到由细胞外和细胞内发出的化学物质和电信号,如果这些信号中的每个信号都能促使受体趋于这一种或那一种构型,那么最终的排列将反映出不同的、可能是相对立的力量所产生的总和(即综合)的影响。
在发送到受体上的信号之中有细胞内的钙离子浓度和穿过细胞膜的电位的变化,膜的超极化和肌肉内钙浓度的升高可加速乙酰胆碱受体的脱敏化。洛克菲勒大学的Richard L.Huganir和Paul Greengard在1986年进一步确定受体的磷酸化会促进其脱敏。
如果神经递质受体确实控制着细胞内信号发送的效能,那么我们就应能预料到它们不仅能减弱,而且还能增强对神经递质的敏感性。这种可能性已经观察到了,细胞外的钙能增强脑里烟碱受体的刺激效应,而甘氨酸则能增强谷氨酸受体的效应。
因此,一般说来,我们推测,如果一个受体摇摆于两种构型之间,那么其中之一是敏感的,而另一种则是耐刺激的。化学物质或电位可能使这种平衡趋向两种状态之一。而由此形成的构型则能增强或减弱受体迅速输送信号的能力。
显然,我们对脑内化学信号发送的了解在最近的25年里有了明显的进展。决定从鱼的器官里分离乙酰胆碱受体是风险性的尝试:如果这一努力失败或者这种受体和其他受体毫不相关,那么我们将白白浪费时间和精力。幸运的是,其结局之好出乎我们的意料。搞清楚了放电鱼里的乙酰胆碱受体并破译了它们的氨基酸序列。后来,生物技术,特别是重组DNA技术使研究人员得以鉴别出人体肌肉和脑里和己酰胆碱有关的受体,并了解到烟碱的乙酰胆碱受体在结构上是相关的,而且和对GABA、甘氨酸以及5-羟色胺等起反应的受体形成了一个受体族。
与此同时,开始搞清楚组成各类受体的亚单元本身是可变化的:在脑内某一部分的受体所具有的特性可能和大脑组织中另—部分中同类受体的特性完全不同。这种可能发生的事物启发人们有可能去开发出以已确定神经元类型上的特定受体为靶子的药物.这类药物将以极大的选择性来治疗各种脑内的信号紊乱症。
请 登录 发表评论