一项跨大西洋的合作研究已揭示了决定着形成微小的然而却必不可少的容器即小泡的机器,这些小泡在细胞内贮藏蛋白质并使它来回地往复运动。
所有的有核细胞——无论是酵母菌落中的细胞或植物和人体中的细胞——都有相似于管理得很好的城市拥有的复杂的内部组织。或许最值得注意的是,细胞和城市两者均依赖于特殊部门的协调活动。在细胞内,这些部门被膜形成的壁分隔开,并被称作细胞器。
到细胞“城”中某些更为重要的部门去作短途旅行,可从外膜出发(它本身也是一个细胞器)。这种结构类似于围绕古代城市的有城门的城墙,其类似之处在于它控制着食物和其它物质的进入以及在其内制造的产物的输出。另一个关键的部门位于胞内深处并起制造中心的作用。正是在这个制造中心的内质网内,生产出许多蛋白质——细胞的主要工作部件。然后这些新近制造的蛋白质被运输到另一个部门,即高尔基体内。在这里它们被改性(往往是加入糖)并最终被运载到胞内或胞外的其它目的地。这样,高尔基体就是我们的微观城市的主要分配中枢。
甚至细胞也包含有它们自己的循环中心,称作溶酶体。这些中心分解老化的和无效的蛋白质以及某些其它分子,以致它们的成分能够被重新制作以及再利用。溶酶体也接受已经从外部运输到细胞内的物质。
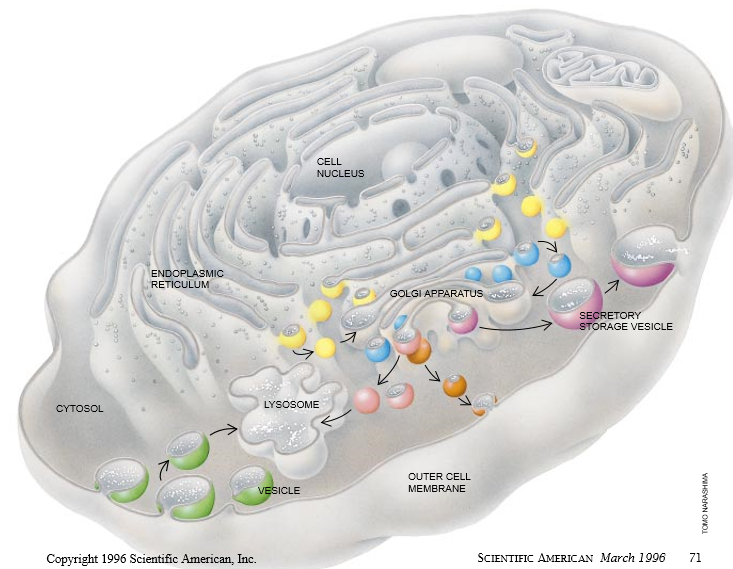
不足为奇,细胞已进化出一个能在不同细胞器之间输送蛋白质的复杂的运输系统。它被组织成像机场内以集装箱为基础的装运系统。所有要到达共同目的地的货物都被装入一个公共的载货集装箱,称作运输小泡。只有当它到达了它的目的地时,该小泡才被打开。每个细胞都产生许多种运输小泡,而且每种对于不同的胞内运送途径或货物类型都是特定的。细胞也产生运输小泡。这些小泡贮藏着对细胞之间的通讯起决定作用的物质r如神经递质和胰岛素),这些载体根据精确的信号从细胞中释放出载货。
很明显,运输小泡对细胞功能和机体功能的许多方面是必需的。然而,多年来没有人知道它们是怎样形成的。但是,近来我们两人以及我们的同事已勾画出了许多分子细节。除了固有的意义之外,这些结果最终对医学可能有价值的。例如,肿瘤细胞只有当它们的运输小泡的功能是适当的时候才能够增殖。因此,可以想见,妨碍小泡形成的物质能够增强当今市场上抗癌药物的作用。
我们的经历在许多方面具有大部分现代细胞生物学的特征——它起源于显微术(显微术首先揭示了运输小泡的存在)。而它的分析能力则在于生物化学(它详细确定了小泡形成中涉及的许多分子反应)。这个情节也说明了科学研究的真实特性。外行常常把科学发现看作为没有人格的过程。在这种过程中,无情的逻辑使纯粹的理解力产生对一个问题的明确解答。这种看法低估了虚假步骤。偶然的好运气和坚忍不拔所起的作用。教科书式的描述反映不出追猎的快乐!对于我们来说,尽管我们被大西洋所分隔,只允许我们每年相会一次,但我们彼此密切合作就是我们最大的快乐。
“你是谁? ”
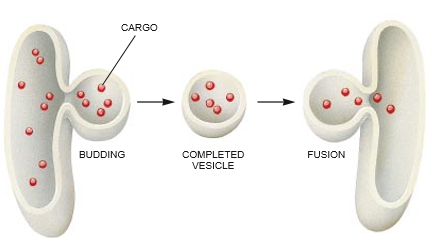
在我们开始合作研究之前,研究完整细胞切片的显微学家们在八十年代中期已经概述了小泡运输蛋白质的一些基本步骤。主要是在George E. Palade于六十年代进行的获得诺贝尔奖的研究(当时他在洛克菲勒大学工作)的基础之上。研究人员已经知道,小泡或许是从细胞器的膜上出芽而产生的,由此变成微型的、被膜束缚的囊。其后每个囊通过胞液(富蛋白质的液.细胞器浮在其中)而移动,并粘到特异靶细胞器的外膜上。然后小泡的膜与靶细胞器的膜融合在一起。在这个过程中,将装载的蛋白质倾倒入靶的内部。换句话说:“货物集装箱”在它的目的地被打开,同时它的货物卸了出来。
为了弄清出芽是怎样发生的,必须在试管中研究这个过程——即在细胞外再创小泡形成过程,消除外来的元素,用这样一个系统,人们能够控制或换句话说分析产生小泡的机器元件。确定哪些分子首先起作用,其次又是哪些分子起作用等等。但是,直到1980年我们两人之一(Rothman)在斯坦福大学设计出这种无细胞系统之前,没有人能做到这一点。

1984年,Rothman及其同事发表了一篇报告。宣称他们的无细胞系统能再创已知发生在完整细胞内的小泡形成过程。这已能使运输小泡从高尔基体的膜上长出芽来,该高尔基体有几个并连的分室。从高尔基体膜衍生出来的大多数小泡将载货从高尔基体的一个分室运输到另一个分室。这些小泡属已观察到的那类小泡。但是,某些高尔基体小泡将蛋白质发送到更远的位置[参见《利学》 1986年,第1期.James E. Rothman所著“高尔基体的区隔结构” 一文]。
正是在这个阶段,我们的合作以难忘的方式开始了。在这篇文章于12月发表后不到一周,在一个下午较晚的时候,Rothman办公室的电话响了。电话铃声打断了Rothman的日常文书工作,他拿起了话筒。他还来不及说出“哈罗”,电话里就以热烈、快速和完全不可思议的独白方式响起了一种深沉的带意大利口音的英语的声音。Rothman自己也是以激烈的语言表达出了名的。现在他却对这种表现吃惊得哑口无言。几分钟后.由于完全不知所措,他重新进行他的日常文书工作,让这种独白继续下去。又过了几分钟之后(在这期间,唯一可听清的词是“合作”和“我们将成为兄弟”),Rothman终于无可奈何地叫起来: 你是谁?这声音停了一会儿,然后又非常温和而清楚地甚至谦逊地声明: “我是Lelio Orci,日内瓦大学的教授,我从事——”
当然,Rothman立刻想起了这个名字。0rci是一位非常知名的电子显微镜专家。Rothman立刻表示道歉。Orci说话更慢了,虽然在日内瓦早已经过了午夜,但是他们还是作了长时间的、富有成效的意见交换。
错误的想法,有用的结果
几周之内,Rothman就到了日内瓦。我们两人激动地拟出了一个计划,用这个计划,Orci的技术能够决定,在无细胞萃取液中从高尔基体膜出芽的小泡是否有特殊的性质。我们特别想知道,这种小泡是否是嵌入所谓的网格蛋白(clathrin)的外被里面,主要由纤维蛋白质的网格蛋白组成的像笼子一样的厚层。在结构上,这种网格蛋白外被,有点像网格球顶。

我们提出这个问题,是因为已知某些运输小泡具有这种外被,这是当时唯一被确认的一类外被。(具网格蛋白外被的小泡从细胞外将蛋白质运输到溶酶体系统中以进行分解;它们从细胞的外膜中长出芽进人液胞中。)这是,由于缺乏无细胞的系统,无法弄清出芽的机理。如果Orci能够证实由高尔基体衍生而成的小泡有着网格蛋白的外被,Rothman就能立即着手他的无细胞系统的生物化学研究,以评价关于具网格蛋白的外被的小泡是怎样形成的一种有说服力的模型。
那种模型在六十年代来自日本大阪大学的Toku Kanaseki和Ken Kadota开创的研究。1969年,Kanaseki和Kadota纯化了具外被的小泡,并发现这种外被有令人吃惊的有规律结构。六年之后,这种规律性的原因已变得很明显,当时英国剑桥的医学研究理事会实验室的Barbara M .F.Pearse发现,这种外被主要是由一种蛋白质的许多拷贝组成。她把这种蛋白质定名为网格蛋白。Kanaseki和Kadota预见那种外被本身导致出芽。随着网格蛋白的笼的发育(或许是由膜的成分发育而来),它使下层的膜(一种高度可塑的结构)变成拱顶样的形状,完全将球形的小泡和附着的蛋白质吸出这大的膜之外。
到1984年,已很清楚这种设想是有点太简单化了。当Rothman证明了在他的试管系统中的出芽时,他发现出芽的过程不能单从分离的膜中发生。小泡的形成需要胞液和能量 这些结果表明,外被必须是以某种方式由胞液中的物质衍生而来。然而 Kanaseki和Kadota的基本模型仍然是有吸引力的,并值得检验。
Rothman从日内瓦回到斯坦福之后不久,他的一个研究生就开始实施我们的计划。Benjamin S.Glick通过在试管中培育高尔基体和胞液及能源而产生了运输小泡。然后他保存这些试样并将它送到日内瓦进行显微分析。数天内,Orci已确定,由高尔基体衍生而来的小泡的确是被包裹在外被里面,但不是预期的那种类型。它的细微结构不同于网格蛋白外被的结构,其材料不能被与网格蛋白特异结合的抗体所识别。这种惊人的结果表明,细胞至少制造运输不同外被的两种运输小泡。现在看来,存在着许多种运输小泡,每一种都有性质不同的外被。
那个研究的结果是错误步骤可能具有意外价值的极好例子。我们的错误假设——网格蛋白外被介导高尔基体内运输小泡的形成——导致我们去进行一种试验,这种试验把我们的注意力从具网格蛋白外被的小泡转向我们刚刚鉴定出的那些小泡。因此,我们的错误把我们推向富有成果的研究新途径中,这种研究揭示了许多关于运输小泡怎样出现的信息。(相反,对具网格蛋白外被的小泡如何发育的认识进展得远为缓慢。直到最近,没有人能设汁出无细胞系统以对其进行研究。)
作为揭开高尔基体衍生的小泡如何形成的第一步,我们必须弄清它们的外被之组成。这一挑战将花去几年的时间。开始,我们必须获得这种微型球的纯的供给源,在那时这是一项令人生畏的任务。经过了努力奋斗之后。Rothman的实验室里的年轻研究员Vivek Malhotra和Tito A.Serafini终于在1989年分离出了很少的数量,但它足够分析用。同时使他们得以证明,这种外被古有8个蛋白质分子。我们把它们定名为COP蛋白质(coat protein),而且很快就习惯将高尔基体衍生的小泡称作COP外被小泡。
为了阐明出芽的机理,我们必须发现更多关于COP蛋白质的情况以及它们彼此之间的相互作用。我们对这种相互作用的最初的主要见解来自1990年,当时我们发现,在作为一个单独的单位附着到高尔基体膜之前,7个蛋白质分子组合成一个大的络合物,我们称这种单位为外被体(coatomer)。只有一个蛋白质分子单独结合。因此,实际上这种外被只由两个主要成分组成:外被体和第八个蛋白质分子。这种大大简化了的发现表明,我们能够查明出芽的主要步骤,而不必分别研究每种外被体蛋白质。
这意外的发现是由于运气和心计起了作用。1990年的一个深夜,Rothman的实验室(那时在普林斯顿大学)里一位的年轻的研究人员M.Gerard Waters正在研究一些数据,这些数据是他试图纯化用来使运输小泡与靶细胞器膜融合所需的一物质时得到的。很凑巧,Serafini刚好经过那里并从Waters的肩上看了过去,他为所看到的东西大吃一惊。
在纯化一种蛋白质时,人们将细胞革取物的组分根据其物理性质和化学性质分为不同的组。然后对这些组或馏分进行测试以寻找有关活性的证据(诸如引起小泡与膜融合)。表现活性的试样被进一步再分为更加精制馏分的新组,并再次测试。同时。那些不表现活性的馏分一般被丢弃。最终,人们获得只含引起有关的生物活性的蛋白质的样品——一种纯化蛋白质。
为了进行得彻底,Waters已分析了未显示引起融合证据的馏分的蛋白质含量。几个月来,十分自然地,他一直把这个馏分作为无用的废物而丢弃了。Serafini注意到,被Waters丢弃的馏分与他和Malhotra早些时间曾鉴定为COP蛋白质的馏分是相似的。
研究很快发现,丢弃的物质几乎仅由七个COP蛋白质分子组成,这些蛋白质是彼此牢牢地结合在一起的。我们知道,因为这个馏分强烈地抵抗被进一步再细分,所以它们结合在一起。然而,具有讽刺意味的是,当Rothman的实验室的一部分人在呕心沥血地努力分离具外被的小泡(以便获得痕量外被蛋白质)时,另一部分人却大量地抛弃同一种蛋白质。多亏了Serafini和Waters的机敏,这种废物才被保留下来,确认了外被体的存在,并省去了若干年的工作。现在我们拥有各种试验所需的无限数量的外被体蛋白质源供我们使用。
我们立即将注意力转向对第八种蛋白质分子的鉴定。我们有很多理由怀疑它是称为ARF[ADP ribosylation factor(腺苷二磷酸核糖化因子)]的一种分子。这种分子首次被得克萨斯大学西南医学院的Richard A.Kahn和Alf0rd G.Gilman描述。并已知能使霍乱毒素引起疾病。但是,它在体内正常的作用却是一个谜。幸好,要证实我们的怀疑是很容易的。从Kahn那里,我们获得了只识别ARF的抗体。然后我们把该抗体与我们的蛋白质混合。这种抗体容易结合,表明该蛋白质实际上就是ARF。
经过六年的艰苦试验之后,我们已有了纯净形式的所有外被蛋白质,并最终准备好破译出芽的机理这个任务是更加简单。在Rothman已将他的实验室迁至斯隆—凯特林癌症纪念中心之后,我们于1991年开始了这项计划,仅在两年内我们就已弄清了许多问题。
揭示出芽
我们首先要问,为了使具COP外被的小泡能从高尔基体中长出芽,外被体和ARF是否是所需的仅有的蛋白质。它们或许需要其它蛋白质的辅助? 已证明只要这种两成分本身就足够了?虽然我们从古有成千上万种不同蛋白质的粗胞液萃取物开始,但是生物化学的威力已使我们能选出两种真正至关重要的物质——外被体和ARF——并使我们证明它们单独就起这种作用。
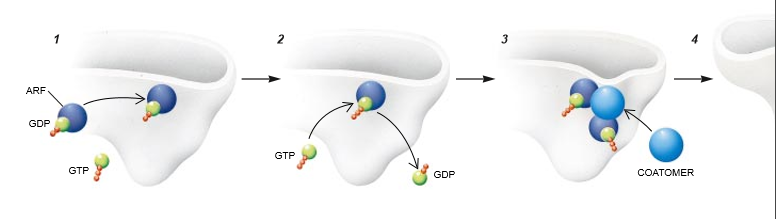
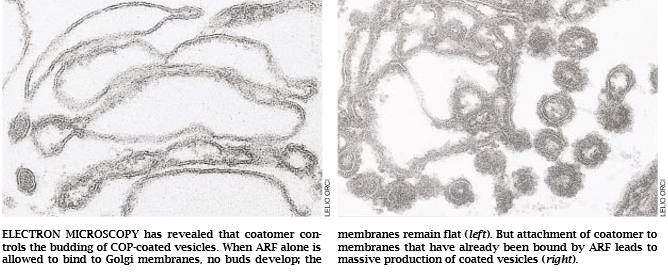
下一步是每次加入这两种蛋白质中的一种,而不是两种同时加入,以作为破译这两种成分所起作用的一种方法。我们看到,在无外被体的情况下ARF与高尔基体膜结合,然后将外被体补充到膜中。但是,外被体单独不能结合到高尔基体上去(这一观点还被国立卫生研究所的Richard D. Klausner及其同事独立地证实)。接着,电子显微镜揭示,当只有ARF结合到高尔基体膜上时,这种膜保持为平展的。但是,当外被体与ARF一起加入时,一个芽就发育而成。这些观察证实,ARF和外被体在产生运输小泡中有明显不同的作用。外被体引起膜弯曲和出芽,而ARF决定在什么时候出芽(命令外被体在什么时候和什么地点发挥其作用)。
实际上,已更详尽地知道出芽过程。在胞液中自由漂浮的ARF一般与一个鸟苷二磷酸(GDP)分子相连接:一个碱基与一个糖基和两个磷酸盐基团相连。当这种单位遇到高尔基体时,在膜表面上的一种酶以从胞液中获得的GDP之对应物[即带有三个磷酸盐基团的鸟苷三磷酸(GTP)]置换该GDP。这种修饰由于两方面的原因是有意义的。第一,只有与GTP结合的ARF才能牢牢地钩在膜表面上,因此使外被体络合物能够出现在运载工具上。第二,在给小泡形成提供能量时,GTP与ARF的结台是一个重要的步骤。
我们应怎样描绘这种出芽过程? 单个的外被体通过一个或多个ARF分子与膜粘连,或许确切的ARF分子数既不是固定的也非决定性的。我们认为(但尚未经证实),这些络合物随后在有规律的排列中并肩相连,在膜的表面形成一个拱顶(有点像网格蛋白构成的拱顶)。当这种排列增长和弯曲时,附着到这外被内部的部分高尔基体膜被形成一个出芽小泡,该小泡最终闭合并被释放出来。因此,正如Kanaseki和Kadota为具网格蛋白外被的小泡所提出的模型所预测的那样,出现许多具COP外被的小泡。但是,在一种改进的模型中,我们的研究表明,每当一个小泡芽生出来时,一个新的外被必须用胞液的成分逐步地组装起来。此外,组装受ARF的控制,并需要GTP提供能量。
虽然这种外被列于具COP外被的小泡的出芽十分重要,但它阻碍了小泡的膜与靶细胞器的膜之间的融合,这种融合需要膜彼此之间直接接触。因此,为了使小泡的内容物能被释放,外被必须脱落。通过把外被组装过程倒过来,这种脱去外被的现象就会发生。在完全形成的具外被的小泡中,ARF分子仍然与GTP相连接。但是很快它们就从GTP中除去一个磷酸根,因此将它转化为GDP并释放出贮存在GTP中的能量。这种转换使ARF分子失去它们对小泡膜的亲和性并落下。因为外被体单位需要有ARF才能使它们自己附糟在小泡膜上。所以它们也分离,留下一个可与靶细胞器自由融合的无外被的小泡。这样,出芽期期间细胞以某种方式在外被中埋下了小的GTP“定时炸弹”:出芽后,炸药被引爆以炸掉外被。
由于小泡在到达它的目的地之前外被就被释放出来,所以它不可能参与引导小泡到它的目标去。无外被的小泡膜含有一组执行这种功能的蛋白质。这些蛋白质也吸引添加的蛋白质,是这些添加的蛋白质引起小泡与它的靶膜融合。
共同的机理
所有的运输小泡出现的过程都与具COP外被的小泡出现的过程差不多吗? 可能的确是如此,这方面的第一个证据是下述发现:网格蛋白外被的组装也是与GTP结合的ARF分子附着到膜上而引起的:Rothman的实验室作出了这一发现。它带我们绕了一个圈又回到我们出发的地方。
然而,当在显微镜下观看细胞中的大多数小泡时,它们似乎没有外被。这一观察可能说明,我们已描述的出芽机理除了揭示具COP外被型和网格蛋白外被型的小泡外,关于小泡的形成情况什么也未揭示。但是,下这样一个结论是为时过早:因为从细胞器长出小泡芽后,外被就迅速被除去,所以标准的观察方法一般不能检测到外被。实际上,迄今为止关于这个领域的历史能够被归纳如下:研究人员最初断定,一个给定类型的小泡缺乏外被,因此由一个新型的机理长出芽:随后,那种类型小泡的出芽在无细胞的系统(它允许短暂的、具外被的状态能够被捕集和鉴定)中再生后发现这种外被。
新近发现需要外被的小泡中包括那些将内质网的蛋白质带到高尔基体中去的小泡。伯克利加州大学的Randy W .Schekman、0rci及他们的合作研究者所进行的试验已证实:与ARF接近的一个对应物起着ARF的作用.在其中它激起了芽过程。此外,叫作COPⅡ蛋白质的一组不同的蛋白质取代了外被体的位置。
现在极少怀疑所有具核的细胞都利用一组共同的原理形成运输小泡。这个过程是如此之有效,以致当简单的单细胞物种演化成更加复杂的多细胞生物时它仍然被保留下来。首先,ARF或一种接近的相似物通过吸收GTP和与膜结合引起外被的形成。其次,这种起始因子补充附加的成分,这些成分组装到拱顶样的外被中。在进行这种变化时,它们引起膜的附着区域作为一个小泡而脱落。以后,GTP分子引起外被除去,使得小泡与靶细胞器融合。
如果外被仅仅对出芽这一在每个细胞器中都基本相同的过程是重要的,那么一个细胞为什么需要许多种外被? 最可能的原因是,外被选择将被组装人小泡中的载货。在某些情况下,作为载货的蛋白质可以存在于膜本身中,并直接与外被结合。在另一些情况下,载货可以通过一个中间体——受体——与外被连接,该中间体横跨在膜上。使用分离的外被将使不同种类的载货从单一产地和从不同的部门被运走。
其它问题也仍然有许多涉及到外被形成的精密的详情。例如,ARF和相似分子怎样精确地附着到膜上?什么精确的相互作用使外被体蛋白质被粘附到膜上。新近的证据表明,某些脂质(脂肪)可以帮助ARF将外被体补充到表面上,同时载货蛋自质本身也能影响外被的组装。我们也将可能知道更多的有关不同外被体亚单位的特异活性的情况。然而,已满意地知道,蛋白质运输的许多核心步骤现在已被弄清。同时,很惭愧地注意到,没有哪座人类组织的城市可与形形色色的细胞将它们的劳动力从一个地方输送到另一个地方的那种高效率相匹敌。
请 登录 发表评论