环境和遗传因素都会在细胞分化成多种免疫谱系的过程中向其发出指令,由此形成的免疫谱系负责识别外来抗原,击杀和排斥入侵物。
免疫系统是由一系列神奇得令人不可思议的细胞组成的,它们总是熟练灵活地相互配合,共同担负起保护机体的使命,使之免遭入侵的微生物和病毒的损害。然而,这些神通广大的免疫细胞却是从少数前体细胞发展而来的。它们最初出现的时间,大约是在受孕之后的第9周。从这一时刻起,免疫细胞还要经历一个循环往复的发育过程。而在这一过程中,免疫系统的基石——干细胞——既能进行自我繁殖,又能导致产生多种专化性免疫细胞谱系,其中包括B细胞、巨噬细胞、杀伤性丁细胞、辅助性T细胞,发炎性T细胞,以及其它一些细胞。
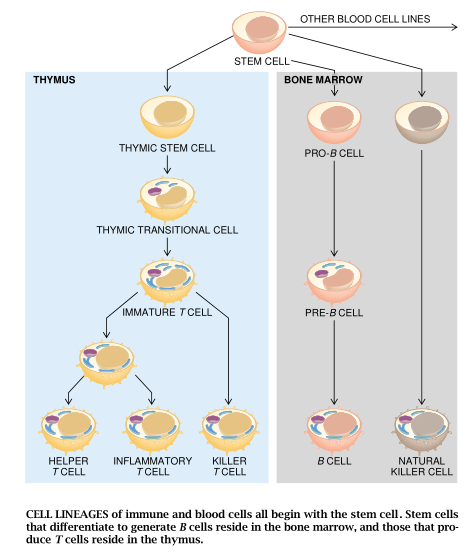
免疫系统的各种细胞既不是与其它细胞分离,单独存在于一个孤立的空间中,也不是共同组合在一起,以独立的器官形式出现.而是一些可以流动的实体,在组织结构上从不依附于其它细胞。这种特征不仅对于其机能的发挥至关紧要,而且给予了免疫系统研究人员不可多得的有利条件,使之能够在整个分化过程中的各个阶段,分离出相对纯净的免疫细胞。这样,研究人员就能通过实验确定各种免疫细胞的特性.勾画出免疫细胞的谱系图。
从受精卵形成之日起,细胞便开始不断产生和分化,最终形成一个完美复杂的成年生物体,而通过上述途径获得的知识,会有助于生物学家了解促使细胞产生和分化的根本原因。除此之外,更为重要的是,这种知识有可能在短期内使人类能够治疗胎儿免疫细胞发育障碍所致多种疾病,以及胎儿娩出后一生中免疫细胞生长偏离正常模式所引起的许多病症。
对于免疫系统的各个组成部分是如何生成的,研究人员如今已有了新的认识。然而,这些观点和研究人员近在30年前持有的见解,却是大相径庭的。现在我们已经知道所有动物免疫系统的各个组成部分都是由数量较少的骨髓前体细胞和胸腺前体细胞发展而成的。本世纪60年代以前,免疫学家一直认为产生免疫应答所需的所有各种细胞都是在淋巴系统内部产生的。而淋巴系统的各个组成部分,包括脾脏、阑尾和淋巴结在内,则广泛分布于躯体的各个部位。随着动物实验和免疫系统机能障碍临床观察结果所带来的新发现的问世,这种观点才开始改变。
或许最先对现代免疫细胞起源说的产生起关键作用的,要数第二次世界大战末期美国军队用原子弹对日本的长崎和广岛两地进行的轰炸。在受到核爆炸所引起的原子辐射后10至15天,许多受害者都因内出血或感染而死亡了。以后,人们进行了一些动物实验,目的在于探明上述受害者的死亡诱因,结果表明,对整个躯体施予的原子辐射,会杀灭造血器官和淋巴器官中的生殖细胞。而体内若没有负责行使凝固功能和击杀入侵物的细胞,动物便会不治而亡。
此后,研究人员发现,若将一小份与患者遗传构型相同的捐献者的骨髓细胞取样植入患者体内,这种由原子辐射引起的辐射并发症就可以医治。随后,人们又用小鼠进行了进一步的研究,结果证明,使小鼠从原子辐射伤害中恢复过来的整个血液系统和免疫系统,仍然是衍源于植入其体内的供体细胞。而在曾受核辐射损伤的这些小鼠通过植入骨髓细胞恢复正常之后。将其亿小份新生骨髓植入受原子辐射重创的其它小鼠体内,同样可以收到起死回生之效。显而易见的是,骨髓所包含的各种细胞,既能分化成所有各种血细胞谱系,又能进行自我繁殖。
免疫学家早就发现,部分骨髓细胞能够繁衍出多种不同类型的细胞,但不一定是所有各种类型的细胞。这些骨髓细胞既要受各个细胞自身的特性所限,又要受细胞谱系的特性所限(据称从同一个前体细胞繁衍出来的所有细胞,都是由同一种克隆复制成的)。研究人员可以通过人工培养,由多种不同的克隆繁育出足量属于分化过程各个阶段的细胞。供分析研究之用。
安大略癌症研究所设在多伦多市,1961年,在该所任职的Ernest A.MeCulloch和James E.Till发现,有证据表明,从理论上讲,单独一个适合于植入受体的正常骨髓细胞,就能在受植者体内重建出一个完整的血液系统。他们将骨髓细胞植入受原子辐射伤害的小鼠体内后,发现许多小鼠的脾脏都长出了隆起的包块,每个包块内都含有好几种类型截然不同的细胞。两位研究人员及其同事通过研究证明,同一个包块内的所有细胞,全都衍源于一个共同的前体细胞。他们认为,动物体内存在着一种数量较为稀少的细胞群体——造血干细胞,它们既能进行自我繁殖,又能繁衍出所有各种类型的血细胞。
人类发现骨髓细胞在建立血液系统和免疫系统上所起的关键作用之后,研究人员又发现,胸腺也起着与之相似的关键作用。新生小鼠的胸腺被摘除之后,就会危及体内其余部位淋巴细胞的产生。(淋巴细胞即白细胞,在动物体内起着杀伤细菌及其它外来异物的作用。)小鼠的胸腺被摘除后,就会出现严重的终身性免疫缺陷。
在另一组意义重大的实验过程中,研究人员摘除了小鸡体内的一种淋巴器官,即所谓的法氏腔上囊,这种器官在小鸡体内所起的作用,类似于人类的骨髓。这一手术并没有像胸腺摘除术那样,危及同样类型淋巴细胞谱系的产生,而是阻止了成熟后便会成为浆细胞的细胞的产生,而浆细胞的作用,便是分泌抗体。小鸡的法氏腔上囊被摘除后,便表现出另一种类型的免疫缺陷。
此后,临床观测结果又提供了新的证据'表明人体内存在两种淋巴系统。有些婴儿的胸腺发育正常,但骨髓却存在机能障碍。这类儿童的外周组织内存在着淋巴细胞,但却患有先天性浆细胞缺乏症。反之,有些婴儿生来就没有胸腺,但其骨髓却发育正常,这类患儿虽能不断产生出浆细胞,但体内所能生成的淋巴细胞数量却很稀少。
对恶性淋巴瘤的研究结果揭示出同样的生成模式。据研究人员发现,小鼠所患的恶性淋巴瘤有许多种都是起源于胸腺,而若是在这类肿瘤的早期阶段利用手术将胸腺摘除,就能防止身体的其它部位长出恶性淋巴瘤。与其相似的是,在小鸡长出另一种恶性淋巴瘤后,利用手术将其法氏腔上囊摘除,也能治愈这种肿瘤。显而易见的是,胸腺和骨髓两种淋巴器官的基本功能是截然不同的,看来它们分别负责生成彼此不同的一类免疫细胞。
60年代末期,研究人员已经查明,千细胞能够生成两大主要谱系的淋巴细胞(以及其它一些血细胞)。其中一个谱系即为B淋巴细胞,这类细胞起源于骨髓,能够产生抗体,在有外来异物入侵的情况下,抗体便能同异体蛋白质结合而示其所在,以供其它免疫细胞杀伤。它们可以抗击细胞外的病原体,例如细菌。另一个谱系由T淋巴细胞构成,它们全都起源于胸腺。T细胞除了负责对付结核杆菌一类细胞内寄生物外,还要负责抗击病毒一类细胞内病原体。此外,T细胞还能分泌称为淋巴激活素的淋巴因子,它们能够控制B细胞、其它T细胞以及免疫系统其余组成部分的活动。
两大类别的淋巴细胞一旦形成之后,便会转移到脾脏、淋巴结和肠系淋巴组织。到达各自的目的地后,这些淋巴细胞会和抗原(入侵的微生物或病毒的分子标记)遭遇,并会按指令采取行动。淋巴细胞平时总是持续不断地在全身血管系统和淋巴系统中循环,而为了巡查外来抗原,它们还会定期停止循环运移呆在各个淋巴器官中。
尽管研究人员初次推测动物体内存在干细胞还是早在1961年的事情,但他们在鉴别出真正的干细胞样品上,一度却没能取得多大进展,直到80年代初期才有所成功。当时,生物学研究人员明确地鉴别出B细胞、T细胞和骨髓细胞的前体细胞样品。这样,他们便能分离骨髓细胞,从而弄清楚在特定的生成克隆的细胞上,存在或缺少哪些表面蛋白质。后来,本文作者之一Weissman的实验室的科研人员仅从小鼠的全都骨髓细胞群的一小部分(大约1/2000)中,就发现了B细胞、T细胞及其它一些血细胞的前体细胞。结果证明,这些细胞全是干细胞。
对人类干细胞的探查研究,同样需要采用通过小鼠实验证明非常实用的几种技术方法。在这一研究过程中,Joseph M.McCune及其在斯坦福大学的同事创造了一种技术方法,事实证明,这种方法使研究人员能够检验这一小部分骨髓细胞,从而弄清其中是否含有真正能够进行自我繁殖的干细胞。McCune及其同事讲人类胎儿胸腺、肝脏、骨髓、和淋巴结植入一种小鼠体内,这些小鼠全都没有自身的免疫系统。结果,他们在小鼠体内成功地建立起一个能够有效运行的人类血细胞生成及T细胞生成系统。自从创造了这一成果之后,名字叫“希斯台来克斯公司”(SyStemisx),本文笔者之一Weissman同这家公司也有联系。
 。
。
希斯台米克斯公司的研究人员将所选中的人类干细胞植入上述这类小鼠体内,并得以证明,他们能够通过这一途径在小鼠体内重新建立起造血系统和免疫系统。有趣的是,事实证明,这些起源于人类的胸腺细胞同样容易受能引起艾滋病的人体免疫缺失病毒感染,而这种感染也会减少能被艾滋病破坏的同一种人类体循环免疫细胞。
干细胞会对来自其生存环境的各种指令(其中许多至今尚未查明)作出反应,从而分化成B细胞谱系或T细胞谱系。人们可以从胎儿体内发现这种现象,在胎儿体内,B细胞和T细胞之间的差别越来越明显。胎儿早期,干细胞会以多次明显可辨的高潮由造血器官向胸腺移行。一旦进入胸腺,这群群干细胞便会分裂和分化,结果先是导致接连生成多种T细胞,它们聚集于皮肤、各种体腔(如口腔和阴道)和与之相连的器官(如胃肠道和子宫等)的表层(即上皮);后又生成后面各代T细胞,这些细胞会通过循环转移到各个淋巴器官。
这些T细胞可以通过其表面携带的分子(即T细胞受体,简称为TCR)鉴别出来。此外,它们似乎是按一种非常明确的顺序产生出来的。早期生成的T细胞所携带的受体组分为所谓的γ链和σ链,而后期T细胞所带有的受体组分则是α链和β链。
例如,小鼠胎儿T细胞的第一次生成高潮通常出现在受孕后的13日至15日之间,并且这一批丁细胞所携带的T细胞受体均为所谓的γ3型。这些T细胞都要转移到皮肤,并在皮肤上起前卫作用,负责识别和杀灭已被感染、已癌变或受到其它损害的皮肤细胞。
第二次T细胞生成高潮总是出现在受孕后的15日至20日之间,此次生成的T细胞主要聚集到雌性生殖器官的表层和雌雄两性的舌表层。这些T细胞所携带的丁细胞受体均为所谓的γ4型。随后几次高潮所生成的T细胞主要转移到脾脏(所携带的T细胞受体均为γ2型)和胃肠道表层(所携带的T细胞受体均为γ5型)。
第一次和第二次高潮生成的这些T细胞都是在胎儿胸腺中产生的。在胎儿此后的发育期间和整个一生中,生存在胸腺中的干细胞主要分化成携带α-β受体的T细胞,即所谓的辅助性T细胞和杀伤性T细胞。
干细胞产生T细胞的这类高潮的先后次序,与编码不同类型的受体组分γ链的DNA出现于T细胞受体基因的先后次序是一致的。看来这些干细胞能够“读出”随动物年龄而定的发育程序。
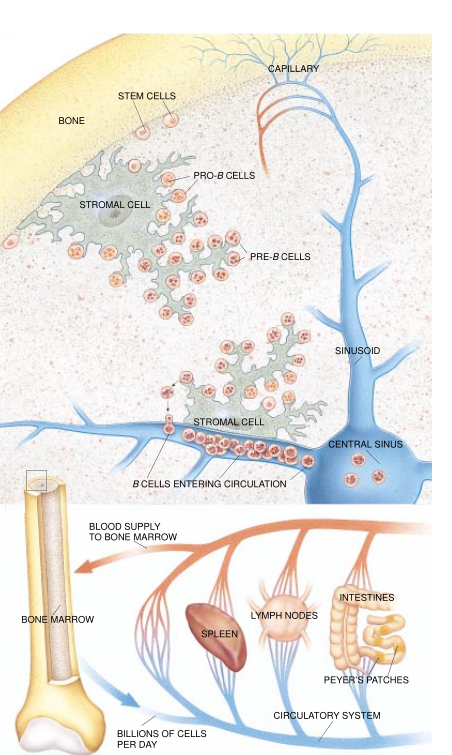
B细胞谱系的早期发育过程所依循的路径与T细胞相似,但没有那么复杂。进入B细胞路径的干细胞后代——B细胞,是在形成其它白细胞和红细胞的相同组织中进入这类路径的。在胎儿早期,B细胞是在肝脏内产生的,但后来产生B细胞的干细胞转移到骨髓中去了。
在胎儿肝脏中产生的B细胞,可能不同于后来在骨髓中形成的B细胞。早期在肝脏中产生的B细胞所生成的抗体能够和种类繁多的抗原结合,但其亲和力较弱。相反,后来在骨髓中产生的B细胞所携带的抗体亲和力则要强得多,但却只能和一两种抗原结合。看来B细胞要产生出种类齐全的抗体,就得利用多种机制,而这些机制则是在胎儿临近出生时才开始起作用的。成熟动物体内的每个B细胞的表面均带有一种独特的抗体受体复合体,B细胞正是利用它来识别某种特定的抗原的。
对于少数干细胞是如何能够产生出多种多样的B细胞的,科研人员现已掌握了大量的情况。干细胞在分裂并依循B细胞分化路径发展的过程中,会表达出多种表面蛋白质,而为了追踪探查干细胞的分裂和分化过程,研究人员现已通过实验掌握了鉴别多种表面蛋白质的技术方法。表面蛋白质这类起标示作用的分子是细胞同相邻细胞之间起相互作用时所要依靠的一种基本手段。因此,B淋巴细胞在成熟过程中,都要表达出多种不同的表面蛋白质。
促使干细胞后代——B细胞——进入B细胞路径而不是变成红血细胞或另一种类型的细胞——白细胞——的指令,似乎主要来自干细胞密接环境中的其它细胞。美国加利福尼亚大学洛杉矶分校已故的Cheryl Whltlock和Owen N.Witte在初次找到长期人工培养B细胞的方法时发现,对于B细胞的人工培养来说,基质细胞(骨髓中的大型膜状细胞)乃是必不可少的。基质细胞借助于表面蛋白质同B细胞的前体细胞——原B细胞——相互作用。此外,基质细胞还能产生可溶性蛋白质因子(如白细胞介素-7),而这些蛋白质因子则要同原B细胞和前B细胞上的受体结合,并向它们发出分裂和分化的指令。
原B细胞在分裂的过程中,开始一种进程,这一进程的最终结果是一种独特的抗体受体复合体的表达。首先,它们对编码免疫球蛋白轻链和免疫球蛋白重链的基因片断进行重排,而这两类免疫球蛋白链最后将组成一种抗体分子。一旦基因片断重排得以完成,这些基因便会自动地得到转录。
对于B细胞以后的发育来说,上述基因片断开始发挥有效作用的次序是至关紧要的。一般说来,指挥免疫球蛋白重链组装的基因片断都是最先重排出来并开始发挥有效作用的。(完成了上述过程的细胞便称为前B细胞。)随后,编码免疫球蛋白轻链的基因片断完成重排后,也开始发挥有效作用[参见本期Charles A.Janeway Jr.所撰“免疫系统怎样识别入侵者”一文]。
和原B细胞一样,前B细胞一旦形成,也开始产生两种附加白质,即所谓的免疫球蛋白和免疫球蛋白口(简称为Iga和Igf1),它们覆盖着整个细胞膜。免疫球蛋白重链和免疫球蛋白轻链两者都要同免疫球蛋白a和免疫球蛋白结合,共同组成一种抗原受体复合体,再向细胞膜表面转移。在细胞膜表面,这种抗原受体复合体能同抗原交相感应,然后将恰当的指令发回细胞核。前B细胞达到分化过程的这一阶段之后,便开始称为B细胞并进入血流进而转移到外周组织中。
这类B细胞群能对种类极多的抗原作出反应。为了指导免疫球蛋白轻链和免疫球蛋白重链的组装,每个原B细胞都要从为数1百万以上的候选对象中,才能选出1个基因片断组合。除此之外,每个处于发育过程中的B细胞都能改变基因拼接位点,以进一步提高编码抗原结合位点的DNA的变率。并且似乎是因为DNA的变率还不够高,每个发育中的B细胞在将基因片断拼接在一起的时候,甚至还能在基因片断接合处插入新的核苷酸。
发育中的B细胞借助于末端转脱氧核苷酰酶来改写其遗传密码。末端转脱氧核苷酰酶只在原B细胞核中表达,而免疫球蛋白重链的基因片断通常都是在原B细胞核中重排的。不过,有时候首先重排的是免疫球蛋白轻链的基因片断,这一情况是亚拉巴马大学伯明翰分校的Himmi Kubagawa发现的,他用EB病毒使早期B系细胞受到感染,由此产生出一种能够进行自我繁殖的人工培养物,其免疫球蛋白基因在上述这一早期发育阶段就被冻结了。结果他发现,处于这种状态的前B细胞只对其免疫球蛋白轻链的基因片断进行了重排,这些基因片断的接合处含有新的顺序,这就意味着在末端转脱氧核苷酰酶的活性被阻遏之前,免疫球蛋白轻链的基因片断就已经被重排过了。
至此为止,我们所探讨的都是B细胞的发育过程,因为我们似乎可以把这一发育过程当作所有B系细胞一旦涉足必将依循到底的一种路径。然而事实上,并不是所有B系细胞都要依循这一路径一直走到底。Dennis G.Osmond现在麦吉尔大学任职,当初他在对小鼠骨髓中处于原B细胞阶段、前B细胞阶段和B细胞阶段的细胞进行计数时发现,显而易见的是,半数以上的B系细胞还在前B细胞阶段就已经死亡了。
于是,研究人员据此推测,前B细胞除非接到了生存指令——来自相邻细胞的某种信使分子,否则便会死亡。这种能够通过接触使前B细胞继续生存下去的信使分子可能是同一种出现在晚期前B细胞表面的受体结合的。而这种受体则是由同所谓的代理性(surrogate)免疫球蛋白轻链复合体配成对的免疫球蛋白重链组成的。这种代理性免疫球蛋白轻链复合体不同于成熟B细胞所产生的抗原受体,是由其表达无需借助于重排的基因编码的。
科隆大学的Daisuke Kitamura及其同事在阻止上述这类受体表达时,发现B细胞的产生率降到了正常水平的1/10以下。而得以幸存下来的B细胞有可能就是那些早先就对自身的免疫球蛋白轻链基因片断作了重排的细胞,由于已对轻链基因片断作过重排,这些细胞便能在足够早的阶段产生出非代理性免疫球蛋白轻链,以代替所缺少的上述受体。
其它那些B细胞之所以死亡,并不是因为它们没有接收到能够促使其继续生存下去的信使分子,而是因为它们本来就带有能促使自身灭亡的成分。B细胞基因片断的某些重排过程会产生出对自体细胞有免疫反应的抗体,因而这些带有此类有害抗体的细胞必然会被消灭掉。
当新生成的B细胞初次同其生存环境发生相互作用时,这种负选择过程便开始发生了。这时会产生自体免疫反应的细胞会迅速遇到大量其抗体能够与之结合的抗原——其相邻细胞表面的分子。如果这种结合足够紧密,那么这种被结合的抗体受体就会向自体免疫反应性细胞内部发出指令,促其以所谓的“程序性细胞自灭”(apoptosis)方式自杀。不会对自体抗原做出强烈免疫反应的未成熟B细胞会继续存活和成熟。此后,已成熟的B细胞会对非自体抗原分子所产生的刺激做出免疫反应。这一基本规律最初是利用注入了未成熟B细胞免疫球蛋白M受体抗体的小鸡和小鼠得到证实的。实验结果表明,在B细胞发育阶段的早期,注入上述受体抗体会抑制B细胞的发育,而以后再注入这种受体抗体则会促进B细胞的发育。在B细胞发育阶段的早期,上述抗体受体所发出的指令,会激活能够分解细胞核DNA的酶,从而引起程序性细胞自灭。因而事实上没有一个会产生自体免疫反应的B细胞能够继续存活直至成熟。

幸免于这种负选择过程的克隆B细胞会转移到外周淋巴组织中去,最后在这种组织中开始其生命史上的功用发挥阶段。在受到抗原和T细胞的刺激之后,它们最终有可能返回骨髓,开始其最后的成熟过程,直至变为能够分泌抗体的浆细胞。
T细胞的发育路径则比B细胞要略微复杂一点。胸腺中并入这一发育路径的干细胞最后成熟后,有可能分化成多种不同的T细胞,其中包括辅助性T细胞和杀伤性T细胞。
T细胞在发育过程中要历经多次筛选。其中第一次筛选的目的在于检验其识别由其它细胞提供的抗原的能力,而这种能力对于免疫细胞功能的正常行使来说乃是必不可少的。所谓的主要组织相容性复合物(major histocompatibility complex,简称MHC)分子将蛋白质抗原的片断抓住,以提供给T细胞。主要组织相容性复合物分子分为两大类,即MHCI和MHCI1。胸腺中处于发育阶段的T细胞会对自身周围的环境进行探查,以确定自身能否识别任何自体主要组织相容性复合物。如果能够做到这一点。这类T细胞就能继续存活;若是不能,T细胞就会死亡。
一旦处于发育过程中的T细胞能够通过这次筛选而得以继续存活,就会面临第二次筛选,而在此次筛选过程中,凡是那些带有对机体自身组织反应过于强烈的受体的T细胞都会死亡,在这一点上,T细胞的情形和B细胞没有什么两样。最后,只有那些所携受体既能识别外来抗原,又能识别自体主要组织相容性复合物的T细胞,才能够活着离开胸腺并驻留在机体的各个部位。
免疫学家为了弄清楚丁细胞发育过程的各个环节,首先着手查找由前体干细胞转变为移行T细胞的路径。为了探查细胞谱系之间的各种关系,免疫学研究人员利用带有容易识别的标记物的干细胞及其子细胞进行研究。他们将处于各个不同成熟阶段的这两类细胞植入小鼠的胸腺,而小鼠胸腺中的细胞则未携带这类标记物。在等待了数小时乃至数日之后,研究人员就能查明,他们所植入的这类干细胞所产生的究竟是什么样的子细胞。
在发育过程早期阶段被植入的胸腺细胞实际上根本没有在其表面表达出共同的细胞标记物:共同的CD4受体蛋白质几乎或完全没有,并且既缺乏T细胞受体复合体,也没有共同的称为CD8的受体蛋白质。(CD8同MHCI结合,而CD4则同MHCII结合。)然而,在植入一日后,这类带有可识别标记物的干细胞就已进行过自我繁殖,并已繁殖出其它类型的干细胞,这类干细胞都带有CD8,但却没有带CD4或丁细胞受体(处于发育过程类似阶段的人类胸腺干细胞表达出CD4,但却未表达出CD8或T细胞受体)。这类细胞本身随即又分裂成带有CD4、CD8和少量T细胞受体的子代细胞。这一阶段事实上是T细胞的前体细胞在其表面表达出T细胞受体的第一阶段。CD4在发育过程的这些早期阶段的表达可以解释人体免疫缺失病毒对T细胞造成致命损害这一现象:据认为,人体免疫缺失病毒要同CD4分子结合,因而可以藉此对这类早期胸腺前体细胞进行攻击,从根本上消灭其整个系列的子细胞[参见本期Wamer C. Greene所撰“艾滋病与免疫系统”一文]。
这类细胞在产生分裂和改换表面蛋白质的过程中,也要对其基因进行重排,以产生丁细胞受体。例如,小鼠T细胞受体链的组装和胞面表达,就是在其表达出CD4和CD8之时或之前进行的。这类前体细胞随时准备同胸腺中带有主要组织相容性复合物的细胞相互作用。大多数同MHC1分子结合了的这类细胞都将成为杀伤性T细胞,而大多数已同MHCI1分子结合的这类细胞,则将成为辅助性T细胞,其中只有一部分也会成为杀伤性T细胞。(而那些未同任何一类主要组织相容性复合物分子结合的这类细胞,则注定会缩小和死亡。)
一旦进入了某条发育路径,处于发育过程中间阶段的细胞都会停止产生它们将不再应用的那些类型的受体(无论是cD8还是CD4).并会表达出另外的T细胞受体。此外,它们还要产生“寻的就位受体”,这类受体能使它们脱离血流,进入外周淋巴器官。最后,它们一旦成熟,就会离开胸腺。
当然,并不是所有有可能发育成T细胞的细胞都能走完这条发育路径。有些细胞会受到负选择,而一旦进入这一过程,来自其它细胞(那些所带抗原已同自体主要组织相容性复合物分子结合的细胞)的指令便会导致程序性细胞自灭。据推测,胸腺中的细胞能够引起正选择或负选择,而究竟引起哪一种选择,则要看细胞来源于早期胎儿组织的哪一层——内胚层、中胚层或外胚层。而胎儿胸腺异于其它淋巴器官之处,就在于胸腺内存有来源于所有这三种胚胎组织的细胞。
在特定的干细胞开始分化为B细胞或T细胞之时,细胞的路径也出现了分歧,而此时此刻,它们又重新在外周组织中会合到一起。而一旦细胞所携带的受体因与外来抗原相遇而产生反应,B细胞和T细胞发育过程中余下的多数阶段就都会接踵而至。
在各个淋巴器官中,已经成熟但尚未参与免疫应答的T细胞和B细胞驻留在相互隔离的区域内。免疫细胞受到抗原刺激后,那些即将参与抗体生成的细胞就会历经一系列复杂的相互作用,从而形成称为生发中心的新型结构。
淋巴器官内T细胞区和B细胞区之间的界面处的生发中心中,聚集着三种类型的细胞,即已被激活的辅助性T细胞、B细胞和树状细胞(—种提供抗原的细胞)。随着与这类抗原的遭遇,一些B细胞将会增殖,不久以后,这些B细胞的克隆就会形成生发中心内细胞群体的大部分。
上述B细胞在增殖的过程中,还会发生分化和变异。它们会对自身基因片断的DNA进行修饰,以生成虽与同上述抗原结合者类似,但反应却有可能更为强烈的抗体。这类B细胞中的一部分会和辅助性T细胞相互作用,随后生成浆细胞。浆细胞有好几种类型,它们所产生的抗体都能对同一种抗原作出反应,但所引起的免疫应答则不相同。而其它的B细胞则将变为所谓的记忆细胞。这类细胞不会直接参与机体的免疫应答,而是利用分子对过去进入机体的入侵物保留一份记录,以促使机体将来尽快作出免疫应答。
虽然机体的免疫应答是在各个淋巴器官内形成的,但淋巴细胞并不是单纯驻留在淋巴器官内等候机体的召唤。1959年,英国牛津大学的James L.Gowans及其同事通过实验得以证明,免疫细胞在血流和淋巴器官之间反复循环。这一循环过程使每个淋巴器官都能迅速抽查所有淋巴细胞,从而查获带有特定抗原受体的淋巴细胞,而通常情况下,正是这类抗原在引起机体的注意。
处于循环过程中的淋巴细胞通过一种特化性血管——多斑内皮微静脉(high endothelial venule,因其管壁表面杂有许多斑点而得名,简称HEV)——进入各个淋巴器官。只有淋巴细胞能够穿过多斑内皮微静脉,因为它们所表达的寻的就位受体能和多斑内皮微静脉管壁上的受体匹敌。这类受体看来分为两种类型,一种以淋巴结为就位目标而发挥作用,另一种则能够同胃肠道淋巴器所表达的表面分子匹敌。
T细胞和B细胞被激活后,就会迅速停止产生通常那种寻的就位受体分子,转而恢复生成另一种整合蛋白(integrin)——它们在自身发育过程早期阶段产生的一种分子。这种分子同一种血管细胞粘附分子(vascular-cell adhesion mole-cule,简称VCAM)——VCAM-1——结合(骨髓基质细胞和胸腺内壁上皮细胞也有VCAM-1存在)。结果,这类已激活的细胞在被释放到血流中时,就不再穿过正常淋巴器官的多斑内皮微静脉管壁,而是自动转向服务于感染组织、炎症组织和带抗原组织的血管。这类炎症部位的血管会表达出VCAM-1,而其它部位的血管则不会这样做。已被激活的T细胞和B细胞在恢复生成于发育过程早期阶段产生的整合蛋白分子之后,就完成了其最终使命。
本文已对免疫系统多种细胞的发育成熟过程作了一番简要的叙述,但并没有说出其全部情况。例如,还有其它一些粘附分子也与淋巴细胞和内皮细胞或基质细胞之间的相互作用有关。事实上,对于细胞接收指令—促其发生程序性自灭、继续存活或增殖分化的指令——所凭借的手段,研究人员至今还有许多情况需要了解。
其中有一个需要弄清楚的重要问题,即干细胞在进行自我繁殖和生成将要发育成特定的谱系的子细胞两者之间,是怎样做出选择的。这个问题所具有的意义并不只是理论上的。若是事实证明,干细胞能够有助于消除先天性免疫缺陷或者获得性免疫缺失,能在试管中或机体内增加干细胞数量的方法,就有可能为患者增加康复的机会。此外,干细胞显然可以作为基因疗法的利用目标,采用这种疗法,可以将干细胞有缺陷的基因替换掉,或者赋予这类细胞的子细胞在危险环境中存活的能力,例如使之能够在带有人体免疫缺失病毒的患者体内生存。
除此之外,随着研究人员对干细胞发育成已激活B细胞或T细胞的路径的认识愈加深刻而全面,在治疗因上述发育路径出现危险错误而导致的各种疾病上,他们将会取得进展。若是对于免疫细胞的生长分化至关紧要的基因出现先天性或获得性缺陷,就有可能导致免疫缺陷或者淋巴癌。
先天性基因缺陷能够在多个不同的阶段阻断T细胞或B细胞的发育,至于在什么阶段发生阻断,则取决于上述这类基因所生成的产物。例如,编码腺嘌呤核苷脱氨酶(ADA)的基因缺陷会使毒性代谢产物积聚在骨髓和胸腺内,使得淋巴细胞无法分裂和合成DNA。患有这种缺陷的婴儿因体内缺乏细胞和B细胞而对感染缺乏免疫力,这种疾病的名称——严重综合免疫缺损症(severe combined immunnodficiency disease.简称SCID)——即由此而来。美国明尼苏达大学医学院的Robert A.Gcod及其同事在充分认识了干细胞的作用这一基础上,通过实验证明,将身体健康、组织相容的同胞骨髓植入患者体内,就能治愈严重综合免疫缺损症。然而,令人遗憾的是,这种病症的大多数患者都找不到合适的骨髓供给者。不过,美国国立癌症研究所的Michael R.Blaese及其同事已经找到了成功的转机,他们把功能正常的腺瞟呤核苷脱氨酶基因植入有基因缺陷的T淋巴细胞内,使患者免疫系统的一个必要环节得到了修复。
去年上半年,研究人员发现了另外三种免疫缺损症的致病基因。这类基因全都在x染色体上,因而患者全系男性(患者仅具有一份x染色体所携遗传信息的拷贝),其中每一种基因都会对免疫系统的发育造成不同程度的损害。一种病症是发出促前B细胞生长发育指令所必需的蛋白激酶基因产生了突变,在这种情况下,患者体内会完全缺乏成熟的B细胞及其分泌的各种抗体。另一种免疫缺损症也是由蛋白激酶基因突变,在这种情况下,组成白细胞介素-2这种生长因子受体的三种链之一的基因产生了突变。这种基因缺陷会阻碍辅助性T细胞的发育,从而使B细胞无法成熟为浆细胞。第三种(有待于阐明的)免疫缺损症是由编码表面蛋白质分子的基因缺陷导致的,而T细胞和B细胞之间的相互作用正是通过这类表面蛋白质分子而得以产生的。患有这种基因缺陷的男性的CD40分子或其受体是畸形的,患者只能产生免疫球蛋白M抗体,并且缺乏必要的指令,因而无法促使B细胞分裂和产生其它类型具有高亲和力的抗体。

研究人员一旦鉴别出这类基因,就有可能找到治疗这类免疫缺损症的基因修复疗法。这三种基因缺陷几乎是在同一时间由几个研究小组分别发现的,因而人类对免疫系统的发育和功能的认识了解,有可能达到一个必要的水平,这样,人类就还有可能早Et发现其它免疫性疾病的遗传基础,从而在临床诊治上迅速取得重大进展。
尽管淋巴癌的致病原因也是基因存在缺陷,但这类疾病有好几个方面不同于免疫缺损症。最重要的一点是,发生淋巴癌的必要条件,是多次突变的累积,其中的每一次突变均以细胞的成熟和自然死亡为代价,促使细胞过度增生和存活。而复杂的多细胞生物已经通过进化在自身机体内形成了许许多多的“检测卡”,用于监测自身细胞的生长存活状况。
多细胞生物体内的恶性突变程序要想逾越这种复杂的防御体系,通常必须先从干细胞或其直接的克隆子细胞下手,使其恶变克隆能够逐步形成,这样才能逃避上述所有免疫检测机制。即使某个人因遗传关系而带有某种注定会导致癌变的基因,患者体内具有遗传缺陷的细胞要恶变为癌细胞,也还必须在其存活期内,多次发生额外的突变。然而,一旦发生了一次促缺陷细胞生长存活的突变,突变的机会便会增多,细胞就有可能存活足够长的时间而又一次发生促细胞生长的突变,并进而发生第三次甚或第四次突变。
人们可以从囊状淋巴瘤(fdlicular lymphoma)看出上述这一致病机理,这是一种由生发中心的B细胞恶变形成的一种症,病程发展极为缓慢。实际上,所有的囊状淋巴瘤都包含着一种称为bcl-2的易位基因,它所产生的信使分子能够防止发生程序性细胞自灭。在被激活的B细胞不能识别抗原或未能重组其小基因而无法生成自体免疫抗体的情况下,这种易位基因通常是关闭着的,然而就囊状淋巴瘤细胞而论,这种基因位于B细胞中一种打开的抗体基因近旁,因而保持着无限的活性。上述这一多步恶变过程还可以解释为何B细胞癌变率会四倍于T细胞。在人的一生中,骨髓中的干细胞总要不断产生出B细胞(因而就有了多年时间来累积突变)。相反,大部分T细胞均产生于生命的初期,而随着人的衰老,产生干细胞的胸腺功能逐步衰退,使得胸腺产生的干细胞越来越少,干细胞的子细胞——T细胞——突变的机会也就更少了。
发生生物学家和分子生物学家一旦揭开了导引于细胞及其复杂的子细胞谱系的指令之谜,就有可能从体外操纵免疫系统的发育,而临床医师则有可能增强患者机体对入侵物的免疫应答,减轻免疫细胞对机体自身的损害,矫正或消除那些不经处理就会繁殖出癌细胞家系的细胞。
请 登录 发表评论