人体的免疫系统已经进化成了一些精巧的机制,使机体得抵制外来的入侵者,但不会攻击机体自身。
有机体具有多种机制可把其自身和任何外来物区别开来。例如,许多植物都有坚硬的外壳。这样的外壳不仅能保护其自身免受侵害,而且还能限定植物的外周尺寸。酵母具有接合型基因,用编码可防止相似细胞间接合的蛋白质。海绵有一组基因,其产物可用来察觉和抵制与其相异的群体。
人体已经进化成了可把入侵者与自身区别开来的最精巧的机制。人体免疫系统的细胞——淋巴细胞、巨噬细胞等——必须学会耐受机体里的任何一种组织,任何一种细胞和任何一种蛋白质。它们必须能把出现在血液里的血红蛋白、由胰腺分泌的胰岛素、眼睛里包含的玻璃体液和其他任何东西区别开来。它们必须能设法抵制无数类不同的有机体,但不攻击机体。
免疫学家一直在致力于研究有关机体怎样学会耐受自身的问题,但只是在最近的十几年里才详细地了解到是什么东西在阻止最主要的淋巴细胞——T细胞和B细胞——攻击其宿主。许多未成熟的淋巴细胞都可能对其自身的产物作出应答,从而造成对机体的威胁。机体凭借几种非常精巧的过程设法使自己摆脱这些未成熟的淋巴细胞。如果某个免疫细胞在胸腺或骨髓里发育时就对自身产物作出反应,那么它通常会被杀死或丧失活力。如果一个成熟的淋巴细胞对自身产物作出应答而没有接收到第二个化学信息,那么它也会遭受同样的命运。机体用来消除自体反应细胞的这些基本策略变化多端,因为有许多种淋巴细胞和许多种自身产物。
尽管免疫系统有了这些安全措施,仍会有一些自体反应的淋巴细胞没有丧失活力或者被杀死,因而可能引发某种严重的自体免疫疾病。免疫学家们都很清楚,如果他们了解了决定耐受性的所有机制,他们就能预防自体免疫病。此外,这方面的知识还能有助于外科医生去继续寻求可用来防止免疫系统排斥被移植组织(如肾、心脏和肺)的试剂。
高等脊椎动物有许多能够发现和消灭入侵者的方法。其中有一些相对来说是非特异性的。它的依据是传染细菌制造的化学物质不是高等脊椎动物大量生产的。例如,哺乳动物能够发现入侵细菌的存在,因为细菌会产生一种以不常见的氨基酸——甲酰蛋氨酸——为起点的肽,而哺乳动物只能产生极少量这样的肽。在哺乳动物体内,高浓度的含有甲酰蛋氨酸的肽确实会吸引中性白细胞。这些中性白细胞被吸引后就会吞噬掉产生这种肽的细菌。与此相似的情况是,哺乳动物的免疫系统能够发现某些病毒,因为这些病毒的双股RNA产量比哺乳动物要多得多。大量的双股RNA诱发哺乳动物细胞产生一种叫做干扰素的蛋白质。这种蛋白质反过来会激发一系列反应,协助宿主去阻止病毒的进一步感染。
虽然这些细菌和病毒制造的化学物质作出的非特异性应答确实是免疫系统至关重要的一部分,但是脊椎动物还需要能够辨认出特异性入侵者的机制。免疫系统必须能够识别化学性与其自身分子只有细微差别的外来产物。
免疫系统已经进化成了三种能识别外来化学物质(即所谓抗原)的精巧方法。这些机制的基础是出现在淋巴细胞上的三类受体蛋白。第一种方法需要拥有受体蛋白(免疫球蛋白)的B细胞;第二种方法依靠拥有称为蛋白的受体蛋白的T细胞;而第三种方法则利用拥有蛋白的T细胞。
许多受体都粘附在每个淋巴细胞的表面,而且在特定的条件下都会与抗原结合。每个受体都由两条不同的多肽链组成:免疫球蛋白由一条轻链,一条重链组成;α-β蛋白由α链和β链组成;而γ-σ蛋白,正如读者定能猜到的那样,是由γ链和σ链组成的。每条链的顺序因细胞而异。例如,任何一个特定的T细胞的α链和β链和其他任何一个T细胞α链和β链总是不同的。因此,任何一个特定的T细胞的受体所能结合的物质必将不同于其他T细胞,人体拥有上亿个T细胞,因此有许许多多不同的a分子适于识别外来的物质。
的确,当人们想到T细胞有那么多的受体。同样,B细胞也有那么多的免疫球蛋白分子和T细胞也有那么多的受体,难免会感到很奇怪,为什么没有一个淋巴细胞会识别其自身宿主的产物呢?这一值得注意的现象几十年来一直是研究人员感兴趣的问题,而且已经提出过许多理论来解释人体免疫系统是怎样学会耐受机体的细胞的。
最初的设想之一是动物只是不可能制造进行自体反应的淋巴细胞受体。特别是人也许没有为产生可能和人体蛋白起反应的。受体所必需的基因。免疫学家们多年来已经知道这一解释是不正确的。现在我们知道正因为受体的组分和结构是以某种方式随机地确定的,所以有些受体也许能够结合其宿主的化学物质。
随机性至少是通过两个途径引发的。淋巴细胞的受体是由特异的基因片段随机地组合成的。例如,T细胞的α链和β链是V-α,J-α,V-β,D-β和J-β等基因片段随机地混合而成的。第二,DNA的短的随机的片段被引入编码受体的组配基因。因此,有机体不能绝对地控制受体的整个氨基酸顺序。
控制作用必定是以另外的方式,在另一个阶段里实现的。加州理工学院的Ray D. Owen是最早检验这一假设的研究者之一。1945年。当时他正在研究牛血型的遗传。他发现共有一个胎盘的孪生母牛很可能具有同一种血型。甚至在一例异父同母的几对孪生母牛中也出现了类似的相关性。Owen得出了这样的结沦,即血型是淋巴细胞和其他血细胞在子宫里交换的结果。此外,他还指出,这一早期的交换防止了母牛血细胞的相互排斥。后来,伦敦国家医学研究所的Peter B.Medewar爵士,Rupert E.BiIIing.ham和Leslie Brent证明,如果把成年小鼠的血细胞移植给无亲缘关系的新生小鼠,这头新生小鼠在其一生中就都能够接受该成年小鼠的皮肤移植。由此可见。在出生时注入血细胞可以影响该个体接受血细胞以及皮肤的能力。
最重要的是,这项研究工作和Owen的研究都导致一个同样广泛的结论:免疫系统并非生来就具有识别其宿主产物的全部指令的,而是在其发育过程中学会识别什么是自身的。
用来解释免疫系统怎样学会耐受机体自身的最早几种设想之一是由现任职于洛克菲勒大学的Joshua Lederberg提出来的。他于1959年指出,未成熟的淋巴细胞是以不同于成熟淋巴细胞的方式对抗原作出反应的。通常,如果某种东西与成熟的B细胞的免疫球蛋白结合,这些淋巴细胞就会改变成分泌抗体的细胞;如果一个分子粘附到成熟的丁细胞的受体上,这个淋巴细胞就会变成分泌细胞信息素的细胞或杀伤细胞。Lederberg推测,如果某个抗原结合到某个未成熟细胞的受体上,这个细胞就可能死亡而不是被激活。
Lederberg的假设——现在被称为“克隆缺失理论”——提出了可消除那些与自身产物起反应的淋巴细胞的一种机制。这一过程是以下列方式进行的,在个体的整个一生中都在不停地生产T细胞和B细胞,尽管在青春期后T细胞的生产速度可能减慢。不管T细胞和B细胞是在什么时候产生的,它们总是在其宿主所产物质的包围之中发育的。根据“克隆缺失论”的说法,凡是受体识别了自身产物的未成熟细胞都要死亡。因此,只有不起自体反应的淋巴细胞才能发育到成熟。可以肯定,如果未成熟的淋巴细胞结合了外来的抗原,它们也理应死亡。但是,在受此感染前成熟的淋巴细胞则将实现免疫应答。
在“克隆缺失沦”推出后过了一段时间,研究人员对免疫系统怎样学会耐受其宿主的问题又提出了两种似乎合理的解释。一种解释是,正在发育的淋巴细胞当其受体卷入后,也许是永久地丧失活性,而不是死亡(免疫学家们把丧失活性的淋巴细胞称为“无反应性细胞”。)另一种假设认为,自体反应的T细胞和B细胞被一类叫做抑制性细胞的淋巴细胞压制了。
多年来,研究人员一直在致力于辨明这三种假设。淋巴细胞显然极善于识别外来的组织。例如,人体会迅速排斥取自无亲缘者的皮肤移植物,但是个体却能很好地接受由其机体的这一部分移植到另一部分的皮肤组织。同样,在培养皿里,淋巴细胞不会被取自其宿主的另一些细胞所激活,但对取自另一个体的淋巴细胞或其他细胞却会作出强烈的反应。尽管如此,仍然留下一个悬而未决的问题:免疫系统不能对自身产物作出应答,是否只是因为那里没有能作出反应的淋巴细胞,或是这些细胞被其他细胞抑制了呢?
为了解决这一问题,研究人员曾试图发明一种方法,用来鉴别那些能识别特定的抗原,但又在应答后不一定会分裂的淋巴细胞。后来发现要发明这种技术是一项使人望而生畏的任务。如果某个动物的丁细胞和B细胞从未接触过特异的抗原,那么必定只有一小部分淋巴细胞有可能对此抗原作出反应。据免疫学家们讲,反应细胞的“频率”大约是百万分之一。这一频率确实低得几乎不可能去把极少几个也许会识别自身产物的淋巴细胞和许多不会这样做的淋巴细胞区别开来。
尽管如此,研究人员最近还是研究出了两种能解决这个问题的实验方法。第一种方法需要有一种独特的抗原(叫做超级抗原),而第二种方法则要利用经基因工程改变后的动物(叫做转基因小鼠)。超级抗原法和用转基因小鼠进行的实验都将在下文作较详细的描述。
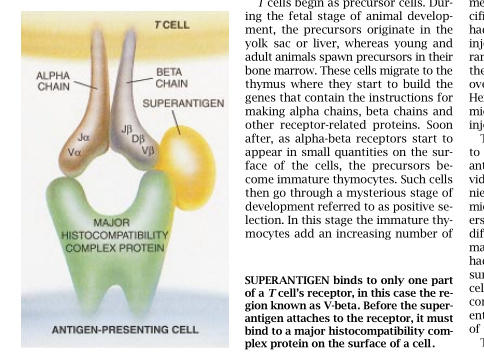
是超级抗原还是抗原将和淋巴细胞结合,这最终要取决于受体的组成和结构。例如,α-β受体是V-α和V-β这样一些片段的随机组配。这种受体的设计主要是为了识别外来肽,即入侵有机体的蛋白质被分解后形成的抗原。但是,这种受体只结合早已粘附在一种组织相容性复合物(MHC)蛋白上的外来肽。(MHC蛋白是出现在普通细胞表面上的特异性分子。)迄今为止,研究人员只能告诉我们,α-β受体所有可变的片段都在结合MHC蛋白和被它捕获的外来肽中起作用。T细胞为了识别特异性抗原,必须具备可变片段正确组合的受体。
超级抗原则完全是另一同事。超级抗原和它们普通抗原一样都要粘附到某个特定型的MHC分子上去,但是它们然后又会去结合α受体的一个特异的V-β片段,而几乎不管这个受体其余部分的结构是什么样的。正因为与不同类型的α-β受体的数量相比不同类型的V-β片段的数量很少,所以能识别特定的超级抗原的丁细胞比能鉴别特定抗原的丁细胞要多得多。例如,在小鼠体内,不同的VV-β片段总共大约有20个,因此在每20个具有受体的T细胞里大约有一个T细胞可能出现特定的V-β片段。

最重要的是,正因为有那么多的T细胞会对特异的超级抗原作出应答,所以研究人员能够观察到这种反应。为了做到这一点,他们首先要得到一个能够结合超级抗原的V-β靶子的抗体。然后用一个能在紫外线下发出荧光的分子标记这一抗体,因此,这个能发出荧光的抗体将结合对超级抗原作出应答的细胞。这样一来,研究人员就能够利用显微镜或荧光激活的细胞分拣器来鉴别这些细胞。
研究人员为了检验这项技术,首先利用了小鼠乳汁肿瘤病毒产生的超级抗原。小鼠通过其母亲的乳汁感染此病毒。这种病毒随即侵犯淋巴细胞,制造超级抗原和刺激淋巴细胞。小鼠乳汁肿瘤病毒和引发艾滋病的病毒一样,是一种反转录病毒。这类病毒含有由RNA制造的基因,但是它们是依靠制造其RNA的DNA拷贝来增殖的。把这种DNA插到受感染细胞的DNA中去。这样一来,这种病毒DNA就会产生病毒RNA和蛋白质——这种物质能组配成新的感染性病毒。
反转录病毒是偶尔会感染产生精子和卵子的细胞。如果发生这样的事,这种病毒就会变成动物后代的DNA的一部分而停止成为感染性病毒。实际上,几乎所有的小鼠都有一个或几个已经整合进其DNA中去的乳汁肿瘤病毒。这些病毒整合物然后会产生一些蛋白质,而这些蛋白质实质上就是自身产物。这些小鼠终其一生都会不断地制造这种病毒蛋白质,和地地道道的自身产物一样。
我们和我们在丹佛的国家Jewish免疫学和呼吸医学中心的同事们利用由这些病毒整合物产生的超级抗原检测了免疫系统是怎样对自身产物作出应答的。因为,就这些小鼠来说,这种由此类整合体制造的蛋白质都是自身产物。1988年,我和其他几个研究小组着手检验由MTV-7制造的超级抗原。(MTV-7是自然地整合到某些小鼠的DNA中去的乳汁肿瘤病毒株。)这种超级抗原对小鼠T细胞受体上的某些V-β片段作出了反应。具体地说,这种超级抗原能结合V-β6,V-β7,V-β8.1和V-β9等片段。
我们和当时在巴塞尔免疫学研究所工作的Uwe Staerz合作把研究重点放在MTV-7超级抗原对V-β8.1的影响上。我们发现,在DNA没有MTV-7的小鼠体内,有多达8%的T细胞有V-β8.1作为其受体的一部分;而DNA中含有MTV-7的小鼠则没有一个含V-β8.1的成熟的T细胞。与此同时,据瑞士的研究小组(包括洛桑的路德维格癌症研究所的H.Robson MacDonald和苏黎士大学的Rolf M.Zinkernagel和Hans Hen garttier在内)报导,在DNA有MTV-7的小鼠体内也没有携带V-β6细胞。最近,国家Jewish研究中心在V-β9方面也得到了类似的研究结果,而我们在V-β7方面也有同样的发现。
所有这些实验都证明,由整合进的MTV-7制造的超级抗原会以某种方式使能和超级抗原起反应的T细胞消失。既然是这样,那么,能识别自身产物的T细胞不是被其他细胞灭活了就是被抑制了。那里简直就没有T细胞,因此必定是在其发育的某个阶段死亡了。
T细胞是由前体细胞开始的。在动物发育的胎儿阶段,在卵黄囊或肝里产生前体细胞,而幼年的和成年的动物则在其骨髓里产生前体细胞。这些细胞迁移到胸腺,在那里开始组成基因,这些基因含有制造α链、β链和其他与受体有关的蛋白质的指令。此后不久,当细胞表面开始出现少量受体时,这些前体细胞变成未成熟的胸腺细胞。这些细胞后来就通过发育的一个神秘阶段(叫做正选择阶段)。在这一阶段,未成熟的胸腺细胞在其表面添加上越来越多的α-β受体。
但是正如我们所发现的那样,如果某个未成熟的胸腺细胞识别了由被整合的MTV-7产生的超级抗原,它就要死亡。现在,对不同动物进行的许多试验都证明,超级抗原能使未成熟的胸腺细胞在其发育大约完成一半时死去。

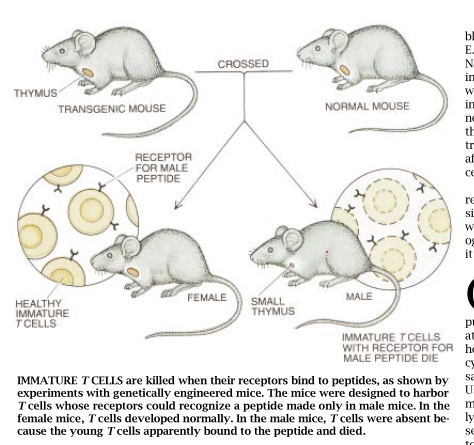
尽管上述研究结果有力地支持了“克隆缺失论”,但在当时,免疫学家们仍不得不认为具有那么多特异性肽的超级抗原有可能不是通过正常抗原的方式去影响T细胞的。因此,Haraid von Boehmer和Michael Stein metz以及他们在巴塞尔的同事,还有Hoffmann LaRoche用另一种完全不同的方法研究了自体耐受性的问题。他们利用了转基因小鼠。把DNA注进受了精的小鼠卵中后得到了这种小鼠。这样的DNA常常会被整合迸发育中的胚胎的DNA中而传递给后代。
Von Boehmer和他的同事们利用这一技术刨造出了大部分T细胞都具有同样的α-β受体的小鼠。为了搞清楚他们是怎样做到这—点的,人们必须知道当前体细胞在普通的小鼠体内发育时,这些前体细胞实际上制造的是能产生某一特定α受体的DNA。编码这一受体的DNA的碎片包含在所有小鼠细胞的DNA里,但是这些碎片只是在发育中的T细胞里重新排列成具有功能的基因。Von Boehmer分离出了早已重排好的编码特定的α受体的那个基因。然后,他把这个重排的DNA注入小鼠卵中。在小鼠发育的同时,这一重排的DNA占了未重排的受体基因的上风。因此,转基因小鼠体内的T细胞带有由注入基因产生的受体。、
Von Boehmer选定制造的是应能结合只在雄性,小鼠体内呈现抗原的那种受体。这一受体证明该抗原伴随有MHC蛋白Db。他和他的同事们在这些制造Db的小鼠身上,正如预期的那样,发现雌性小鼠和雄性小鼠之间确有不可否定的差异。在雌性小鼠体内,许多T细胞在其表面具有导入的受体。而在雄性小鼠体内,则几乎完全没有携带该受体的细胞,这些细胞显然在胸腺里,在其发育的早期阶段就遭破坏了。
上述研究结果表明,Lederberg提出“克隆缺失论”是正确的。未成熟的淋巴细胞要通过一个其受体如进行结合就会导致其死亡的阶段。自体反应细胞在有机会增殖和损伤其宿主之前就被杀死了。免疫系统确实能利用克隆缺失以形成对自体的耐受性。
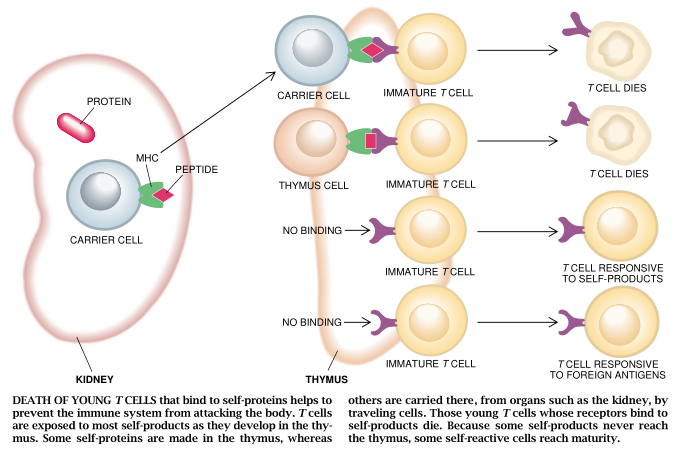
遗憾的是,克隆缺失论没有涉及关于免疫系统怎样学会耐受胸腺不制造的或者产量极少的那些自身产物的。这不仅关系到相对来说是多价整合的蛋白质(如在脑或眼里制造的蛋白质),而且也关系到只在某些特异组织里制造的蛋白质。
事实上,这类不同寻常的自身抗原中有许多是被输送到胸腺去的。单核白细胞和B细胞能够吸收机体某一部分里的蛋白质并把它们带到机体的另一部分,特别是带到胸腺里去。这一类过程可以很好地说明免疫系统是怎样学会耐受不在胸腺里产生的许多自身产物。
但是这一概略的说明不适用于所有的情况。例如,它不能解释T细胞是怎样学会耐受与MHCI蛋白质相结合的那些肽的。这些蛋白质只粘附由来自在细胞内自我制造的那些蛋白质的肽。单核白细胞和B细胞不能把其他细胞的肽送往胸腺。因此,胸腺里未成熟的T细胞没有接触到细胞质的蛋白质而无法学会去耐受它们。肯定还有另一个机制在起作用,这个机制或是杀死成熟的T细胞,或是使其丧失活力,或是将其抑制。
研究人员探索了成熟的T细胞可能赖以学习耐受性的机制。现在,有几项不同的实验已经证明,当成熟的T细胞遇到自身产物时,它们或者死去或者丧失活力。
其中的一项实验是由Jacques F.A. P. Miller和他在澳大利亚Walter and Eliza Hall医学研究所的同事们进行的。他们利用编码MHCI蛋白(叫做Kb)的基因作了研究。他们把这一基因注入小鼠体内,使其受胰岛素基因的控制。因此,小鼠只在其通常制造胰岛素的细胞,即胰腺的口细胞里制造Kb。正因为这些细胞是不移动的,所以Kb无法找到其通向这些小鼠的胸腺去的道路。因此,毫不奇怪,这些小鼠的胸腺细胞有可能结合Kb。但是,成熟的T细胞未能产生应答,除非它们在非常特殊的条件下与Kb 遭遇。这些结果表明,能够识别自身抗原的那些成熟的细胞有时能在动物体内存活,但是会变成无反应性的。此外,在另一些实验里,Susan Webb和她在加利福尼亚拉乔拉的Scripps研究所的同事们证明,在某些情况下,成熟的T细胞接触到自身抗原后即死亡。
免疫学家们并不确切地知道是什么因素促使成熟的T细胞死亡而不是丧失活性。也许失去活力的T细胞正是它们走向死亡的前奏。不管怎样,重要的结局是这些细胞不能应答。现在,研究人员已经收集到如此之多的关于抗原导致T细胞死亡或丧失活力的例子,以致他们都在苦苦思索,入侵的有机体的抗原为什么和在什么时候激活T细胞的。看来,带有α-β受体的T细胞生来就具有这样的特点,即当它们的受体参与后,它们通常也不会被激活。因此,问题在于一个成熟的T细胞,当其受体对某些东西作出反应后,如何决定是分裂呢,还是失去活力或死亡?
大约30年前,当时在英格兰医学研究委员会实验室工作的David W.Dresser的一项经典性实验在一定程度上解决了上述问题。当时,研究人员都知道免疫系统会对凝聚的外来蛋白质制品或与佐剂混合的蛋白质(如放在矿物油里的死细菌)作出活跃的应答。但是,Dresser发现免疫系统对可溶性外来蛋白不能作出应答。事实上,免疫系统一旦接触过某种可洛隆外来蛋白,以后它对该蛋白的任何制品就都不能起反应。免疫系统学会耐受可溶性外来蛋白的部分原因至少是在于它会消除那些能对这类蛋白作出应答的细胞。这一情况是Scripps医院的Jacque M.Chiller和William O. Weigle以及MRC实验室的Roger Taylor于1971年发现的。
很明显,T细胞能够识别抗原的类型,尽管直到最近还不清楚它们是怎样做到这一点的。α-β受体没有直接的途径可以发现外来蛋白是以何种类型被引入机体的。只要某个肽粘附到MHC蛋白上,它就能结合。一口受体而不管这个肽来自溶液里的蛋白质,还是佐剂里的蛋白质。除α-β受体以外,一定还有某种东西给予丁细胞有关抗原类型的信息。
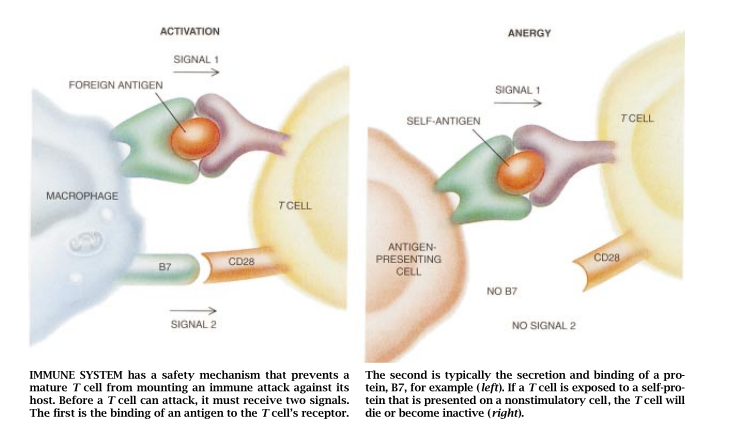
1970年,Salk生物学研究所的Peter A. Bretscher和Melvin Cohn提出了解决这一问题的初步设想。5年后,澳大利亚John Curtin医学研究院的Kevin J.Lafferty和Alistair J.Cunning-ham把这一设想改进为现在认可的型式。从免疫学观点来看,T细胞需要有两个信号才能被抗原激活:第一个信号来自8受体的结台作用,第二个信号则有某个另外的来源。
近10年来,免疫学家们一直在鉴别这第二个信号。一条线索来自Ronald H. Schwartz和他在国立卫生研究所的同事们所作的研究工作[参阅“细胞无反应性”一文,HC蛋白的T细胞,那么和这种MHC蛋白相结合的抗原不会诱使这些T细胞分裂。几天后,当这些T细胞与活的、未处理过的细胞上的MHC蛋白所结合的抗原相遇时,不仅不能作出应答,而且也不能分裂。处理过的带有这种MHC蛋白的细胞已经某种方法使这些T细胞丧失了活力。
以后的研究工作证明这种使丁细胞失活的机制涉及T细胞表面上的一种蛋白质——CD28。当CD28结合驻留在B细胞和巨噬细胞表面上的蛋白B7或BB1时,它把一个信号转输给T细胞。通常,T细胞会同时结合一个抗原和一个MHC蛋白以及一个B7。结果是T细胞获得两个信号:一个信号是通过其受体获得的,而另一个信号则是通过CD28获得的。如果一个T细胞遇到没有功能性B7的细胞上的一个抗原,那么它将得到受体信号。但没有CD28信号,这个T细胞也就会丧失活力。这一研究结果有力地证明了关于T细胞需要有两个信号才会对抗原作出应答的理论。(但是有必要强调指出,CD28-B7只是许多可能的第二信号之一。)
当然,在实验室里阻断CD28-B7信号的方式和免疫系统里实际发生的情况不是一回事。研究人员仍在设法搞清楚,什么样的细胞能把抗原提供给MHC蛋白而又不传输CD28-B7信号。根据伍斯特马萨诸塞大学的David C.Parker和国家变态反应和传染病研究所的Polly C.Matzlnger的说法,问题的答案可能是B细胞。动物体内的大部分B细胞携带着极少的B7。B细胞只是在自身受到刺激后才会使B7增加到适当的数量。因此,如果T细胞遇到B细胞上的抗原,它们可能会丧失活力,因为它们只接收到一个信号而没有另一个信号。目前,这一理论似乎是可信的,但是还没有被证实。很可能,只有某些特异性细胞(巨噬细胞,树突细胞,也许还有被激活的B细胞)能够把第一个信号和第二个信号都传输给T细胞,从而把它们激活。
机体可通过许多途径去应付具有α-β受体的自体反应T细胞。如果这些细胞在胸腺里继续发育而且其受体又结合自身产物,那么它们就会死去。另一方面,受体能结合自身产物的那些成熟的细胞如果接收不到第二个信号(如CD28-B7信号),则将丧失活力或被杀死。研究人员较为不能肯定的是,B细胞和带有α-β受体的T细胞是怎样对自身产物作出应答的。
看来免疫系统控制着自体反应的B细胞及其免疫球蛋白的方法和它控制带有a受体的自体反应的T细胞的方法是一样的。例如。1976年,宾夕法尼亚大学的Norman R.Klinman和他的同事们以及达拉斯德克萨斯大学西南医学中心的Ellen Vitetta和她的同事们不约而同地证明,要使组织培养物里的未成熟的B细胞对抗原产生耐受性比成熟的B细胞要容易得多。在此之后,Hal1研究所的Gus.Tav J.V.Nossal爵士和他的合作者证明,这一现象可能涉及B细胞的无反应性以及B细胞的死亡。
最近,研究人员已经能够利用转基因小鼠在这些动物身上而不是在培养皿里展示这一现象。为了进行这项实验,他们把带有完全重排过、编码一种特定的免疫球蛋白的成熟基因注入受了精的小鼠卵中,从而把这些基因引入小鼠的DNA中去。当B细胞在处于发育过程中的小鼠体内成熟时,这个引入的基因诱使几乎所有的B细胞都在其表面上产生这种特异的免疫球蛋白。
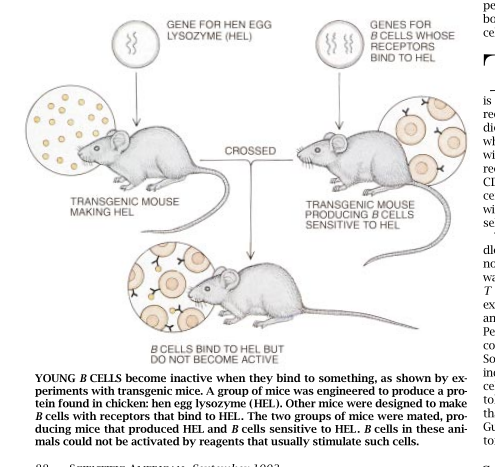
最早试用这种方法的研究人员中有悉尼大学的Christopher C.Gcxnow和他的同事们。他们培育出了两组转基因小鼠。一组含有这样一些基因,这些基因编码能结合外来蛋白质——蛋清溶菌酶的免疫球蛋白。另一组含有的基因可指令细胞去生产蛋清溶菌酶。使第一组的小鼠和另一组的小鼠交配后,它们产生的后代含有上述两类基因。因此,这些后长既能制造蛋清溶菌酶,也能制造会结合蛋清溶菌酶的免疫球蛋白。研究人员发现,这些后代的B细胞是失活的,从而肯定了在组织培养皿里取得的研究结果。
当时在巴塞尔免疫学研究所工作的David Nemazee和山遭士制药公司的Kurt Buerki也进行了类似的试验。他们培育出了一种转基因小鼠,这种小鼠带有的基因,可编码能结合MHC蛋白的免疫球蛋白分子。这类小鼠中有一些天生会在其骨髓里生产D。在这些小鼠体内,B细胞都死去。
为什么未成熟的B细胞和自身抗原接触后有时会丧失活力而有时又会被杀死呢?研究人员已经发现,抗原的类型决定着细胞的命运。可凝聚抗原,如蛋清溶菌酶最可能使与它相结合的未成熟B细胞丧失活力。而与细胞结合的凝聚的抗原(如D)则更可能杀死未成熟的B细胞。
总而言之,B细胞的耐受性机制和B细胞的耐受性机制非常相似。未成熟的B细胞的受体和某种东西结合后便死亡或丧失活力。耐受性是否也能像对成熟的T细胞那样对成熟的B细胞产生影响呢?这一问题仍悬而未决。
拥有γ受体的T细胞和B细胞相反,是个谜。在人体和小鼠体内,这些细胞和B细胞或T细胞一样多,而且T细胞显然非常重要的。但是科学家们对于这些细胞怎样为免疫系统作出贡献的问题是一知半解的。看来,T细胞会对宿主在下列情况下制造的产物作出应答。例如,当宿主的组织被擦伤,受到过热的影响,接触到危险的金属或受到外来有机体攻击时。这些细胞上的受体看来是天生地专门被用来结合机体自身的某些成分的。如果确实是如此,那么研究人员就面临这样一个问题,即这些自体反应的细胞是怎样被控制的。在这一点上,研究人员们一无所知。
健康的免疫系统不会攻击其自身的宿主。遗憾的是,免疫系统会犯错误,因此有时会出现可能对自身抗原作出应答的T细胞和B细胞。这些细胞损害它们所在的机体,而引发诸如类风湿性关节炎、多发性硬化症和红斑狼疮等疾病。在这一点上,医生们治疗这些疾病的方法是与引发它们的免疫细胞展开全面的斗争。人们使用有效的抗炎症药物和能够杀死T细胞和B细胞或能使其丧失活力的化药制剂来制止自体免疫应答。不幸的是,这些方法并不总是有效,而且在某些情况下还会有副作用。免疫学家们希望,如果他们在有关免疫系统怎样学会耐受机体这方面继续进行研究,那么他们将会找到一些方法去改进对自体免疫疾病的治疗方法。
请 登录 发表评论