免疫系统的细胞重组基因片段以产生数以百万计的受体,供鉴别和攻击一生中遇到的无数病原体。
36年前,《科学美国人》杂志登载了一篇文章,题为“丙种球蛋白缺乏症”,该文作者之一是我的父亲。他在这篇文章里描述了一种机体缺乏抗感染能力,即免疫系统检测病原体的机制失灵而引发的疾病。他和Ogden Bruton在诊断这种首次被称为免疫缺失症方面所作的研究帮助人们打开了深入有效地了解免疫系统怎样识别和区分机体自身的分子和入侵的细菌、病毒或寄生虫分子的思路。
罹致了丙种球蛋白缺乏症的人不能制造抗体分子。出现在血液和细胞、液体里的这种特异性蛋白质通常能结合可引起感染的细菌或病毒,并向免疫系统的攻击性分子和细胞发出信号。抗体这类分子具有的鉴别外来分子,进而引导机体防御的能力对机体来说是极为有用的。它们能使我们去消除感染,通过接种来抗御再感染,从而使机体受到保护。
不幸的是,这些相同机制中有一些却会引发疾病而不是防治疾病。例如,免疫系统可能和无害的外来物质花粉起反应而引起变态反应(过敏反应)。当免疫系统转而攻击机体自身的组织而导致自体免疫疾病时,则事态会变得更为严重。但不管是保护健康还是引发疾病,其识别和应答的机制都是相同的。因此,认识这些机制是了解免疫系统怎样工作和怎样失效的关键所在。
我在本文中将描述机体赖以鉴别外来物质的两个主要系统。第一个系统是先天的免疫系统——“先天”的含意是指机体生来就具有能立即识别某些微生物并将其推毁的能力。第二个系统是适应性免疫系统——抗体在此系统中起主要作用。适应性免疫应答中使用的受体是由拼接在一起的基因片段(像一条东拼西凑成的棉被)形成的。每一个细胞都各不相同地利用可获得的基因碎片去制造某个独特的受体,使细胞得以集中地识别在其一生中所遇到的感染性有机体。研究人员已经搞清楚形成免疫系统的基因、分子和细胞,所以能够确定包括丙种球蛋白缺乏症在内的一些疾病的病因学,从而着手研究其治疗方法。
我们的先天性免疫系统能够一遇到许多病原体就予以摧毁。先天免疫系统的一个重要的组成部分是一类叫做补体的血蛋白。之所以称作补体是因为它们能在抵御感染方面协助抗体,或为抗体加把劲。比利时的细菌学家Jules Bordet于1900年发现补体能通过多种途径起作用。有一类补体蛋白在受到化学刺激时能结合任何蛋白质——无论是细菌上的还是我们自身细胞上的。这种被结合的蛋白质会激活另一些补体分子。这些被结合的分子能吸引吞噬细胞和阿米巴样细胞,后者会吞食和消化有一层补体外壳的微生物。补体还能在细胞和细菌的脂膜上钻孔而把它们杀死。有了这些孔,水就会冲进细胞体内。这一过程足以把细胞摧毁。补体能防止像细菌性脑膜炎和淋病等这类疾病。
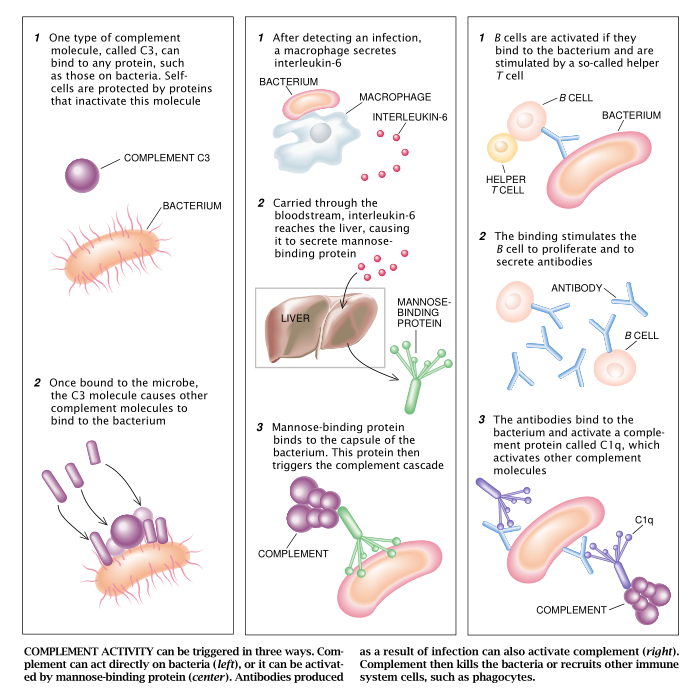
但是这些强有力的攻击系统并不破坏我们自身的细胞。和微生物不一样,我们的细胞拥有能使补体失活的蛋白质。因此,最简单地说先天的免疫性能把组成机体分子(即自身分子)和一切其他的分子(即非自身分子)区别开来。
并不是所有的病原体都会那么轻易地受补体安排。有些病原体有躲避补体攻击的独特方法。引发肺炎和链球菌喉炎的细胞都具有由糖分子的长链(多糖)构成的包囊(即外壳)。这些包囊能阻止补体直接作用于细菌。
先天的免疫系统可通过两个途径来对付这类细菌。第一个途径是遍布机体组织的大型吞噬细胞,即巨噬细胞。巨噬细胞有针对一些这类多糖的受体,并利用这些受体去结合和吞食细菌。第二个途径是,与细菌遭遇的巨噬细胞能分泌白细胞介素-6。这是一种反过来会刺激肝脏的蛋白。白细胞介素-6指令肝脏分泌一种新的能结合糖残留物(叫做甘露糖)的蛋白质。这些残留物会从细菌包囊里钻出来。这种结合甘露糖的蛋白质和细菌结合后就会改变细菌的形状,从而激活一系列补体并起动吞噬细胞。结合甘露糖的蛋白质会警告机体,必须结合哪些微粒。
但是先天的免疫系统不是任何感染都抵御得了的。微生物进化迅速使它们得以设计出许多方法去避开进化要慢得多的人和其他动物体内先天的免疫防御系统。为补偿此不足,脊椎动物拥有独特的免疫识别方法,即适应性免疫功能。适应性免疫功能使机体得以识别即使以前从未遇到过的任何微生物并对其作出应答。
适应性免疫系统是依靠克隆选择过程来发挥其功能的。这一想法是在50年代由澳大利亚的Walter and Eliza Hall医学研究所的Frank Macfarlane Burnet爵士正式提出的,现在已被广泛地接受。在克隆选择过程中,适应性免疫系统的细胞(叫做B淋巴细胞,简称B细胞)制造抗体并显示在这些细胞的表面。这种抗体随即起受体作用。每个B细胞都制造不同的受体,因此每个B细胞各能识别一个不同的外来分子。装备了这些受体的B细胞起着哨兵的作用,总是在警戒着微生物。当某个B细胞发现了某个入侵者后,它就迅速分裂。正因为所有的子细胞都来自一个亲本细胞,所以称它们为克隆。即无性繁殖系(“克隆选择”一词即由此而来)。每个克隆里的所有细胞都有着相同的受体。这些克隆的B细胞分化成分泌抗体的细胞。这些抗体和B细胞的受体一样地去结合微生物。这些微生物一旦被抗体插上标记而被视为外来物,吞噬细抗和补体系统就会把它们驱逐出机体。
要了解适应性免疫系统,必须搞清楚的关键问题是,B淋巴细胞是怎样产生那么多不同的受体的。具体地说,在一个有限的基因组里怎么能编码数以百万计的供识别任何微生物用的各不相同的受体的呢?一个人大约有100,000个基因,但是个体内的10兆(10^12)个B细胞却随时都能制造出1亿多个特殊的抗体蛋白。我们显然不可能通过遗传获得决定所有这些蛋白所必需的基因。
近几年来找到了这个问题的答案,研究人员发现了编码抗体和B细胞受体的基因。问题的要害是在1976年由当时在巴塞尔免疫学研究所工作的Susumu Tonegawa发现的。他指出抗体基因是作为基因片段遗传下来的。这些片段只在单个的淋巴细胞发育时连接在一起而形成一个完整的基因。
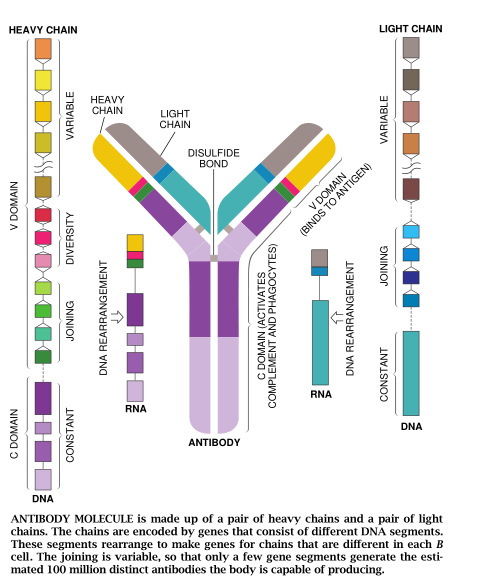
这一连接过程本身会产生更多的多样性。1980年,麻省理工学院的Fred Air和David Baltimore指出,连接基因片段的酶把DNA碱基随机地加到正在结合的片段的末端。结果是形成了新的基因(每个基因编码一种蛋白链。蛋白链组配成完整的受体后又进一步增加了多样性。抗体是由两对蛋白链(重链和轻链)构成的。重链连接而形成Y,位于上枝的轻链横靠重链。每个B细胞只产生一个轻链和一种重链,因此每个B细胞都制造一个独一无二的抗体受体。事实上,从理论上讲,每一种类型的1000根不同的链能有一百万种组合形式。所有这些随机的连接过程产生的独特的抗体分子可能比机体内的B细胞还要多。
这些过程好像不能产生足够的多样性,但是当B细胞因结合外来物质或抗原而被激活后,编码B细胞受体的基因会极其迅速地发生突变。这些“超突变”能产生额外的受体。事实上,免疫系统为了寻找最适宜的免疫应答,总是在利用细微的变异去试验卓有成效的受体。
B淋巴细胞一旦把抗原结合到它的受体上,它就分化并把抗体分子(受体的可溶形式)分泌到血液的血浆(即液态补体)里去。正因为新的抗体是由在原来的B细胞上产生了抗体的那个基因决定的,所以它具有同样的特异性。但是B细胞和它的后代能对抗分子产生不同的变异。可以改变重链的所谓的恒定部分(又是借助重排基因)来做到这一点。这第二种基因操作可以产生到达机体不同部位的抗体。这些抗体仍能识别同样的抗原。这类抗体在结合微生物后能开始一系列补体的活动,激活吞噬细胞或引发变态反应。
适应性反应也是免疫记忆的源泉。这就是说,我们对早已经受过的感染的抵抗力远比对初次遇到的感染要有效而又强烈得多。我们之所以有这种记忆是因为机体保留了在初次感染时作出了应答的淋巴细胞。当同样的微生物侵入机体时,这些细胞能迅速地被再激活,而它们的产物则可阻止该疾病的再发生。(与此相反,先天的免疫系统不能把一种微生物和另一种微生物区别开来,因此在经受某种感染后既不能增强也不会减弱对它的预防性能。)
适应性免疫系统的长处由于以下两个缺点而有所削弱。首先,既然B细胞在能够制造抗体之前必须增殖和分化,所以需要5天多才能产生抗体应答。在此期间机体必须依靠先天的免疫系统去制止感染。其次,正因为任何一种大分子(如蛋白质或多糖)都可能被抗体所识别,所以适应性免疫系统偶尔也会制造出对抗机体自身细胞的抗体。这些抗体能如此有效地激活补体,以致会压制能防止补体攻击机体细胞的那些系统。其后果就是发生自体疫病。通常可以通过耐受性来避免这种攻击自身的现象。耐受性是一个消除自身反应细胞的过程。[参见本期“免疫系统怎样识别机体”一文]。
尽管有上述缺点,适应性免疫力方面重排基因的方法已经建立了—套精巧的防护系统。脊椎动物体内怎么会出现这样精巧的过程,而这一过程是否确实成了适应性免疫的关键呢?和所有的进化问题一样,这个问题只有利用模型才能得到答案,而且还不一定确实能做到。尽管如此,我们对受体的了解确实给我们提示了一个可行的方案。一个重要的线索来自这样一个事实,即所有的免疫性受体都是由相似的蛋白质模块构成的。每一个模块都被编码在叫做基因外区,即编码顺序的一大块DNA中。基因外区被基因内区分开。基因内区是非编码的DNA,可被转录成RNA后又被RNA拼接过程移走。其结果是编码的模块形成连续不断的信息。
抗体的每个蛋白组分都有一种叫做免疫球蛋白褶的结构。这一普遍存在的结构常见于除抗体以外的许多蛋白质里,它形成一个紧凑的区,包着排在一起的各股氨基酸。在抗体里,这些区形成重链和轻链,由一对硫原子(二硫键)把它们连接起来。
免疫球蛋白区有两类:可变区——V区和恒定区——C区。抗体里的v区成对而形成识别抗原的位点。紧随它们的是一对C区,以介导抗体分子的功能,如补体结合作用。V区由部分基因组成:一个V基因片段、一个J基因片段(起连接作用),有时还有D基因片段(形式多样化)。V区特有的可变性来自基因的重排。这种基因的重排可产生人体内受体的多样性。
但是,有些蛋白质拥有这样的区,这些区和抗体的V区相似,但不是由基因重排后产生的。在这些蛋白质中,一个基因外区决定了整个V区。这类蛋白的例子之一是CD4分子:CD4分子在免疫识别中起作用而且也是艾滋病病毒的靶子。这类完整的v基因实际上是在某些原始的脊椎动物的抗体基因里发现的。
我们所指的重排抗体的V基因很可能是从这些完整的V基因进化而来的。当少许流动的DNA(叫做转位子)被插到某个完整的V基因外区后,就可能发生基因的重排。这一插入作用会割裂V基因外区。被割裂的基因失去活力,这些基因只是在插入的转位子被清除,而基因片段连接而重新形成完整的基因外区后才可能制造抗体。在我们的机体里,在B淋巴细胞产生其受体时,正是这种清除机制在起作用。因此,V基因的重排确实不仅产生了抗体的多样性而且也是形成编码抗体蛋白的基因的关键因素。没有基因的重排,就不可能由这些基因制成蛋白质。
基因重排已被证明是只表达许多相关基因中某一个基因的强有力的手段。这些手段至少被—种病原体用来逃避免疫系统的检查。昏睡病(非洲锥虫病,昏睡性脑炎)的病原体是一种寄生性原生动物锥虫。这种锥虫在其外壳中有一种蛋白质,受感染的宿主即针对此蛋白质制造出抗体。这些抗体能消灭大部分锥虫,但是有极少数锥虫会重排其外壳的蛋白质基因,从而改变其外壳。这些变异的锥虫能逃脱抗体首次突击活动的检查而继续成长。宿主能制造针对每一个变异的抗体,但是新的变异型不断产生和生长而使感染复发。在这方面,就像免疫性受体一样,基因的重排控制着基因的表达。
至此,我们讨论了依靠遗传下来的识别分子起作用的先天免疫系统和依靠基因的重排而在淋巴细胞里产生新受体的适应性免疫系统是联合行动以鉴别微生物的。这种双体功能只能对抗体体液里的病原体成功地发挥其作用。许多微生物在免疫系统能制造出抗体之前就潜入了机体的细胞。作为水溶性蛋白的抗体能够渗到细胞外液体和血液里去,但是穿不过细胞的脂膜。
因此,免疫系统进化而形成了一种专门发现细胞内感染的机制。这一机制分两步起作用。第一步:设法向机体发出某些细胞已受感染的信号;第二步:动员专门识别这些感染的淋巴细胞并消灭这种感染。
第一步是细胞发出它已被感染的信号。这是由能把微生物的碎片输送到爱感染细胞表面上去的那些特异性分子来完成的。这些在细胞内质网里合成的分子能结合已在细胞内分解的蛋白质片段——肽。这些运输分子和肽结合后就转移到细胞表面。
这些运输分子是基因的主要组织相容性复合物(MHC)的蛋白质。MHC是由已故的英国遗传学家Peter Corer和缅因州Bar Harbor的Jackson实验室的George D.snell发现的。当时MHC被看成是移植物受排斥的原因。这一长串名词是由希腊字histo(组织)和其相容在一起的性能(相容性)组成的。这些MHC分子可分为两类:MHCI和MHCII。MHCI分子几乎在机体的各类细胞里都能见到。MHC2分子只出现在参与免疫系统的细胞里,如巨噬细胞和B细胞。
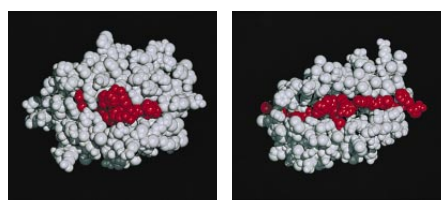
这两类MHC分子尽管结构不同,哈佛大学的Jerry H.Brown和Don C.Wiley和他们的同事在今年七月发表的研究报告,以及现任职于加州理工学院的Pamela J. Bjorkman和她的同事们的早期研究都证明它们会折叠成非常相似的形状(见图5)。每一个MHC分子都有一条深的槽口,短肽(即蛋白质片段)能够结合到这条槽口里去。正因为这个肽不是MHC分子自身的一部分,所以各个MHC分子的这个肽都不同。在健康的细胞上,所有这些肽都来自自身蛋白。是MHC槽口里的外来肽向免疫系统通报这个细胞受到感染了。
被受感染细胞显示的外来的肽-MHC复合物是被另一类淋巴细胞——T细胞上的受体识别的。了细胞上受体的结构和与膜结合的抗体基本一样。(这个抗体的作用和B细胞上的受体相似。)但是了细胞受体专门只识别被MHC分子结合的外来肽。当了细胞受体和其特异的外来肽——MHC复合物结合后,T细胞就能够处理或杀死这个被感染的细胞。
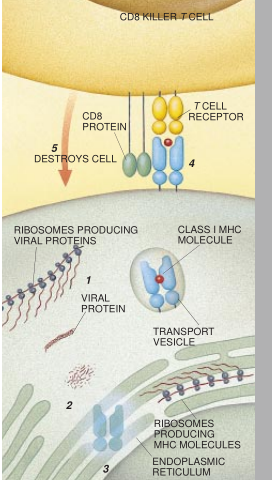
这两类不同的MHC分子能显示细胞内不同部位产生的肽。MHCI分子能结合来源于细胞液区里的蛋白质的肽。这些肽在细胞内被消化是细胞赖以更新其所含蛋白的那个自然过程的一部分。在耶鲁大学我的实验室里工作的James Shepherd最近证明,由这一过程产生的短的肽片段被另一个转运子由胞液泵送到内质网里。
![]() 在这里,MHCI分子合成为氨基酸的长链。这个氨基酸必定会折叠成成熟的MHCI蛋白。只能围绕着一个合适的肽实现这一折叠作用,如同蚌壳里围绕一粒沙逐渐形成一颗珍珠一样(见图4)。转运到这里的肽就成为天然的种子。
在这里,MHCI分子合成为氨基酸的长链。这个氨基酸必定会折叠成成熟的MHCI蛋白。只能围绕着一个合适的肽实现这一折叠作用,如同蚌壳里围绕一粒沙逐渐形成一颗珍珠一样(见图4)。转运到这里的肽就成为天然的种子。
MHCI分子围绕肽的折叠表明它要把这个肽带到细胞表面并把它保留在那里。如果这个肽是外来的,譬如说是产生于正在感染细胞的某个病毒的,那么一个正好路过的了细胞就会把它识别,以这种方式起作用的T细胞是表面带有CD8蛋白的了细胞,这些CD8蛋白将发动针对这一细胞的免疫应答,释放破坏这整个细胞的化学物质。正因为CD8了细胞是被指定去杀死显示外来呔的细胞的,所以有时把它们称之为杀伤性了细胞。这种应答是防止受感染细胞产生更多病毒的唯一有效的方法。
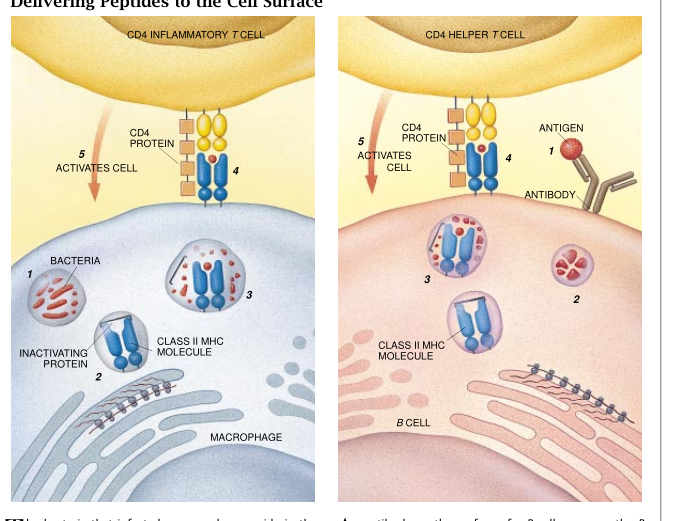
当然,并非所有的微生物都是在胞液里生长的。有些细菌,如结核病的病原菌分枝杆菌(Myoiaf-teria)是在细胞内的泡囊里生长的。有一层膜把泡囊和细胞的其他部分隔离开来。通过这一途径受到感染的细胞往往是巨噬细胞。它们能吞噬细菌并自然地形成一个这样的感染点。细胞泡囊里的细菌制造能在泡囊里被分解成肽的蛋白质。这些肽结合MHCⅡ分子,后者随即从它们在内质网里的原发地迁移到泡囊。
和必须围绕一个肽成熟的MHCI分子不同,MHCII分子一旦合成就时刻准备着行动。现在在耶鲁大学工作的Peter Cresswell证明,内质网里有一条专门的氨基酸链在MHCⅡ分子转移到泡囊之前一直在抑制着它的结合能力。这根多余的链然后会消失,而使MHC分子得以抓住任何一个被它们发现的肽。
MHC2分子然后把这个肽运送到细胞表面。在那里,这个肽可能被表面具有CD4的T细胞识别。和CD8T细胞不一样,CD4T细胞不能直接杀死细胞,而是激活那些已经显示这个呔的细胞。例如,有一种CD4T细胞叫做发炎性了细胞(Th1),能够刺激巨噬细胞在其自己的泡囊里杀死分枝杆菌。艾滋病患者正是因为丧失了这类CD4T细胞才对结核病这样的一类疾病如此敏感。
另一类CD4T细胞——辅助性了细胞(Th2)——能引导B细胞的活性。当某一蛋白质结合B细胞的受体后,这个蛋白质就被吸入泡囊而在那里被切割成能结合MHCⅡ分子的肽。然后,这些复合物被送到细胞表面而使它们可被辅助性了细胞识别。这种辅助性了细胞通知B细胞开始制造抗体,此时只起动已和抗原结合的那些B细胞。因此,甚至抗体生产最终也是受控于MHC分子和T细胞的。
编码MHC分子的基因是人体里最易变的基因。MHC分子系统的这种异乎寻常的特性使人类得以在如此众多的病原体的包围中存活下来。一个人的抗原受体基因各个细胞是不同的,而MHC基因则和它们不同:一个人的所有细胞里的MHC基因都一样,但人与人之间的有差异。某个MHC分子的每一种变异体可结合不同的肽,因为遗传变异主要影响抓住肽的那些槽口的结构。
MHC分子的遗传变异性意味着,至少有些个体将拥有能结合任何一种病原体肽的MHC分子,那怕微生物蛋白质的进化是在不断进化的。牛津大学的A.V.Hill最近已经调查研究了数百年来一直在遭受致命性疟疾的病原体——恶性疟原虫(Plasmodiumfaldparum)之害的人群。他发现MHC分子能特别稳固地结合该寄生虫的肽的那部分人的百分比一直在增长。T细胞还能识别MHC分子的这些遗传差异。这可以说明为什么组织移植物会被排斥:宿主体内的T细胞把被不同的MHC分子结合的肽看成是外来物,因此会杀死这种移植的组织。
抗原与受体相结合实际上仅仅是免疫应答的开始。对于B细胞生产抗体或T细胞释放其杀伤性或辅助性分子来说,这些细胞的核必须知道在其表面已经发生结合作用。淋巴细胞受体是由几种蛋白质构成的,这些蛋白质通过相互作用而把生化信息送到细胞内部。受体结合抗原后会促使细胞膜里的其他蛋白质去起动细胞内一类叫做激酶的酶。激活的激酶把一类叫做磷酸基团的化合物加到细胞内的其他蛋白质上。添加上的磷酸基团能改变这些蛋白质的活性而最终让它们把信号送给细胞使其生长并分化。T细胞上的CD4和CD8蛋白以及B细胞上叫做CDI9的蛋白是和细胞内激酶偶合的膜蛋白的例子。另一类起作用的分子是CD45,这是一种协助介导淋巴细胞活动的酶,其作用途径是去掉某些蛋白的磷酸基团,从而使它们失活。
但是由激酶介导的信号本身不能激活淋巴细胞。淋巴细胞必须接受由机体另一些细胞发出的第二个信号才能生长。这些信号通常叫做共刺激信号。B细胞需要辅助性T细胞不仅为了识别抗原,还为了制造能结合B细胞分子CD40的蛋白质CD40配体。T细胞主要依靠所谓的B7分子作为共刺激信号:这样的分子也是由呈现抗原的细胞表达的。现任职于纽约大学医学中心的Yang Liu在我的实验室工作时曾证明,当先天免疫系统识别出存在的微生物时,即通常在感染的初期阶段,B7就被表达。实际上,先天免疫系统可能是为适应性免疫系统的活动作好准备。在这方面,共刺激信号可能也在协助适应性免疫系统把感染性微生物和自身组织区别开来。结合抗原但未接受共刺激信号的淋巴细胞不会被激活。其结果是,自身抗原不可能单独起动免疫应答。
淋巴细胞一旦结合抗原并接收到共刺激信号,它就分化并变得活跃起来。(这种活跃的淋巴细胞有时被称作效应细胞,因为它们实际上是介导免疫应答的。)细胞一旦激活就不再需要共刺激信号。因此,尽管只有表达共刺激物的细胞能诱发免疫反应,任何细胞或分都可能成为靶子。这一应答很重要,因为它使B细胞和T细胞得以去攻击任何已被感染的细胞而不管它们是属于哪一类的细胞。
那么丙种球蛋白缺乏症(一种不能制造抗体的疾病)患者的问题出在哪里呢?最近才找到这个问题的答案[参阅本期“免疫系统发育探密”一文]。原来,健康个体体内的B细胞在其发育过程中,受体基因的重新排列是被小心翼翼地调节着的。换句话说,抗体的受体是精确地制造的。编码每条链的v基因必须按正确的顺序被重排,因此在精确地完成重排之前,受体不可能是完整的。
因此。为了形成正确的受体,细胞必须在受体基因的发育过程中确定其状态。重链的V基因重排使得细胞首先能够制造出重链。这条重链走向细胞表面。细胞表面上重链的存在向T细细胞发出信号使其停止重排重链基因而开始重排轻链基因。看来是一种激酶把这一关键的信号从细胞表面送到细胞内部的。
对丙种球蛋白缺乏症患者来说,重链是制成了,但是轻链并没有制造出来。最近在这些患者身上发现缺少一种激酶。(值得注意的是,缺少见于T细胞里的一种相关激酶对T细胞发育会发生同样的影响。)显然,我父亲于36年前在(Scientific American)描述的这种基因缺失现象终于得到了证实,因此我们应该很快了解其作用机理。
与此同时,在丙种球蛋白缺乏症患者身上出现的各类感染已经告诉我们为什么抗体生产是保证机体健康所必需的。用取自供体的免疫球蛋白治疗丙种球蛋白缺乏症患者可以为他们提供抗体而使他们得以过几乎是正常人的生活。但是这种治疗方法只是暂时性修正这种遗传病,而从理论上来讲,现在已经能利用把正常基因注入到患者骨髓细胞中去的方法来治愈这种病。为了征服这种病以及本文中讨论过的其他更常见的病,需要我们继续大力支持免疫学、遗传学、细胞生物学、癌症及分子生物学方面的基础研究。
请 登录 发表评论