免疫系统通过自我定界和防卫使生命成为可能。免疫系统的功能失调会导致疾病和死亡,对这一系统的研究为生物学提供了一个统一的观点。
舒伯特、济慈和勃朗宁夫人有什么共同之处?他们都是才华横溢的天才,但每人都因一种今天应该可以预防或治疗的传染性疾病而悲惨地英年早逝了。对这一类疾病的治疗取得了长足的进步,这无疑是现代科学的一个巨大成就。天花已被彻底消灭了,小儿麻痹和麻疹到本世纪末也可能成为历史。在目前艾滋病的传播之前,针对传染病的斗争所取得的成就是如此辉煌,以致各工业化国家都不把它们当作国家的重大问题来对待了。
光是在公共卫生方面的这种惊人进展就证明了探索人类免疫系统的巨大努力是多么正确。但免疫学领域不只是包括研究传染的本质及其防治。免疫学研究要针对寻找医治癌症和其他固免疫反应偏差或失调所引起的疾病的新方法。这种研究提供了一种科学的框架,它可以检测生命体系的化学组构再把这些信息汇台成对有机整体如何协调运作的认识。
应当承认,我一开始并没有马上认识到免疫学潜在的重要性。我在50年代当医学院学生的时候,我开始对病毒感兴趣希望通过对病毒生长的分析可以揭示生命过程的奥秘所在。我渴望到墨尔本的瓦尔特和伊利莎·霍尔医学研究所,在澳大利亚杰出的病毒学家Sir Frank Macfarlane Burnet门下学习。
到我从悉尼大学毕业并完成了临床训练后,我终于如愿以偿,被他接受了。但是,Burnet写信告诉我,他已经对病毒不太感兴趣,而转向了探索人类免疫系统。我对此深感失望。在我的想象中,早期的伟人们——路易斯·巴斯德、保尔·艾利希和艾米尔·冯·贝林——已经发现了免疫作用的基本真理。作为免疫学研究主要应用领域的公共卫生事业,似乎是医学课程中最令人乏味的学科。
后来我逐渐明白我的错误有多严重。就在我开始读研究生的时候,与免疫有关的一系列发现揭开了生物医学史上极其光辉的篇章。研究人员观察到,能杀死进入人体的致病性微生物的白血球——淋巴细胞,还能攻击癌细胞并至少能暂时对它们进行控制。其他一些实验证明,同样是那些淋巴细胞还能以不太受欢迎的方式起作用。例如,在器官移植时淋巴细胞会对抗外来细胞,引起移植排斥。如果免疫系统规律被破坏,淋巴细胞会攻击属于人体自身的细胞,而它们本该是保护这些细胞的。这就造成了可能致命的自身免疫疾病。
所有这些发现都增强了人们对免疫系统的一个最关键又是最难揭示的奥秘的兴趣:它是怎样能够识别那些威胁到机体健康的、似乎难以计数的病毒、细菌和其他外来物质的。在大多数生物化学相互作用中,例如一个激素分子与一个受体相结合或一个病毒粘合到它的寄主细胞上,亿万年的进化过程已经把所涉及的化学过程精炼到每个分子只以一种精确预定的方式与它的对应物相结合的程度。相反,免疫系统并不能预知它下一次将面对哪一种外来分子。
帮助免疫系统对付疾病挑战的关键物质之—是抗体,这是1890年由冯·贝林和北里柴三郎所发现的蛋白质大分子。抗体抓住像细菌和病毒之类的外来入侵者,并把它们消解。抗体还包围微生物,使它们成为巨噬细胞等净化细胞的食物,每一类抗体只对某一种特定的目标分子,即称为抗原的分子进行攻击。因此,攻击炭疽杆菌的抗体对伤寒杆菌没有作用。几十年来,生物学家把抗原看作是一种模板,抗体分子用它来塑造自己,以获得一种与之互补的形式。这一理论首先是由Fdix Haurowitz在本世纪30年代阐明的,后来又得到了Linus Pauling的支持,直到1960年左右它一直占着统治地位。
到了60年代中期,模板理论遇到了麻烦。霍尔医学研究所的Gordon L.Ada和我证明,制造抗体的细胞并不含有能在其周围形成抗体的任何抗原。对酶的研究证明,一个蛋白质的结构只取决于它的氨基酸亚单位的特定顺序。此外,Francis Crick推断,在生物系统中信息是从DNA流向RNA,再流向蛋白质的。为此,抗原蛋白质并不能限定新的抗体蛋白质:抗体结构的信息一定是编码在基因之中的。这些发现提出了一个令人迷惑的问题:如果基因指令了抗体的制造,人体所制造的几百万种不同抗体又怎么可能每种都有一个特定的基因呢?
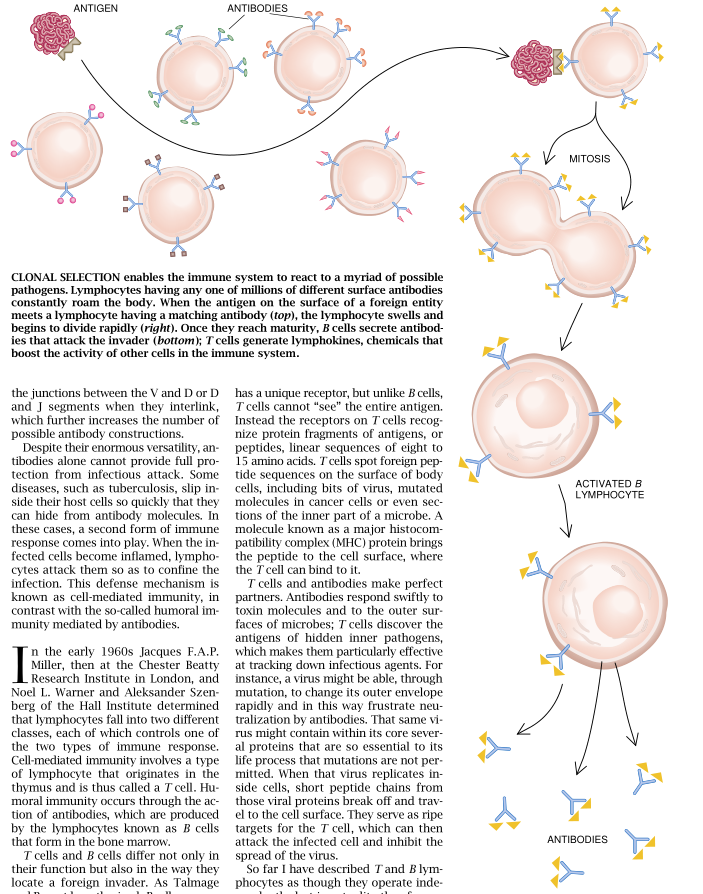
1955年,当时还在加州理工学院的Niels K.Jerne已经对抗体不可思议的多样性提出了一个可能的解释。他提出。免疫应答是选择性的,而不是指令性的,也就是说,哺乳动物有一种本能去合成几十亿种不同的抗体。他还提出,一个抗原的到来只是加速了最能配合它的那个抗体的形成。
两年以后,科罗拉多大学的David W.Talmage和Burnet分别提出一种假说认为,抗体位于淋巴细胞的表面,而每种淋巴细胞只承担一种抗体。当一种外来抗原进入身体时,它最终会遇到一个具有一个相匹配受体的淋巴细胞,它在化学上激发这个淋巴细胞进行分裂,大量生产出相应的抗体。1958年,当时正在霍尔医学研究所访问的Joshua Lederberg与我一起验证了当一个动物用两种不同的抗原免疫后,某一种细胞事实上确实只制造一种类型的抗体。
此后不久,洛克菲勒大学的Gerald M.Edelman和牛津大学的Rodney R.Porter发现,抗体是由4条称为链的小蛋白质组成的。每个抗体有两条相同的重链和两条相同的轻链。一条重链和一条轻链缠绕在一起,形成一个能识别一个抗原的活性位点。因此每个抗体分子有两个相同的识别位点,知道了两条链在结合位点上起作用,有助于解释抗体的千变万化,因为存在着大量的可能配对组合。
由巴塞尔免疫学研究所的Susumu Tonegawa所首创的一套实验方法,使人们能明确描述免疫系统怎么能生产出如此众多不同的抗体。他发现,几乎与身体中所有其它的基因都不同,那些含有重链密码的基因并不预先存在于受精卵中。相反,这种密码存在于四组微基因中,这些微基因位于细胞核的相距甚远的各部分中。抗体多样性源于这些微基因家族的数量上:有100多种v(可变)基因,12种D(多样)基因和4种J(连接)基因。c(稳定)基因的变化方式只影响抗的功能,而不影响它的抗原亲和力。
在一个能生成抗体的细胞的发育过程中,每一组微基因的一个成员跳出它原来的位置,它与其他跳出来的微基因结合成一个完整的V-D-J-C基因。这种基因重新组合可以产生重链的4800种不同的组合形态(100×12×4x1)。除了轻链只有v、J和C三个微基因区段外,同样的过程也发生在轻链基因的组合上。因此,轻链的基本组合方式大约是400种。重链和轻链的多样性允许存在4800×400,即1,920,000种抗体基因。此外,特殊的酶在v和D或D和J区段连接时,能在两者之间插入几个额外的DNA编码单元,这就进一步增加了抗体结构可能存在的数量。
虽然抗体千变万化,但光是抗体并不能充分防御传染病。有些疾病,如肺结核,它们进入寄主细胞速度极快,以至于能躲过抗体分子。在那种场合,第二种免疫应答形式就发挥作用了。当受感染的细胞发炎时,淋巴细胞向它们进攻,以便限制感染。这种防卫机制称为细胞介导免疫,以与称为抗体中介的液体免疫相区别。
60年代初,当时在伦敦切斯特皮蒂研究所工作的Jaegues F.A.P.Miller和霍尔医学研究所的Noel L. Warner和Alesksander Szenberg确定,淋巴细胞有两种不同的类型。每种类型控制两种免疫应答中的一种。细胞介导免疫作用涉及到产生胸腺的淋巴细胞,因此它们被称为T细胞。液体免疫是通过抗体作用而发生的,抗体由在骨髓中形成的称为B细胞的淋巴细胞产生的。
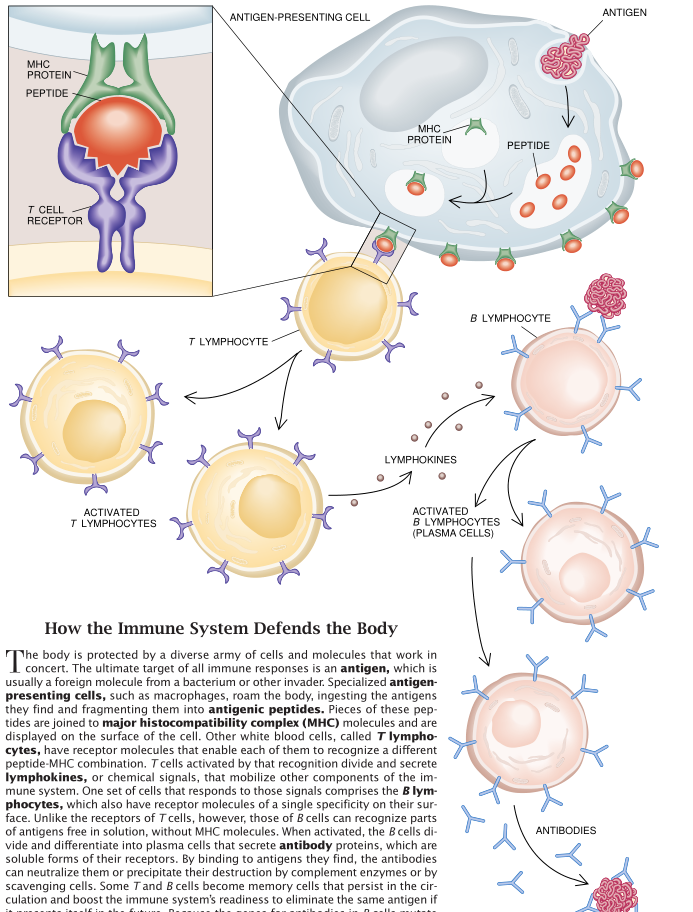
T细胞和B细胞不仅在功能上不同,而且它们在结合外来入侵者的位置上也不同。Talmage和Burnet假设,B细胞能识别抗原是因为它表面上带有抗体。每个T细胞也有一个特殊的受体,但与B细胞不同,T细胞不能“看清”整个抗原。相反,T细胞上的受体所能识别的只是抗原的蛋白质片段,即肽。肽是8到15个氨基酸的线性序列。T细胞把外来肽序列置于人体细胞的表面,这些序列包括病毒片段、癌细胞中的突变分子或者甚至是一个细菌的内部片段。有一种称为主要组织相容性复合分子(MHC)的蛋白质分子把外来肽带到细胞表面,T细胞在那里与肽结合。
T细胞与抗体组成了完美的伙伴。抗体对有毒分子和细菌外表作出快速应答。了细胞能发现内部藏有病原体的抗原,从而它们能特别有效地跟踪到传染因子。例如,一种病毒有可能通过突变迅速地改变它的外壳,这就挫败了抗体的消解作用。同样的病毒很可能在它的内核含有几个蛋白质,这些蛋白质对它的生命过程是如此重要,因此决不允许发生突变。当这种病毒在内部细胞复制时,这些病毒内枝蛋白质上的一些短肽链会脱落,移到细胞的表面上。它们成了了细胞的合适目标,T细胞便攻击受感染的细胞,抑制了病毒的蔓延。白质对它的生命过程是如此重要,因此决不允许发生突变。当这种病毒在内部细胞复制时,这些病毒内核蛋白质上的一些短肽链会脱落,移到细胞的表面上。它们成了T细胞的合适目标,T细胞便攻击受感染的细胞,抑制了病毒的蔓延。
我迄今所描述的T淋巴细胞和B淋巴细胞都是独立起作用的,但实际上它们构成了一个相互交织的严密系统。T细胞与B细胞密切接触,激发后者达到活化状态并分泌淋巴因子,那是一种促进抗体形成的分子。丁细胞通过释放抑制性淋巴因子来压制抗体的生成。
另一方面,B细胞把抗原处理成T细胞最容易与之作出反应的形式,使抗原附到主要组织相容性复合分子(MHC)上并在细胞表面把它们显示出来。B细胞通过这种方式帮助T细胞,促进它们进入活化状态。研究人员已经观察到,B细胞在某些实验条件下还能抑制T细胞的应答。这种高度有规律的正负反馈圈是免疫系统组织的一个标志。
免疫系统的特化并不因它分为B细胞和T细胞而终止。T细胞本身包括两个亚群,CD4(协助者)T细胞和CD8(杀伤者)T细胞,CIM细胞能识别由巨噬细胞和其他特化的捕抓抗原的细胞所吞食的蛋白质分解而成的肽。CD8细胞与肽样本发生反应,这些肽样本来自一个细胞的自身内部,例如一个受感染细胞中一个病毒的片段,或一个癌细胞中的突变蛋白质。T细胞的每种形式都利用自己的MHC形态来使得那些肽容易识别。
当CD4T细胞遇到适当的化学信号后,它们产生大量的淋巴因子,以加速其他T细胞的分裂并促进炎症的发生。有些CIM细胞特化成有助于B细胞的形式,另一些则特化成会引起发炎的形式。受到活化的CD8细胞产生的淋巴因子要少得多,但它们发育出具有在目标细胞上打孔的能力,还能分泌出能杀死受感染细胞的化学物质,从而限制了病毒的蔓延。由于它们的杀伤性质,CD8T细胞也被称为细胞毒素T细胞。
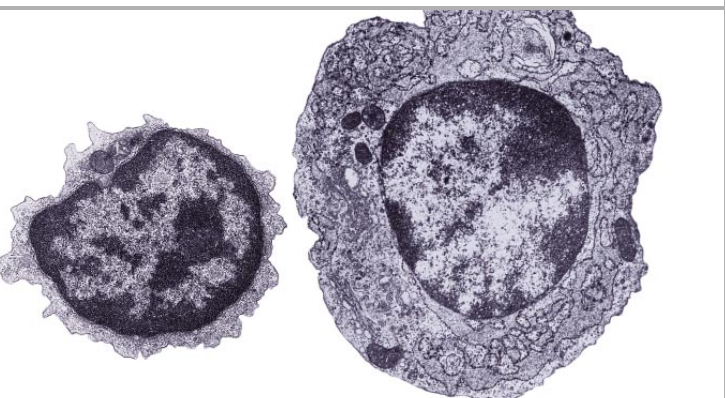
一旦被活化,B细胞会发生特别惊人的变形。在它遇到抗原之前,B细胞是一个很小的细胞,其中有一个紧密的细胞核和极少量的细胞质,它好像一个工厂的办公室,厂里没有干什么活。当B细胞发动后,它反复分裂,在细胞质里建立起数千个装配点,用来制造抗体以及一个用来包装和输出抗体的广阔通道体系。一个B细胞每小时能释放出超过一千万个抗体分子。
我的同事和我常常把单独一个B细胞培养生长成具有数百个子代细胞的一个“克隆”。一个星期后,这些克隆能生产出可供研究之用的上千亿个相同的抗体分子。我们通过这样的克隆培养技术得以目睹了B细胞另外一个令人注目的本领。不必改变抗体与之相结合的抗原B细胞就能从制造一种抗体同型(一种功能的变种)转换到制造另一种抗体同型。一种抗体的每种同型都从C微基因的一种不同形式衍生而来。
每种抗体同型都有它自己的特长。有一种同型充当第一道防线,另一种特化成能消解毒素,第三种释放粘液,由此筑起屏障,防止感染因素通过鼻子、咽喉或肠道进入体内。在对T细胞所释放的淋巴因子作出反应时,B细胞能在一天左右的时间里从制造一种抗体同型转换到制造另一种抗体同型。
B淋巴细胞和T淋巴细胞都得到了各种其他的细胞和分子的帮助。当抗体攻击一个细菌时,它们能活化补体,那是一类能通过破坏细菌外膜来杀死细菌的酶。有些淋巴因子向巨噬细胞、粒性细胞和其他白细胞发送一个化学信号。那些细胞吞食细菌和死亡的细胞来清理发炎部位。这种清理工作极其重要,一个没有粒性细胞的病人会面临以细胞尸体为食的传染性细菌引起的致命危险。显然所有白细胞都联合起来以一种完美协调的方式进行工作。
在免疫防卫的所有复杂运作中,淋巴细胞始终要保持在对外来非自身细胞进行识别并做出攻击性反应的同时,对自身的细胞是无害的,这一点极其重要。Bumet推测,自体识别并不是遗传决定的,而是在生物体胚胎阶段由免疫系统学会的。他提出,在免疫系统发育成熟之前向胚胎引进一个外来抗原会诱使淋巴细胞把外来分子当作自身的。但是,Burnet向鸡胚胎注射流感疫苗以证明他的理论的努力并没有得出所期待的虚假反应。
1953年,在伦敦大学学院工作的Rupert E.Billingham、Leslie Brent和Sir Peter B.Medawar在Burnet失败的地方取得了成功。这三位正在探索从一个个体向另一个个体进行植皮的方法,以便治疗烧伤病人等。Medawar以前曾发现,由于存在免疫应答,人体会排斥这种皮肤移植。当他读到Burnet的理论著作后,Medawar和他的同事们着手向近亲繁殖的小鼠胚胎注射从不同的小鼠品系聚集的脾脏衍生细胞。有些胚胎因为这种侵害而死亡,但那些得以成活并长大的小鼠能够接受供体品系小鼠的移植皮肤。一只小白鼠身上所长的一块黑毛皮,明显地展示出主动获得免疫耐受性的这一发现。有史以来第一次,免疫细胞受到愚弄,把非自我认作了自我。Burnet和Medawar因他们的研究而分享了一届诺贝尔奖金。
后续的研究弄清了为何Burnet的实验出了偏差。Medawar的研究小组使用活的细胞作为抗原源,特别是那些能够运动到胸腺和骨髓等关键部位的活细胞。只要那些供体细胞活着,它们就继续不断地制造影响所涌现的淋巴细胞的抗原。另一方面,Burnet的流感疫苗很快就被吞噬细胞们消耗分解,没有足够的抗原能到达免疫系统来诱发相当程度的耐受性。
明确了免疫反应主要依靠身体中无数B细胞所产生的各种各样抗体后,人们提出了淋巴细胞学习避开自体细胞的机制。一个免疫反应代表了从人体所有组织中选择出来的特定淋巴细胞得到了活化。有理由相信,自体的耐受力可以看作是免疫作用的镜象对称:系统地删除对自体抗原作出反应的那些细胞。
遗传影响和环境触发因子能造成一般的免疫规律的失效。在那些情况下,B细胞和T细胞,或两者一起,可能对自体抗原作出反应,攻击人体自身的细胞,导致一种破坏性的自体免疫疾病。有些这种失调来自误导的抗体:在溶血性贫血症中,抗体攻击红血球,而在重症肌无力中,抗体把一种致命的蛋白质对准接收神经信号的肌肉细胞。在其他一些自体免疫疾病中,T细胞也充当反派角色:在依赖胰岛索的糖尿病中,T淋巴细胞摧毁胰脏里生产胰岛素的细胞,而在多发性硬化症中,T淋巴细胞把攻击对准了大脑和脊髓里神经细胞周围的隔离层。
要治疗自体免疫疾病需要清除或至少要限制免疫系统。免疫抑制药和消炎药能达到预期的效果,但这样一种鲁莽的方法不仅会压制有害的抗自体应答。而且还会压制所有有益的免疫作用。幸运的是,研究人员在朝着重建针对受害的自体抗原的特定免疫耐受力这一理想目标上取得了一些进展。
有一种治疗方法涉及到给病人服用大量的受攻击的自体抗原。实在令人吃惊的是,这样一种方法能够有选择性地抑制对那种抗原的进—步应答。研究人员用单克隆抗体阻断T细胞的抗原受体,暂时蒙蔽T细胞,同时又静脉注射抗原,也达到了类似的效果。以这些方法为基础的一些治疗自体免疫疾病的方法已经进入了临床试验阶段。
要使器官移植成功也需要中止不想要的免疫反应。原则上,外科医生可以在手术时开始提供一些免疫抑制药物,先发制人地防止淋巴细胞的攻击。大多数器官移植会引起如此强烈的T细胞应答,以致防止器官排斥作用所需的药物的剂量要比用来治疗自体免疫疾病的药物的剂量还大。幸运的是,这样的剂量在几个月以后便能减少了。更新更有效的免疫抑制药物正在使肾、心脏、肝、骨髓、心肺和胰的移植的成功率得到提高。最近做了几例小肠移植。研究人员还在致力于研制一些定向药物,它们能阻止器官的排斥应答但仍允许身体对传染性疾病作出反应。
器官移植已经变得如此成功以致医生们常常面临缺乏来自刚刚死亡不久的器官提供者的器官。为此,研究人员把他们的努力转向实施异种移植,即移植取自动物的器官。可以把内分泌腺体组织培养成失去部分抗原打击性,从而有可能有朝一日把猪的分泌胰岛素的细胞移植到糖尿病人身上。化学处理有可能把动物器官上的一些关键性分子“人化”,从而改轻免疫排斥反应的凶险。然而,异种移植面临着令人生畏的技术和伦理障碍。

对体内组织的免疫攻击不一定是可怕的。如果把它们指向癌肿,它们实际上是有益的。确实,有一种有争议的理论——免疫监视理论(当时在纽约大学工作的Lewis Thomas首先阐述的)——认为,不断地进行巡视的淋巴细胞的首要职责就是消灭癌前体细胞。
免疫系统受到药物抑制的人,他们大多数属于接受了器官移植的人,实际上在移植后不久便要比普通人群中的类似个体具有更高的白血病、淋巴瘤和皮肤癌的发病率。在对肾移植病人进行30年跟踪观察后,医生们发现,这些个体还存在许多普通癌症,如肺癌、乳腺癌、结肠癌、子宫癌和前列腺癌的易感受性有所提高的迹象。这些发现暗示,免疫监视可能至少能控制某些癌症。换句话说,与药物有关的癌症可能是除免疫抑制之外的某些机制的结果。
免疫系统在防止癌症发生方面的作用的进一步证据,来自对用病毒或用化学致癌物质诱发的小鼠癌症的研究。当这些癌细胞被移植到基因上相同的小鼠身上时,它们常常会激起很强的免疫应答,这证明了癌细胞具有标志它们属于不正常的抗原然而,小鼠身上自发的与人类癌症更相似的癌症却不会激起免疫应答。
但如果存在某些其他化学信号,自发性癌症有可能带有某些能引起免疫系统反应的肿瘤特化抗原。有一个高度有效的启动分子被称为B7。当B7被插入肿瘤的分子中时,它们能把无法控制的致命癌细胞转换成T细胞能够攻击和摧毁的细胞。B7本身不是一个抗原,但它最终有助于肿瘤细胞里的抗原分子去激活T细胞。
免疫刺激分子如B7的发现,重新引发了对研制抗癌疫苗可能性的兴趣。这种治疗方法可能有效地用于恶性黑色瘤,这是产生于色素痣的癌。这些癌含有一组统称为MAGR的蛋白质。布鲁塞尔市路德维希癌症研究所的Thievry Boon对这一组蛋白质做了深入的研究。在实验中,从MAGE衍生制得的一种肽能促进细胞毒素T细胞做出有力的攻击如果研究人员能够学会如何适当地操纵抗原,可能是通过向病人注射MAGE蛋白质或它的组分肽再配之以设计成能增强免疫力的分子,他们可能会创造出一种治疗恶性黑色瘤的有效方法。
另一种战胜癌症的方法涉及把免疫应答能力提高到畸变形态粘蛋白的程度。正常粘蛋白台有几乎被糖分子完全包覆的一个蛋白质核。许多癌细胞,特别是那些与肠胃道、肺或子宫有关的癌细胞,却具有露核的畸变粘蛋白。研究人员已经从粘蛋白的核蛋白质中鉴定出一些肽,T细胞对这些肽能做出强有力的应答。用这些肽制成的疫苗有可能去诱导细胞毒素T细胞进攻那些裸露核的蛋白质,从而杀死癌细胞。
制造抗癌疫苗是一个难题。肿瘤细胞具有极大的突变能力,它们通过丢掉或更改它们特有的抗原来躲避进攻。要治愈癌症必须杀死每一个肿瘤细胞,这对于晚期癌症病例是很不容易的。然而实验性疫苗已经显示出诱人的成功迹象。对广泛扩散性的几种癌症如黑色瘤、肾癌和某几种白血病的病人所作的试验,大约五分之一的人对这些疫苗的反应是出现了明显的肿瘤退化。但为什么有些人有反应而另些人没有反应,却仍不得而知。
许多研究人员相信,抗癌疫苗可望作为手术切除、化疗和放疗后杀死剩下不多的突变细胞的武器。这些存活的癌细胞即使在显然十分成功的主要治疗之后还会引起癌症复发。原则上,在一次丰要治疗之后要杀死剩下的几百万个癌细胞应该比治疗前要消灭几于亿个癌细胞来得容易。
尽管有这样的很有希望的创新技术,治疗传染性疾病的新疫苗和改良疫苗,仍然是免疫学研究最紧迫、最直接的应用。在这个战场上,世界卫生组织的免疫化扩大计划(EH)在普遍遇到麻烦的全球公共卫生事业中取得了值得称颂的成功。在联合国儿童基金会、世界银行、路透社和各发展中国家卫生部门的大力支持下,EPI向第三世界每年新生的一亿儿童中的百分之八以上提供了对六种主要疾病的预防。这六种疾病是:白喉、百日咳、破伤风、小儿麻痹症、麻疹和肺结核。
去年,虽然成本上的考虑限制了可供的剂量数,EPI还是在预防表上增加了乙肝疫苗。在许多亚洲和非洲国家,5--10%的人口是乙肝病毒的长期携带者,其中很大一部分人患上了严重的肝脏疾病,最终变成肝癌病人。在出生时就接受乙肝疫苗的婴儿就不会再成为乙肝病毒搏带青,从而防止了传染。即使在西方国家也值得进行大规模的疫苗接种,这不仅因为同性恋男子所面临的乙肝危险,而且因为这些国家中有许多包含了相当大的亚裔或非洲裔人口。
虽然目前的趋势令人鼓舞,但在免疫领域还有许许多多工作要做有效防止几种形式脑膜炎的疫苗还没有广泛使用。能用于防止白喉、霍乱、肺结核和流感的疫苗只是部分有效。对于啼炎、腹泻、疟疾和癌症这样的由人类乳头状瘤病毒和腺热病毒所引起的许多普通疾病还不存在广泛适用的疫苗。此外,富国和穷国同样面临着把疫苗送到需者手中并弄清疫苗确实被使用了这样的具体操作上的问题。世界卫生组织迫切需要资金来支撑它在研究与开发上的卓有成效的努力。
制造艾滋病疫苗是免疫学研究人员所面对的一个最紧迫又最艰难的任务。现在全世界至少有一千万人感染了能引起艾滋病的人类免疫缺损病毒(HIV),其中的大多数人生活在发展中国家。HIV具有一种惊人的突变能力,它能躲在淋巴细胞和清除细胞中,以避开免疫系统。但仍有一些令人鼓舞的迹象表明,HIV能被击败。HIV常常在人身上潜伏许多年,这表明免疫过程把这些病毒控制了一个很长时期。抗体可中和HIV,细胞毒素T细胞至少能杀死一些带病毒细胞。一些疫苗已经防止了猴子身上的类似艾滋病感染。然而还需要几年时间来确定目前的临床试验是否真的可望成功。
艾滋病危机也提高了公众对免疫学的认识。当我出席社会或业务活动并说明我是一位免疫学家时,人们通常会说,“啊,那你一定在研究艾滋病!''他们在听说在鉴别出艾滋病之前几十年就诞生的免疫学是一门广阔的学问时,往往会大吃一惊。
而且我相信,免疫学的跨学科本质对所有的生物科学具有意义重大的好处。在我年轻时,许多研究人员担心,随着专业和子专业的激增,科学家将在越来越少的课题上做出越来越多的发现,因此科研事业将分裂成难以计数的小片,每一片都闪闪发亮,但相互间却毫无联系。
但是,一门新的、整体的生物学已经在分子生物学、蛋白质化学和细胞生物学的基础上诞生和建立起来了。它的研究领域多种多样,包括神经生物学、发育生物学,内分泌学、癌症研究以及心血管生理学。单独项领域中所做出的一项基础性发现,就会在其他领域里像象野火一样燃遍。
在这一舞台上,免疫学稳坐第一把交椅。免疫系统的细胞为生物学的基础研究提供了理想的工具。它们在试管中顺利生长,呈现出化学受体的丰富多样性,生产出高度特化有效的分子。因此,淋巴细胞也许是了解所有活细胞的最佳途径。此外,免疫学包括了许多相互交联的分子和细胞系统,研究它们如何在整体上对生物体起作用。于是,免疫系统已经成了生命过程的一个指令模型。该模型的总体图已得到了充分的展示,这为今后的研究提供了一块坚实的跳板,但也为最勇猛无畏的探索者留下了秘而不宣的部分,可以让他们充分地施展身手。
请 登录 发表评论