现已证明,构成这种致命性疾病基础的遗传缺损会消除或阻塞一种关键性的通道,即盐的一种成分由此进入并保留在细胞中的通道。

吻孩子的前额尝到咸味时,灾难就降临到那个孩子的身上,他被着了魔并很快会死去。来北欧民间传说的这一谚语是最初提到的现在被认定为囊性纤维变性的这一常见遗传病。正如这种说法所暗示的那样,这种疾病曾在婴儿期惯常地杀死孩子,而且往住以汗中含过量的盐而得以鉴别。盐眉是更为温和的表现之一。这种继承的遗传异常还能破坏肺,并引起胰脏、肠道和肝脏的严重损伤。过去数十年间在治疗方面的进展已为受折磨的孩子们带来了曙光,使一半以上的孩子可存活到20多岁或更长。但是,尚无一种被认可的治疗方法能在生化异常上根治这种疾病。同时也没有哪种治疗方法能够排除早期死亡的幽灵。
由于研究人员希望做得更好, 他们约在15年前就开始试图鉴定可带来囊性纤维变性的特异性遗传紊 乱。几乎经过10年的奋斗之后,他们已分离出受损伤的基因,并为最常导致这种疾病的突变准确定位。当时,他们只能猜测基因的正常功能——即健康DNA产生的蛋白质所起的作用。自那以后,在振奋人心的—系列发现中,研究人员已经懂得,这种蛋白质起一个通道的作用,盐的成分之一氯化物通过此通道进入并留在细胞内。他们也已解释了,对基因的损伤如何阻止氯化物的运输。他们正在研究,氯化物不能移动怎样引起囊性纤维变性的明显体征。正如所料,这些研究结果暗示出治疗的新思路,其中有的思路可能有朝一日会治愈这种疾病。
如果没有医生的开拓性的努力,即如果许多医生没有在病床旁边获得对囊性纤维变性的最初的了解,已带来医学史上这种有希望的时期的分子方面进展可能就不会到来。实际上,几十年来临床研究比生化研究获得了更多的关于这种疾病的本质方面的信息。
最重要的贡献之一是1938年来自哥伦比亚大学的Dorothy H. Anderson作出的。在对婴儿和儿童进行尸体解剖和考察了青少年的病历之后,Anderson提供了囊性纤维变性的症状和在器官中产生的变化的第一个最全面的描述。她注意到,这些变化几乎总是包括胰腺的破坏(甚至婴儿也如此),而且常常感染和损伤到肺的气道。Anderson在观察胰腺组织的显微特征的基础上还为该病定了名,叫“胰腺囊性纤维变性”。
到四十年代中期,医生们已进 一步意识到,受囊性纤维变性侵袭的器官中的导管系统和其它通道一般变成被异常浓稠的分泌物所阻塞。例如,在胰腺中,输送消化酶到肠道中的渠道几乎总是闭塞,损害了人体分解食物并从中提取营养的能力。

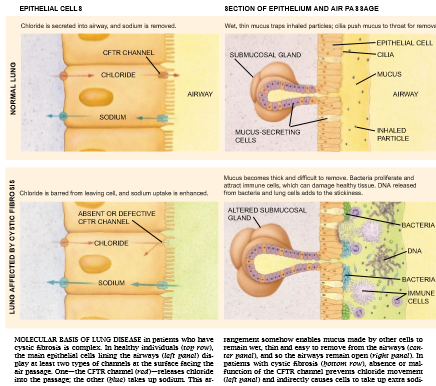
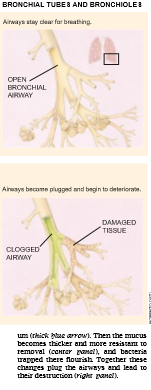
在肺中,受阻塞的是支气管和 细支气管。这些通道一般被一层薄的粘液浸洗,这些粘液可捕集吸入的粒子并将其带入咽喉而排除。但是,在囊性纤维变性患者中,这种粘液极浓,并阻止粒子排除。这种自身的变化能够使气道变窄,并防碍呼吸。此外,当细菌停留在气道中时,它们能够很容易地建立感染。这些感染往往复发,通过分泌有害化学物质和酶去补充免疫细胞而损伤肺组织。随着时间的推移,慢性感染逐渐破坏支气管通道,加上气道的堵塞,最终导致呼吸衰竭。
到1946年,对患者的研究也发现了与囊性纤维变性的遗传有关的某些东西。研究人员在研究了家族中疾病遗传的模式之后推断,囊性纤维变性是一种隐性疾病,或许是由单基因的突变所引起的,如果一个婴儿从双亲遗传了该基因的受损拷贝,因而不能产生该基因特化的蛋白质正常分子,孩子即患此病。但是,接受一个好的拷贝和一个受损拷贝不会生病。
现在已经知道,囊性纤维变性属于最普通的遗传疾病之列,并且主要侵袭白人。约5 %的美国白人是无症状的携带者,在他们的细胞中隐藏着该基因的一个个突变体。约2500名欧洲人后裔就有一名儿童带有两个有缺陷的拷贝并且得此病。 在美国,如此数量的人每年将带来约1000个新病例,现在活着的人中总共约有3万人患有此病。

从热浪中得到帮助
在描绘出遗传模式后约7年,纽约市热浪滚滚。医院发现数量极不相称的儿童患囊性纤维变性,他们明显地变得比其它青少年更容易脱水。其后,Paul di Sant’Agnese及其在哥伦比亚大学的同事发现,患囊性纤维变性的男孩和女孩从汗中失去过多的盐。多年都未能探明盐度增高的原因,但这一观察有极大的临床价值。它导致了一种测试的形成,这种测试仍然是诊断的基础:测量汗中氯化物的含量。
多年来,这种临床研究已导致了较早的、更准确的诊断和较好的治疗。例如,现在胰腺故障极少是有生命威胁的,因为当患者进食时,可用所摄入的消化酶胶囊代替他们失去的消化酶。现在消化问题一般能够被控制。肺的损伤成为囊性纤维变性90%以上的病残和死亡的原因。对肺病治疗的选择也已扩大。当前的治疗包括称为体位引流或叩胸的老式备用法。患者头朝下地斜躺着,然后一个人轻轻地、快速地拍打他们的背部或胸部——如象敲击番茄酱瓶的底部一样——试图从气道中清除粘液。但是患者也可从一系列的抗生素中获益,它们有助于防止重复感染(虽然一般未能消除重复感染)。约两年前,另一种治疗方法出现了:吸入一种称为脱氧核糖核酸酶(DNase)的药物.这种化合物旨在通过消化从临死细胞中释放的DNA的长而带粘性的链去分解粘液。
对囊性纤维变性的生化基础的研究所取得的进展比临床研究慢,但在八十年代前半期其步伐有所加快。在那时,科学家们意识到,上皮组织的机能障碍是被囊性纤维变性损伤的各个器官的毛病。(上皮是一层细胞,它在身体的不同间室之间形成一个屏障;这种细胞层常常分泌粘液,衬在肠和许多管道内。)特别是,研究的两个途径揭示,囊性纤维变性患者的上皮对氯化物相对是不可渗透的。这一发现暗示,在上皮组织中的某些输送氯化物的通道是有机能障碍的。
在一组这类的研究中,里弗赛德加州大学的Panl M. Quinton发现,汗腺的上皮衬里管道不能从汗腺的腔或穴中有效地吸收氯化物。这一发现最终解释了囊性纤维变性患者为什么有异常多盐的汗。汗一般是在汗腺的基部产生,然后通过狭窄的管道流到皮肤表面,汗最初 是富含盐的组份钠离子和氯离子的一种溶液。但是,当这种汗液送入管道时,这些离子就逃入上皮,而留下水。因此,出现的可使皮肤表面变凉爽的这种汗只是稍稍含有盐。相反,在囊性纤维变性的患者中,上皮组织不能吸收氯化物,其后由于不能从管腔中吸收钠引起汗保留过量的钠和氯,并变得异常多盐。
在其它方面的研究中,查珀希尔市北卡罗来纳大学的Michael R. Knowles和Richard C. Bou-cher研究了肺。他们发现,从上皮组织移向气道腔的氯化物减少,而上皮吸收的钠増多。现在也已证明,鼠的胰腺管道的上皮和病人肠的上皮中氯化物的输送都减少。
最终发现了基因
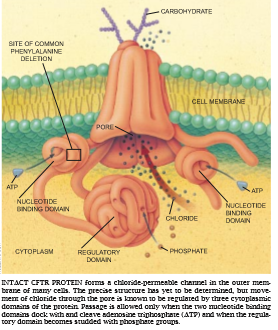
随着这些氯化物输送的研究不断地取得进展,许多科学家投入了寻找导致囊性纤维变性的基因的激烈竞赛。这种努力在1989年达到了高潮,当时由多伦多儿科医院的Lap-Chee Tsui和John R. Riordan领导的,其后由密执安大学的Francis S, Collins领导的一个庞大的合作研究小组宣布已分离出了这个基因。发现该基因的蛋白质产物可能直接或间接地影响氯化物的移动,他们将这种蛋白质定名为囊性纤维变性横跨膜传导调节器(CFTR)。在寻找这个基因时,该研究小组还鉴定出了 DNA异常,这似乎能解释约70 %的囊性纤维变性的病例。常常表示为△F508突变的这种畸变因这种基因缺失三个核苷酸(DNA的构件)造成。这种缺失引起基因的蛋白质产物缺乏一种氨基酸:在508位置上的苯丙氨酸。
这一报告对关心囊性纤维变性的每一个人都是极大的振奋,它可望开辟新的认识和新的治疗选择。然而,研究人员希望再获得额外的证据,因为正确的基因已被分离出来。在囊性纤维变性患者的细胞中插入—个健康的基因,并因此而改正氯化物运输的缺陷可获得强有力的支持。令人失望的是研究人员难以构成即使是该基因的简略形式。但是,至1990夏季,我们的同事Genzyme公司的Richard J.Gregory已解决了这一问题。
我们两人以及我们的合作研究者不失时机地将该基因插入从囊性纤维变性患者气道中分离的上皮细胞中。接着我们将这些细胞暴露于环腺苷酸,这种分子一般促进氯化物在气道上皮中运输,而对囊性纤维变性患者的组织没有影响。我们惊异地发现,现在环腺苷酸引起氯化物从治疗的细胞中流出;该基因已明显地使这些细胞正常。不只是我们感到高兴,Collins和他的许多同事用不同的方法在胰腺上皮细胞中亦获得了相似的结果。
用培养细胞获得的成功表明,向患者提供健康的CFTR基因可能改正他们所造成的生化异常——一种诱人的可能性。但是我们也知道, 正如将要看到的那样,对于达到那—目标还存在着许多障碍。同时另一个明显的问题已笼罩在这一领域:正确地解决CFTR蛋白质怎样影响着氯化物的移动。
这种蛋白质起什么作用?
蛋白质中氨基酸的线性序列(一旦该基因被分离出来,它容易推断)对蛋白质的正常行为提供了些直接的线索。这种序列明显地很象在称为运输腺苷三磷酸酶(traffic ATPase)或ABC运送器(因为它们带有称为ATP结合盒的东西——ATP binding Casse-tte)的蛋白质家族中所发现的序列。这种相似性表明,CFTR蛋白质在它的行为和它的折叠式三维结构方面可能也类似于这一家族。
运输ATP酶家族包括细菌用来某送营养物质通过它们的细胞膜的许多蛋白质,它还包括抗药性蛋白质。这种蛋白质遗憾地从癌细胞中排斥化疗药物[参见1989年7月号 《科学》中Norbert Kartner和 Victor Ling所著“癌症的多种抗药性”一文]。当折叠时,这些ATP酶一般有4个主要的结构单元或区:两个跨越膜(每个含有几个横跨膜的片段)和两个停留在胞质中。最后两个单元称为核苷酸结合区,它们吸收并裂开ATP(腺苷三磷酸核苷)以获得泵唧所需的能量。预计CFTR 分子实质上具有相同的形状,而且正如将要看到的那样,在胞质中存在一种附加的成分。
基于ATP酶的活性,有些研究者赞成这样的假说:CFTR是一个由ATP驱动的、能主动地将某些物质转入或转出上皮细胞的泵,然后这种被输送的物质激发氯化物通过一个分离的通道而穿过细胞膜。由于没有已知的离子通道(为了更直接地移动氯化物需要这类通道)相似于所预测的、折叠的CFTR结构,他们假设了这种复杂的设计方案。
第二个假说提出,CFTR本身附着在氯化物通道上并影响它的活性。第三个假说认为,CFTR可能直接充当氨化物通道的作用,即使它的结构与当前所认识的任何离子通道都不相同。在这种情况下,这两种跨越膜的区将成为氢离子穿过膜的孔。
随着研究的推进,数据证实了第三个概念:CFTR单独形成了氯化物的通道。我们发现,CFTR基因转移到氯化物不可渗透的细胞中,提供了移动这种离子的能力。如果该基因首先在被认为有助于氯化物通过通道移动的那部分CFTR蛋白质上被改变,通道对氯化物的亲和性就降低。这种效应是由我们的同事、衣阿华大学的Matthew P. Anderson所证明。当Riordan及其同事将高纯度CFTR蛋白质插入不含其它通道类蛋白质的人造细胞膜(类脂双分子层)中时,任何最后的疑虑都消除了。加入这种蛋白质使离子能穿过膜移动。
随后的研究阐明了在运输ATP酶中未发现的“额外”CFTR成分的功能。在这种成分的某些短序列的基础上,据推断这种神秘的片断是调节区——R——它在细胞质中的活性是受磷酸盐基团的添加和移除所控制。包括我们的同事、G enzyme 公司的 Seng H. Cheng和衣阿华大学的Devra P.Rich的试验在内的不同试验表明,当R区缺乏磷酸盐基团时,氯离子不能流入通道孔中。但是当细胞内的化学变化(特别是环腺苷酸含量升高)引起酶在R区中散布磷酸盐时,这种添加物就促进氯化物通过孔而移动。
下述设想虽然过于简单但是有帮助的:当调节区未被磷酰化时,它的行为象一扇封闭膜孔的胞质开口的门。加入磷酸盐以某种方式移动了这个区域(打开门),使氯离子进入孔。其它的分析已表明,核苷酸结合区也影响通道的活动。对于要穿过孔的离子,这些区域必须结合 ATP,并可能裂开ATP。
突变怎样搬弄是非
了解CFTR蛋白质形成氯化物的通道以及知晓这种分子的功能后,仍留下一个重要的问题需要回答:CFTR基因中的突变究竟如何导致氯化物失去运输?最普通的DNA突变——导致从CFTR蛋白质中省去苯丙氨酸508的缺失——的效果已被作了最广泛的研究。
这种缺失造成称之为胞内开放交通缺陷的现象。许多蛋白质,其中包括正常的CFTR分子。在台成后被加工。它们在叫作内质网的细胞小室内获得一些糖基,又在送到细胞膜之前在高尔基器内吸收更多的糖。而这种突变的蛋白质不能离开内质网。它的迁移被阻止,或许是因为内质网中的质量控制系统能辨別这种蛋白质被不适当的折叠了。被鉴定为有缺损的蛋白质为了降解而被标记,不允许进行进一步的加工。
虽然苯丙氨酸508突变是最常见的一种突变,但现在已鉴定出在囊性纤维变性患者中有数百个其它的突变:正如508突变是真实的那样,这些变化中的许多都可阻止蛋白质向细胞膜前进。有些变化完全阻止CFTR蛋白质的生成,但仍然有其它的变化允许蛋白质的生成并插入细胞膜中。但妨碍CFTR分子进行正确的运作。在最后这种情况下,这种突变由于破坏核苷酸结合区的功能或将一个裂缝引入离子输送孔的衬里中,而可能阻碍氯化物的移动。
大体上,细胞中带有两个含苯丙氨酸508突变基因拷贝的人往往有严重的疾病,也许因为几乎没有任何突变的蛋白质能从内质网中逸出。在其基因允许至少某些CFTR 到达细胞膜并在一定程度上运输氯化物的人身上,残存的活性能够形 成稍微不太严重的症状。
但是,这些方式并非总是固定不变的,因而对各个病例作预测仍然是有问题的。事实上,两对父母在其CFTR基因两个拷贝有完全相同的突变,在他们遭受的器官损伤程度上可能显著不同。产生这种偏差的原因是其它仍然了解不多的遗传因子和环境因子或许能够影响病程。
应谦逊地指出,对遗传缺陷不断增多的认识尚未完全解释肺上皮中失调的氯化物运输怎样改变钠的运输,以及这些改变怎样引起粘液在支气管通道中积累。同时发现,粘膜下层腺(位于表面上皮之下的粘液生产者)产生大量的CFTR蛋白 质。这种腺体在这种疾病中起什么作用呢?某些细菌比其它细菌更容易侵染囊性纤维变性患者的气道这一事实进一步困惑着科学家们。例如,铜绿假单胞细菌和金黄色葡萄球菌的侵染特別普遍。对某些微生物为什么兴旺的认识只是现在才开始出现。
研究人员也想知道,CFTR蛋白质除了起氯化物通道的作用之外是否有其它功能。正在被研究的可能性之一是,CFTR可以帮助调控氯化物的通道有别于CFTR。研究人员还断定,这种分子以有利于某些细菌定殖的方式间接改变上皮表面上的糖混合物。
治疗的策略
尽管还有一些问题尚未解答,但自1989年已获得的知识业已表明,有几个途径可以治疗囊性纤维变性。其一是提高不同种类的氯化物通道的活性以补偿CFTR氯化物通道的损失。例如,已知钙离子控制的通道存在于上皮细胞的面对腔的表面中。这些分子一般不能阻止 CFTR通道的损失,但是或许它们的氯化物传导作用能够人为地增加。正在患者中测试这种可能性。
总有一天医生也能向需要 CFTR蛋白质的细胞提供纯化的这种物质。培养细胞的研究已表明,这种蛋白质分子能够改正带突变 CFTR基因的细胞中氯化物的流动。在理论上,另一种战术是用药物从内质网护送突变CFTR分子通过高尔基器并进入细胞膜。这种想法似乎值得深入研究。因为已陷入内质网的△F508突变体CFTR蛋白质当试验性插入细胞的外膜时,功能一般可很好发挥。
但目前,我们知道没有哪种药物能矫正胞内的交通异常。一个尚未进行试验的不同方法将用药物提高任何突变CFTR通道的活性以找到它们通向细胞膜的路径。
但是,最吸引人的治疗选择是基因疗法。它旨在向需要的细胞提供CFTR基因的正常拷贝。如果一切顺利,插入靶细胞的DNA应该直接合成正常CFTR蛋白质,并在囊性纤维变性的本质上逆转最初的生化异常。引入这种基因是一种受欢迎的方法,因为它能代替CFTR蛋白质的所有功能,包括任何尚未被认识的功能。
研究得最多的基因疗法是利用病毒进人细胞的能力,在这些病毒中带有它们的DNA。我们以及其它的人已对腺病毒作为基因携带者或介体给与了特别的注意,因为这些微生物能够自然侵染人的气道,但通常都会产生如感冒那样相对无害的疾病。这种腺病毒以两种方式被改变:除去某些病毒基因以防止病毒在细胞中繁殖并引起症状。另一个是以正常的CFTR基因代替除去的DNA。我们的研究小组以及当时在国家心、肺和血液研究所的Ronald G.Crystal和当时在密执安大学的James M. Wilson的研究小组已证明,这些介体能够向培养的上皮细胞和向动物的气道细胞提供这种CFTR基因。而且,这种细胞用DNA合成CFTR分子,其功能与健康氯化物通道相同。
在这些试验的基础上,几个研究小组已开始试图通过遗传工程制造的腺病毒介体向患者提供CFTR 基因。这些早期试验的目的主要是评估安全性。即使如此,我们以及其他人还测试了携带CFTR的腺病毒改正患者鼻上皮中氯化物运输的能力。我们之所以选择鼻上皮,是因为它相似于支气管通道的上皮而且更容易达到。

我们的第一个试验是鼓舞人心的。为了试验目的,我们将改变了的病毒直接用于鼻上皮的一小块上。这种治疗暂时地部分矫正了氯化物的运输。但自那以后,我们所作的相似研究就不太成功;而另一个小组所作的试验表明,氯化物的流动没有增加。这些研究结果表明,这些腺病毒介体在治疗中能够用作基因提供者之前,必须有实质上的改进。
即使找到了提高病毒提供基因的效率的方法,但另一种挑战将依然存在。上皮组织中的大多数细胞每几个月要更换一次。因此,基因治疗或许每年必须进行几次——至少直到可产生替代细胞的极少长寿命细胞能够被永久性地诱发吸收正常的CFTR基因时为止。除不方便和昂贵之外,需要多次治疗是利害关系之所在,因为人们会通过建立最终消除这种微生物和防止重复感染的免疫应答来对腺病毒作出反应,为了使基因疗法成功,研究人员必须想办法让腺病毒“躲过”免疫系统或生产出不会引起免疫应答的病毒或其他个体。
一个可替代依赖病毒的吸引人的方法是用脂肪分子包膜治疗的基因,这种脂肪分子未被免疫系统识别然而它能使这种DNA进入细胞。近来伦敦皇家布朗普顿医院的Eric Alton及其合作研究者对人类患者所作的研究表明,这种方法能够恢复氯化物对气道上皮的可渗透性,虽然这个研究小组如象我们的研究小组那样,迄今只研究了鼻组织。除此之外,以非病毒系提供基因还须提供其效率。
科学家们在准确弄清CFTR蛋白质的缺失怎样导致囊性纤维变性的表现之前。还有许多问题需要澄清。而且在任何治疗能常规地补偿那种损失之前,还有许多技术上的困难必须清除。然而,在许多方面正在取得进展。困难存在但需乐观,正在进行的研究将在今后几年内提出改进的治疗方法。
请 登录 发表评论