与对付许多种病毒的疫苗不一样,用于HIV的疫苗其任务可能不只是产生抗体。需要发明一些彻底激活免疫系统的方法,而这远非轻而易举之事。
科学家们对HIV——引起艾滋病的人类免疫缺损病毒(human immune deficiency virus)——的了解比对其它任何一种病毒的了解都多。然而开发一种能抵抗HIV感染的疫苗至今仍然是与该病毒被发现时一样严重的挑战。这个问题部分在于,与人体对大多数急性病毒感染的响应不同,天然免疫响应并不破坏HIV。这一缺陷使研究人员难以知道一种有效的疫苗应当引起何种免疫活动。
与此同时,研究人员在使用对于预防其它传染病的已经成为标准形式的疫苗制剂时——例如完整的死病毒或弱化的活病毒——必须极其谨慎。如果这些形式的HIV疫苗引起了感染,其后果可能是毁灭性的。因此,疫苗专家们必须寻找其它的替代办法来使人产生对HIV的免疫能力。
疫苗的作用是使免疫系统在遇到引起疾病的有机物时能别它们,从而为个体提供保护。在HIV的情况下,成功的疫苗应当能消灭侵入人体的病毒并迅速地破坏任何被病毒感染了的细胞。
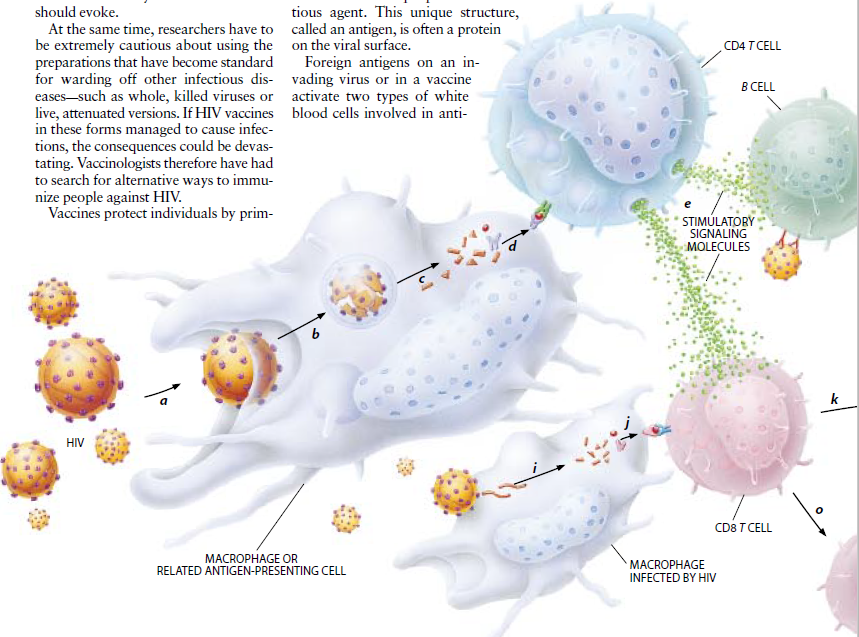
大多数疫苗激活免疫系统的所谓“体液”部分,激发保护性抗体的形成(抗体就是给游离病毒——在细胞循环的病毒——作标记以便将其消灭的分子)。抗体识别出传染性有机物的某一独特成分并与其结合。这一独特成分称为抗原,常常是该有机物毒面上的一种蛋白质。
侵入体内的病毒上的外来抗原或疫苗中的外来抗原激活参与抗体制造的两种类型的白细胞。在接触抗原后,所B淋巴细胞就达到成熟并产生抗体。此外,助手T淋巴细胞(也称为CD4T细胞)引导B细胞制造更多的抗体或引导它采取记忆B细胞的形式。
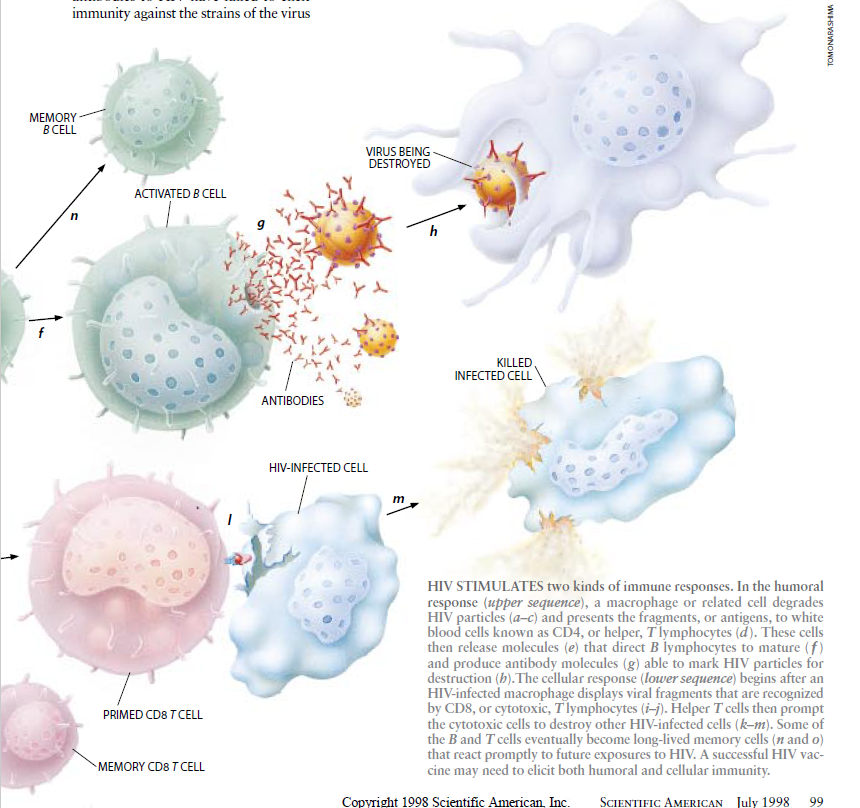
(记忆B细胞并不立划产生抗体,但在以后接触抗原时它将产生强有力的响应。)在接种疫苗后,长期产生少量的抗体以及记忆细胞的持续存在将使机体在一旦遭遇病毒后能够迅速建立起防线。
已开发出的疫苗中,没有任何一种是专门用来激发免疫系统的另一部分,即所谓细胞免疫。但是许多艾滋病研究人员现在正为实现这一目标而努力。因为至今开发出的产生HIV抗体的疫苗都未能激发对感染了HIV患者体内普遍存在的病毒株的免疫能力。
在以细胞为基础的免疫被激活的一类白细胞——称为细胞毒性T淋巴细胞(CD8T细胞)——开始增殖并在血流和组织中到处巡游,搜寻并消灭受病毒侵染的细胞。某些CD8T细胞也变成了记忆细胞,随时准备在以后碰到某种病原体时就开始行动。与抗体不同的是,细胞毒性T淋巴细胞识别受感染的细胞而不是传染媒介本身。然而,细胞毒性T细胞同免疫系统的体液部分中的B细胞一样,部分是靠助手T细胞发出的信号激活的。从长远来看,最有效的HIV疫苗很可能是既刺激免疫系统的体液部分、也刺激其细胞部分以产生抗体和被激活的细胞毒性T细胞这两者的疫苗。
由于缺乏关于免疫系统如何起作用的基本知识,设计一种能产生尽可能多的抗体或最大限度地刺激细胞毒性T细胞的疫苗的工作受到阻碍。在研究人员得以弄清如何诱使机体产生并维持记忆细胞和细胞毒性T细胞之前,试图开发HIV疫苗的研究人员将不得不多多少少地依靠反复的试验和摸索,希望能借此找到一种起作用的方法。
抗体方法
激发机体产生保护性抗体的疫苗已被证明能成功地预防小儿麻痹症、麻疹和流行性感冒。现在经过最广泛检验的HIV候选疫苗都含有包膜蛋白(Env)的某一部分(包膜蛋白是覆盖病毒表面的分子)。由于病毒使用Env作为进入人体细胞的一把钥匙,因此,产生出能附着在这种蛋白的功能端上的抗体,将会防止HIV结合到细胞上并使细胞不会受到感染。
Env(也称为gp160)实际上是两个单元的结合。一个单元是gp120,即一种被糖类包复的蛋白,它从病毒的膜中伸出.并与人类T淋巴细胞表面上的受体相互作用。另一个单元是gp41,它是使gp120附着在病毒膜上的小蛋白。gp120和gp160都曾作为候选的HIV疫苗在志愿受试者身上进行过试验。
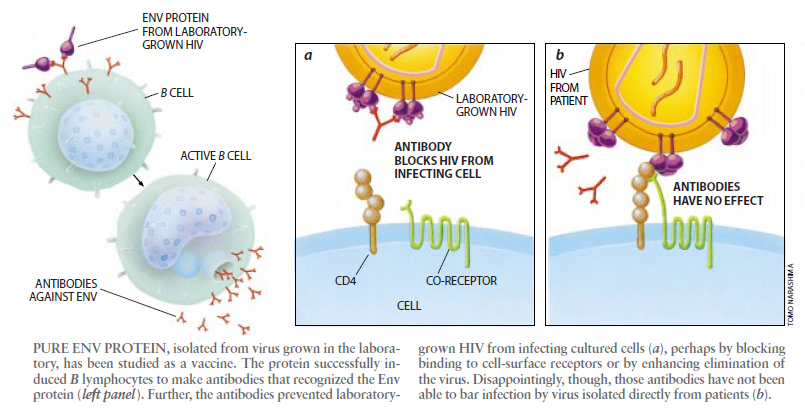
在试验中,这两种蛋白都激发抗体的产生,此结果点燃了人们的这样一种希望,即它们可能成为一种有效的HIV疫苗的基础。此外,所产生的抗体有效地中和了试管中的活的HIV,从而使它不再能够感染培养的人类淋巴细胞。
遗憾的是,这些抗体只识别同用来产生疫苗的HIV病毒株相似的病毒株。疫苗制剂中的gp120和gp160蛋白,是用实验室中培养的HIV病毒株制出的。针对这类在实验室中产生了适应性变化的HIV病毒株蛋白的抗体,不能有效地中和直接从被感染的患者身上分离出的HIV病毒株;这些分离物感染培养细胞的能力很强。
为什么抗体不能中和直接从患者身.上得到的HIV呢?实验室培养的病毒株中的Env蛋白的结构似乎比患者分离物中的表面蛋白的结构要松散一些:分离物中的蛋白折叠得比较紧密。针对实验室HIV病毒株的抗体可能识别的是Env蛋白的某些部分,而这些部分在患者身上分离出的病毒中通常是不暴露出来的(可能是因为识别位点藏在折叠得比较紧密的Env蛋白的内部)。这样,以实验室培养的HIV为目标的抗体就看不到从患者身上分离出的HIV上的目标了。研究人员目前正在开发一些新的疫苗,它们以患者分离物制取的表面蛋白为基础。这样的疫苗制剂可能以患者身上存在的形式呈示Env蛋白。然而,即使是这样的疫苗可能也无济于事。这类分离物上的Env蛋白可能包得非常严实并被糖类加以非常巧妙的伪装。因此,B蛋白可能无法找到许多抗原,这样就可能只产生较少几种抗体。此结果与下述发现是一致的:感染了HIV病毒的人所产生的同HIV病毒表面蛋白起反应的抗体种类通常是比较有限的。
当Env蛋白结合到一个细胞上时,它的形状将发生一定的改变。如果一种疫苗能模仿gp120在结合到细胞表面的受体上时所采取的形态,那么此疫苗在产生能够防止HIV病毒感染人类细胞的抗体这一方面可能获得最大成功。
那些感染了HIV病毒、但仍然保持健康并使病毒的复制受到遏制的人为指导设计一种有效的HIV疫苗提供了某些希望。这些长期生存者中有一部分人能产生极少量的抗体,这些抗体分离出来能够中和患者分离物中的HIV。此外,这些抗体能够中和许多不同的患者分离物中的HIV病毒,这对于一种能有效地预防广谱HⅣ病毒株的艾滋病疫苗来说是一个必不可少的要求。遗憾的是,甚至连这类抗体也不能完全解决问题。培养细胞的试验表明,抗体的浓度必须高得惊人,才能有效地阻止HIV进人细胞。
纯净的蛋白疫苗可能并不是激发抗体产生的最佳途径:在分离中,gp120似乎并不具有一种精确的形态,而gp160则团聚成一种效率不高的聚合体。为了克服这些困难,研究人员现在正在试验旨在以更自然的形态呈示Env蛋白的两种不同的疫苗策略。
一种方案是使用完整的死病毒粒子。这种失能形式(disabled form)的HIV不能繁殖,但可以向免疫系统呈示更自然的Env蛋白形式。有了较好的目标,B细胞就可以产生质量更好、数量更多的保护性抗体。
制造死病毒疫苗需要一种严格的失活程序,因为残余的病毒(甚至残余的病毒遗传材料)可能造成潜在的危险。然而,过于严格的处理又会降低疫苗的效力;失活过程可能使HIV摆脱它那连接并不紧密的gp120。因此,许多研究人员逐渐放弃了这一设计方案,尽管gp120的稳定性问题最终可能会解决。
Env蛋白也可以嵌在“假病毒粒子”中呈示给免疫系统。假病毒粒子是一种与病毒粒子相似的人造结构。可以设法使这些空的类脂壳只携载gp160蛋白。假病毒粒子比完整的死病毒安全,因为它们没有可能传播HIV感染的基因。遗憾的是,假病毒粒子非常难于以稳定的形式制备和产生。但研究人员希望很快就将有较稳定的假病毒粒子用于人类的安全性试验。
补充细胞毒性T细胞
为了产生激活的细胞毒性T淋巴细胞,需要采用不同的疫苗策略。虽然表面蛋白或甚至整个死病毒粒子能够引起抗体的产生,但它们激发细胞免疫的效果并不好。细胞毒性T细胞识别出在被感染细胞表面上出现的外来蛋白的短片段。被感染的免疫细胞在消化病毒蛋白——既包括Env之类的表面蛋白,也包括推动病毒的复制与装配的内部蛋白——的样本时产生这些抗原肽。然后一个载体蛋白(cartier protein)把这些蛋白片断送到细胞膜上,并在细胞的外侧显示出来。
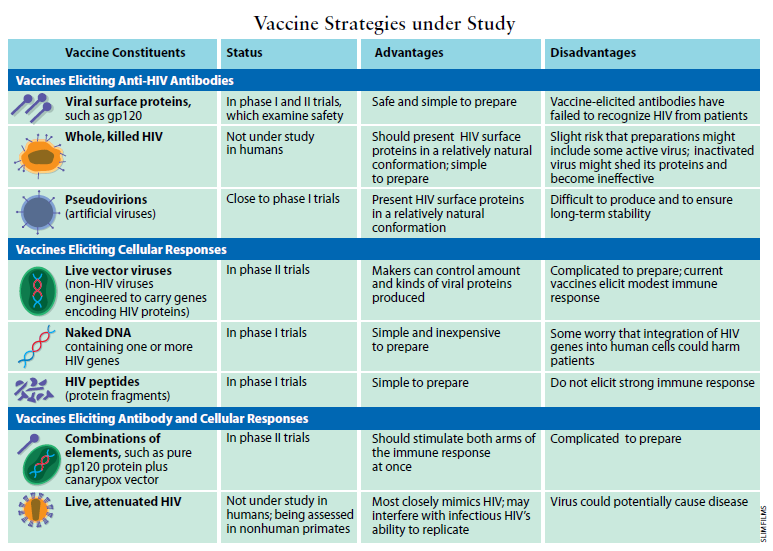
为了使一种HIV疫苗激发以细胞为基础的免疫作用,该疫苗必须引导选定的细胞合成并呈示HIV病毒在正常情况下制造的蛋白的一种或一种以上的肽。这些细胞将诱使机体产生一个针对所有呈示病毒肽的细胞的免疫响应(包括那些真正被HIV病毒侵入的细胞)。
预防小儿麻痹症的萨宾(Sabin)疫苗是用活的脊髓灰质炎病毒制成的,这种疫苗已被证明能激活细胞毒性T细胞以对付被脊髓灰质炎病毒感染的细胞,但它不会引起小儿麻痹症,因为其病毒的毒力已经在实验室中通过某些遗传突变而被削弱了。然而,至今还没有发现有任何一种突变会把HIV转变成一种完全安全的疫苗。
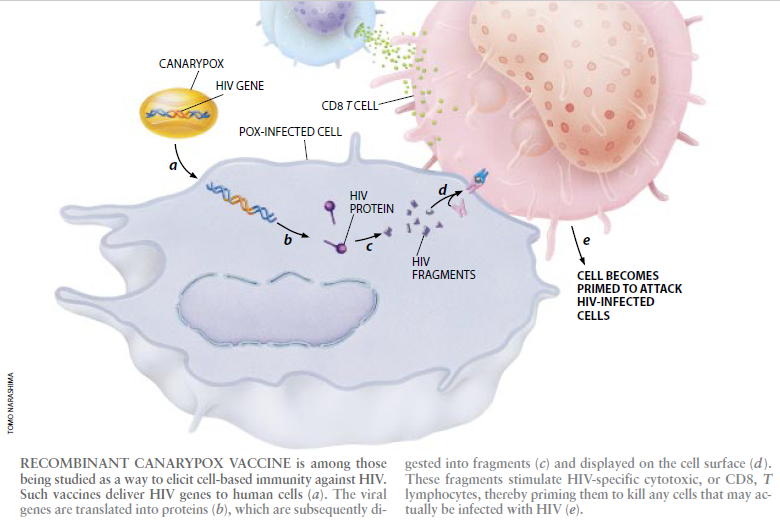
但是研究人员目前正在研究其它一些方法来诱使细胞产生并呈示HIV蛋白。一种方法是构造所谓的活载体疫苗(live vector vaccine),它利用了不同的病毒侵入细胞的能力。研究人员将某些选定的HIV基因插入一种无害的病毒中,然后让此种良性病毒(即载体)把这些DNA送入机体的细胞中。由于基因是蛋白的蓝图,因此受感染的细胞将制造HIV蛋白。接着这些病毒蛋白将被切成片断并运到细胞表面上,在耶它们可以引起四处巡行的细胞毒性T淋巴细胞的注意。这些T细胞义将抗原刺激的作用而大量增殖,并作好准备消灭任何被HIV病毒感染了的细胞。
得到最彻底、最详尽检验的活载体疫苗是以金丝雀痘病毒为基础的。金丝雀痘病毒是天花病毒的非致病性近亲,它能进人人体细胞,但不能组装新的病毒粒子。研究人员已经设法使得金丝雀痘病毒能够运送那些控制着Env和gp120蛋白的生产以及一系列非表面HIV蛋白——例如Gag(核心蛋白Gore prorein)和蛋白酶——的生产的基因。在人体中检验过的金丝雀痘疫苗至今已被证明是安全的,激起了中等程度的细胞毒性T细胞免疫响应。为了激发更有力的免疫响应,研究人员正在开发将在受感染的细胞内产生数量更多或种类更多的HIV蛋白的病毒。给与多剂疫苗可能有助于产生并维持大量被激活的细胞毒性T细胞。
其它一些研究人员则在考虑给与病毒肽——即病毒蛋白的片段——以诱发免疫响应。由于来自病毒蛋白的抗原肽激活细胞毒性T淋巴细胞,因此或许可以起疫苗的作用。遗憾的是,肽本身并不会使人体引起强烈的免疫响应,无论是细胞免疫响应还是以抗体为基础的免疫响应。肽可能在到达目标细胞之前就被降解了,也可能未被遇到它们的细胞有效地呈示。开发出更好的辅药——即同疫苗一起使用以诱发免疫系统产生更强烈的响应的药物——或许会对肽疫苗有所帮助。
诱发细胞免疫响应的一种相当新颖的方法是注射“裸的”HIV的DNA——也就是不用蛋白质或脂类来递送或保护的遗传物质。科学家们一度认为,裸的DNA将会很快降解,因此不可能成为一种有效的疫苗。然而实际上DNA的确会进入细胞并能够引导病毒蛋白的生产。在用老鼠和非人类灵长目进行的动物试验中,DNA疫苗成功地产生了能识别HIV蛋白的细胞毒性T淋巴细胞。在部分实验(但不是所有实验)中,DNA疫苗保护了动物以后得以免遭随后的HIV感染。在动物和人体上进行的进一步研究正在评估这种方法的安全性和有效性。
结合策略
最有效的策略——也是在人类试验中得到最充分研究的策略——采取了双管齐下的方法,即把免疫系统的两个方都动员起来。例如,一位患者可能接受HIV合并金丝雀痘病毒的疫苗,而病毒携带着能激发细胞免疫响应的Env基因。几个月后这同一位患者可能接受纯gp120以诱发抗体的产生。这样一种联合使用两类疫苗的策略称为“起动促进”法(prime boost),因为金丝雀痘载体使细胞毒性T细胞起动(即作好准备),而gp120蛋白接着就刺激抗体的产生以加强或者促进免疫响应。
初步试验已经证明,通过这种联合策略接种的人既产生了抗体,也产生了细胞免疫活性。但是所产生的抗体是针对在实验室中产生了适应性变化的HIV病毒株的,而细胞毒性T细胞响应则不强烈。下一代联合疫苗将使用携带更多的HIV基因的金丝雀痘病毒,而这些HIV基因能产生数量更大的病毒蛋白。至于疫苗的“促进”部分则可能含有从患HIV病毒所制得的gp120蛋白。这种疫苗现在正在生产,或许很快就能准备好用于人体试验。
许多研究人员也在继续考虑开发一种活的减毒HIV疫苗。由于这样一种疫苗相当逼真地模仿活性HIV病毒,因此从理论上说它应当能有效地诱发细胞免疫响应、以抗体为基础的免疫响应以及可能还有其它一些未知的保护方式。科学家们希望,通过系统地删除对HIV的复制必不可少的基因,他们能开发出HIV病毒的一个变种,它既能引起强烈的免疫响应,同时又不会使人患上艾滋病。
最近有一批医生自愿参加一种活的病毒HIV疫苗的首次临床试验。这样一种试验计划将使研究人员能够监视自愿人员的免疫响应并研究疫苗的长期安全性。自愿参加试验的医生们相信对这种方法进行检验的价值将胜过给他们的健康带来的潜在危险。他们的计划现在仍存在着很大的争议,而我们和其它许多研究人员则认为,应当在非人类的灵长目动物上对减毒的HIV病毒进行更充分的研究之后再进行人体中的试验。
猴与艾滋病
以活的弱毒猿类免疫缺损病毒(SIV)为基础的疫苗已在恒河猴和其它非人类灵长目动物中进行过试验。(SIV是HIV病毒的近亲,它感染猿猴。)感染了致病性SIV病毒株的猴将产生一种与艾滋病相似的综合征。通过研究这个猴类模型,科学家们能够检验活的减毒疫苗的安全性以及在接种了疫苗的猴子随后接触致病性SIV病毒株时这些疫苗保护它们的能力。若干不同的弱毒SIV疫苗已被证明对于抑制一种野生型病毒的生长是非常有效的。
在恒河猴中这种免疫作用的基础不是十分明了的:那些获得了有效的保护因而免受SIV病毒之害的猴子不一定具有高水平的中和抗体或激活的细胞毒性T淋巴细胞的能力。疫苗的保护效果可能是抗体、助手T细胞和细胞毒性T细胞免疫活性的共同作用所造成的。这些效果也可能是来自免疫作用的其他方面。为了确定SIV疫苗如何激发保护作用,需要进行更深入的研究。
虽然初步的研究提示活的弱毒SIV是高度安全的,但是更加深入而广泛的安全性研究则开始显示有越来越多的接种过疫苗的动物朝着与艾滋病类似的综合征的方向发展,甚至在这些动物未接触野生型病毒时也是这样。这些研究现在正开始考察数目更多的动物,但是其结果却提示活的弱毒疫苗可能不会产生充分的、长期的免疫作用,甚至可能引起疾病。这些结果也意味着研究人员在人身上试验这样一类疫苗之前必须非常谨慎。
前景预测
如果受HIV病毒感染的个体的免疫系统无法消灭这种病毒,那我们为什么要期望一种激起同样的免疫响应的疫苗去防止HIV感染呢?疫苗的作用是使机体获得免疫上的“占先”优势,也就是让免疫系统作好准备,在HIV病毒刚一出现时立刻对它展开攻击,而不是在遇到病毒后还要花一段时间去从头组织对病毒的防御。这样,疫苗诱发的免疫就可以在受天然感染的机体未能制止病毒的情况下成功地遏制病毒。
但是,现在还没有证明预防HIV的免疫接种是可能的,因为还没有任何保护性的候选疫苗进入第三阶段试验(第三阶段试验就是旨在评估疫苗对人的有效性的大规模试验)。此外,HIV的广泛的遗传变异性可能会削弱正在研制的任何一种疫苗的用处,因为从世界上不同地方的患者身上分离出的HIV病毒株,其ENV蛋白(以及在较小程度上还有其它一些蛋白)具有显然不同的结构。这些差别(或者是我们尚未识别出来的其它一些差别)是否将严重地阻碍疫苗的研制,现在还无法确定。
但是仍然存在着希望。随着人们对HIV感染的致病机理获得更充分的了解,研究人员已经意识到,如果能够设法使血中的HIV病毒被保持低浓度,那么一个感染了HIV的人可能永远也不会发展成患艾滋病。这一认识非常鼓舞人心,因为它意味着即使是部分地有效的疫苗在控制患者体内病毒数量方面的作用也可能是有价值的,这样疫苗就可能减轻患者的感染程度及其表现出来的症状。

今后5年内研制出一种适合于在人类中广泛使用的疫苗是不大可能的。即使“起动-促进”联合使用的方法看来会刺激细胞免疫活性并产生良好的广谱抗体,但仍然需要进行大规模的临床试验才能证明这种方法的价值。单是进行这些试验就需要好几年的时间。与此同时,研究人员仍将继续探索每一种可能有助于免疫系统同HIV病毒作斗争的方法。
请 登录 发表评论