目前,人们注重与抑郁症相关的生物学研究。已有的发现将为常常发展成致命的心理障碍疾病治疗提供更好的前景。
美国小说家Willam Styron在1990年所写传记中,冷淡地描述了他在沮丧时期的心理状态。
“精神病医生问我是否想自杀,我迟疑了—下回答说是的。但是我没有详细说明,因为没有必要这样告诉他。在我眼里,屋里所有的人和物品都是我自我毁灭的工具。可以用房顶和房外的枫树上吊,可在汽车间吸入一氧化碳,可以用浴盆接被我割开动脉后的血流,抽屉里的餐刀对我只是一件自杀工具而已。我还在想着其它的死亡方式,心脏病突发死亡来得突然,可以免除我自杀的罪名。我还幻想穿短袖衬衣长时间地在树林里散步,使自己因长时间受冷而造成肺炎,还设想径直走向附近高速公路上奔驰的大卡车,来造成一起交通事故,⋯⋯这些可怕的幻想,让正常人恐惧,而对心情极度沮丧的人则是极具诱惑力的梦想。”

正象上述段落描述的那样,临床上的抑郁症完全不同于每个人时常会产生的那种忧郁情绪,也不同于丧失了亲人时的那种极度悲哀。抑郁症是过度忧虑并伴随有其它许多症状,它要严重和危险得多。患者除了有心思想自杀外,许多人还困扰在罪恶感和无用感中。他们在下列方面出现困难:清楚地进行思考,记忆以及对事物的兴趣等。同时也表现出焦虑,精力不足,吃睡困难或吃睡过度等症状。
心理学家和神经生物学家时常发生争论,是自我毁灭的行为和自我贬低的意识,还是生物学过程引起抑郁症。然而,离开大脑的意识是不存在的。有足够证据指出,无论开始的“扳机”效应是什么,抑郁症最终的共同途径总是包括了脑部的生物化学变化,正是这些变化产生深度焦虑和抑郁症的显著特征。人们一直在不停地探索上述变化的完全程度,但直到最近几十年(特别是近几年)这种努力才取得较快进展。

与此同时,我们当中有些人却取笑抑郁症的神经生物学研究,说这好象瞎眼的研究者去摸索一个巨大而神秘的精灵的不同部位,还妄图搞清其逻辑关系。事实上,我们的所有发现不都是交叉的,某些抑郁症患者的明显的生物化学异常,并不同于另一些患者表现的主要指标。将所有的研究发现汇集后,最终会让我们理解抑郁症的详细机制并改善现有的抑郁症诊断,治疗和预防方法。
紧迫的目标
子目标之一是区分出抑郁症不同的个体特征。例如对某些人,特异的神经递质(神经细胞之间携带信号的分子)兴奋性降低是主要的,而对另一些人,激素系统的过度兴奋更具影响力(激素在血液中循环,可远离分泌部位起作用)。另一个相关目标是找出简单的生物学标志物以对患者进行分类。标志物应是这样一些分子,可在血液或脑部区域观察它们的水平是升高还是降低。
对抑郁症患者检查了这些标志物后,从理论上讲,精神病医生就可以根据该患者的特异生物学异常症状开出处方,就象对一个主诉喉炎的病人在进行快速检查后,若结果是阳性,立即就可开出相应抗生素一样。而眼下精神病医生只能通过直觉法和尝试法选择药物,一直到选出适宜的药物,这需要较长时间。对企图自杀的患者,在治疗过程(该过程还常常配合了心理治疗,但对抑郁症相当严重的患者,光心理治疗是不够的)的数周和数月都存在危险。
尽管目前的抗抑郁药较以前的副作用小,对许多抑郁症的治疗也有极大帮助,但改进现行治疗方法还是相当重要的。抑郁症患者伤亡数仍在继续增加,夺去了许多人的生命,导致社会生产率的降低。上述趋势大得令人吃尺。在美国,有5—12%的男性和10—20%的女性在其一生中的某个时期有过较严重的抑郁症发作史,这些人中的一半有不止一次的发作,而多达10%的人(约占美国人口的1.0—1.5%)还有抑郁症发作以外的躁狂症状,这种症状称躁狂性抑郁症或双相情感障碍。躁狂症表现为睡眠减少,语言加快,狂妄自大,过度兴奋,喜欢导致自我毁灭的活动,如泛滥的性生活,寻欢作乐,无目标地驾车行驶。
抑郁症不仅使人痛苦和无力,还是人类的潜在杀手。约有15%的抑郁症和双相情感障碍患者自杀。据美国疾病预防和控制中心1996年的报道,精神病引起的自杀列在了死亡原因的第九位,仅稍次于艾滋病,有30862人死于精神病。多数专家认为该数字是大大地打了折扣的。因为考虑到能让家人获得保险或免于尴尬。抑郁症自杀者会设法让医生对其死因下其它诊断,一些交通事故里也隐藏了自杀行为。
抑郁症带来的经济损失也很大,据估计,1992年抑郁症造成的经济损失高达43亿美元,多数是由于减少或丧失劳动力所致。
所有的发现都表明,在急性心脏病和中风发作后,有发生重度抑郁症的高度危险,抑郁症也常常降低癌症患者的生活质量,或许会减少患者的存活时间。
基因的发现
基因学家已提供了许多抑郁症患者人群生物学成分的某些最早的证据。抑郁症和躁狂性抑郁症患病的家族性机率较大,有密切血缘关系的亲人(如子女,兄弟,父母)之间,比普通人群更易患抑郁症和双相情感障碍症。对同孪双生的子女(基因完全一样)和异孪双生子女(基因关系与普通兄弟姐妹一样)的研究也证实有遗传因素存在。同孪双生子女均患躁狂性抑郁症的机率比异孪双生子女高得多,同孪双生子女患单纯性抑郁症的机率比异孪双生子女稍高一点。

在过去的20年里,研究基因的学者花费了很大力气去研究异常基因,迄今为止还谈不上重大发现。因为抑郁症是多个基因在起作用,而每个基因起的作用甚微,以至于难以检测。
对有长期躁狂性抑郁症疾病历史的一个阿米希族人群进行基因研究后,一度认为11号染色体上可能带有一个或数个易患双相情感障碍症的基因,但此发现未被确证;某些病例在x染色体某些位置上的基因可能与其抑郁症有关,但对多数研究对象的实验未获得有关证据。最近又报道在18号染色体的某区域和21号染色体的某点与双相情感障碍有关,该发现也有待重复。
基因学者在继续进行研究,而其它学者则把精力集中在神经化学方面。多数工作集中在神经递质的研究上。多数抑郁症患者的发病原因至少部分地归结于由单胺家族某些分子组成的神经递质在信号运输的脑回路上受损。这些生化物质全都是氨基酸衍生物,其中有5一羟色胺,去甲肾上腺素和多巴胺,报道最多的是5一羟色胺和去甲肾上腺素。
抑郁症研究者早在50年代就在关注单胺家庭了。50年代早期,外科医生发现服用利血平的高血压患者中,有15%会产生抑郁症,原因是利血平可消除单胺。大约与此同时,医生们还发现,一种治疗结核病的药物能改善抑郁症患者的情绪。以后的观察揭示该药物可抑制单胺氧化酶对神经元单胺的降解,推测该物质是使单胺免降解以保持脑回路的正常,从而阻止抑郁症。这些发现还提示脑的胺水平异常降低将导致抑郁症。以上研究促使了第一代抗抑郁剂即单胺氧化酶抑制剂的发展。
去甲肾上腺素联系通道
哪一种单胺在抑郁症中最重要? 在60年代,哈佛大学的Joseph J.Schildkraut提出情绪障碍的去甲肾上腺素理沦。他提出,抑郁症与某些脑回路上去甲肾上腺素(儿茶酚胺类化合物的一种)的缺少有关,躁狂症则与去甲肾上腺素的极度升高有关。由于去甲肾上腺素水平的变化不是使每个人都改变情绪,因此该理论已作了修正。但该理论把去甲肾上腺素的消除与抑郁症环接在一起获得了实验的支持。该回路发源于脑干,起始于着色的脑桥色素核,再发射至脑部各区域,包括对情绪调节起重要作用的边缘系统一皮层和副皮层区。
理解上述神经递质的作用原理,对理解去甲肾上腺素和其它单胺与抑郁症的关系是必要的。联系两个神经元或神经细胞的点称作突触,单胺象所有的神经递质一样,从一个神经元(突触前细胞)越过一个小缝隙(突触裂隙)后附着在位于第二神经元上(突触后细胞)的受体分子表面,此结合引发细胞间变化,细胞间变化将刺激或抑制突触后细胞的点燃。神经递质的作用在很大程度上依赖于突触后细胞上受体的浓度和其性质。例如,5一羟包胺受体有13种或更多的受体亚型,在对5一羟色胺的敏感性和产生效应上均是各不相同的。
神经递质在突触裂隙的保留时间和释放数量均会影响信号的强弱一一这种性质受至少两种位于释放细胞表面的分子的影响,即自身受体和载体。神经递质分子结合突触上的自身受体后,受体给突触信号,减少自身的点燃速受和释放递质的速度。载体把神经递质分子从突触裂隙泵回突触前细胞,该过程称重摄入。细胞内的单胺氧化酶降解单胺,进而减少这些分子的释放,以此调节突触神经递质的水平。
在众多将极低水平的去甲肾上腺素与抑郁症联系起来的发现中,有一项发现是脑去甲肾上腺素的间接指标——在可得到的样品(尿、脑脊液)中去甲肾上隙素的代谢产物或副产物的水平一一在抑郁症患者常常是低的。死后检查发现,抑郁症自杀患者脑部皮层某些去甲肾上腺素受体密度增高。
对受体显示不熟悉的观察者或许会认为受体数目的升高是更多去甲肾上腺素与受体接触以及更多信号传递的征兆。但该“受体上调”模型实际上是利学工作者预测突触去甲肾上腺素是否异常低的一个模型。突触递质分子数目异常少时,突触后细胞增加受体分子,以尽可能捕捉信号分子。
最近有一个发现支持去甲肾上腺素假说:新的药物可选择性地阻断去甲肾上腺素重摄入,突触中的去甲肾上腺素因此增加,该药对许多抑郁症患者有效。有一称为Reboxetine的化合物已作为抗抑郁药在美国以外的国家上市,并在美国等待批准上市。
5一羟色胺的联系
有关去甲肾上腺素与抑郁症有联系的实验数据无疑是可信的,此数据还在不断增加。5一羟色胺进入实质性的研究阶段是在90年代,这得归功于Prozac及相关的抗抑郁剂在治疗上的成功。Prozac可以操纵5一羟色胺水平。自从Arthur J.Prange,Jr,Alec Coppen等提出许可理论以来,对5一羟色胺在情感障碍中所起作用的严谨研究已进行了近30年。该理论认为5一羟色胺在突触的耗损是抑郁症另一原因,一般认为与去甲肾上腺素水平下降有关。
利用5一羟色胺的脑回路的损伤肯定会在某种程度上破坏去甲肾上腺素信号。形成5一羟色胺的神经元从脑干的缝际核发散至中枢神经系统的各区域,包括那些分泌或支配去甲肾上腺素释放的区域。5一羟色胺耗损还通过影响其它神经元对抑郁症发生起作用。产生5一羟色胺的细胞发散到许多脑部区域——杏仁核(与情绪相关),下丘脑(与食欲,性欲,睡眠有关),皮质区(参与识别及另外更高级的过程)。——据认为它们介入了抑郁症症状。

在抑郁症患者特别是已自杀患者的脑脊液中,5一羟色胺主要副产物量减少(表明脑内5一羟色胺减少)。这一发现支持了突触5一羟色胺水平降低与抑郁症有联系的设想。抑郁症患者脑中释放与5一羟色胺形成细胞有关的表面分子数目低于正常人,提示形成5一羟色胺细胞的数量减少。在抑郁症死亡患者脑部,5一羟色胺复合受体中的至少一种——II型受体密度增高。此研究与去甲肾上腺素的研究结果—致。此受体上调现象提示突触裂隙中5一羟色胺浓度极低。
更进一步的证据来自下述药物显著的治疗效果,这些药物阻断突触前的重摄入载体将5一羟色胺从突触裂隙吸回,从而维持突触裂隙中较高的5一羟色胺水平。尽管作用机理还不清楚,50年代后期三环类抗抑郁剂(因其化学结构上有三个环而得名)即单胺氧化酶抑制剂就出现了。后来发现,这些化合物对脑部产生许多作用,包括减少5一羟色胺的重吸收,升高突触5一羟色胺水平。
也有人怀疑上面最后所列举的抗抑郁作用,但80年代后期发明了Prozac类药物以及后来的其它药物(Paxil Zoloft和Luvox),它们可以阻断5一羟色胺重摄入而不影响其它脑单胺。这些选择性的5一羟色胺重吸收抑制剂(SSRIs)已大大改进了抑郁症治疗。和以往的药物相比,它们的疗效更高。毒副作用更轻微。现在又出现了Effexor这类更新的抗抑郁药,它既可阻断5一羟色胺又可阻断甲肾上腺素的重吸收。
对5一羟色胺的研究也为了解抑郁症个体更易患心脏病及中风提供了线索。血小板(血液)活化聚集会形成血栓,堵住血脉,阻止血液向脑和心脏的流动,从而损害这两个器官。在我和其它人的实验室的实验都证实,抑郁症患者的血小板对包括5一羟色胺在内的活化信号特别敏感,5一羟色胺会增强血小板对其它更强化学刺激的反应性,抑郁症患者血小板拥有较少的5一羟色胺重摄入载体数目。换句话说,与健康人的血小板相比,抑郁症患者的血小板可能更难从周围环境中吸收5—羟色胺,降低它们对血小板活化信号的暴露。
5一羟色胺和肾上腺素回路中的一个或两个受干扰也会使许多人因此引起抑郁症。也有报导称抑郁症常伴随有特定的控制激素活性的脑回路的障碍。事实上早就有证据表明抑郁患者激素水平有变化。
激素异常
位于骶骨顶部的下丘脑调节激素分泌,产生并释放出作用于位于脑底部垂体的多肽,刺激或抑制垂体释放各种激素至血液。这些激素——生长激素,甲状腺刺激素,肾上腺皮质激素(ACTH)——控制其它激素从目标腺体释放。除对神经系统以外的作用外,还将因应答垂体激素而释放的激素反馈回垂体和下丘脑,在那里产生抑制信号以防激素生产过多。
抑郁症患者重复地表现出对刺激生长激素释放的物质的响应迟钝,也显示对下丘脑一些诱导垂体分泌甲状腺素的物质的异常应答。因此,甲状腺素缺乏引起对抗抑郁药不起作用。
所有这些都是激动人心的发现。目前,最严重的问题是操纵身体响应应激反应的下丘脑一垂体一肾上腺(Hypothalamic—Pituitary—Adrenal HPA)轴的调节障碍。当检测到对生理和心理有威胁的信号时,下丘脑增加促肾上腺皮质素释放激素(CRF)的产生,CRF可诱导垂体分泌ACTH,ACTH又指导肾上腺体在两肾顶部释放皮质醇。所有的这些变化使人体作好抵抗或逃避的准备,关闭不利于自我保护的兴奋点。例如,皮质醇加强能量向肌肉输送,同时CRF抑制食欲和性欲以提高机体的警惕性。然而,慢性HPA轴的兴奋是疾病似乎也是抑郁症的基础。
早在60年代末70年代初,一些研究小组报告未服药的抑郁症患者HPA轴兴奋性是高的。在尿,血清和脑脊液可检测到皮质醇的浓度升高这一事实,证实了此现象。数百甚至数千例的持续研究证实许多抑郁症患者特别是较为严重者,显示出HPA轴过度兴奋,该发现与所有精神病的生物学研究结果完全一致。对该现象更深入的研究揭示,抑郁症患者HPA轴的每一层次都有变化,例如肾上腺体和垂体都增大,肾上腺体过度分泌皮质醇。但许多研究者包括本人及同事在内都相信以下事实:在下丘脑和其它部位的CRF形成神经元承受了多数的HPA过度兴奋,进而出现抑郁症症状。
值得注意的是,在正常组和其它精神障碍组的对照研究中,抑郁症患者脑脊液CRF升高,抗抑郁剂和电休克治疗后CRF水平降低。死后脑组织研究揭示,同正常人比较,抑郁症患者下丘脑CRF形成神经元数目过分增加,CRF基因过度表达,CRF合成增加。动物实验也显示,CRF传递给脑组织产生的效果与人类抑郁症患者一致,即失眠,食欲,性欲和欲望下降。
神经生物学家现在还不知道怎样把基因,单胺和激素等研究统一起来。毫无疑问,外部环境也对抑郁症起部分作用,人们在童年经历心灵创伤后,后来的一生里会出现抑郁症,本文作者把这种理论称作情绪障碍的应激素质模型,以突出即刻应激和先天素质的相互作用。

观察发现抑郁症有家族发生现象,这意味在受影响的家族里,某些基因因素不知怎么会降低抑郁症阈值。基因会直接或间接降低突触的单胺水平,或增加HPA轴的应激兴奋性。基因的阈值还不足以低到能在缺乏严重应激条件下诱发抑郁症。但基因阈值可因早期有心灵创伤经历而变得更低。
我和同事们认为,早期受虐待和疏忽,不仅兴奋应激,也时常诱导CRF形成神经元兴奋性增加,这都是抑郁症患者的生理表现,若神经元从儿童期至成年期持续地过度兴奋,这些超敏细胞对轻微的刺激都会产生强烈反应,在生来就有抑郁症倾向素质的人身上,这一效果为精神障碍的形成在神经内分泌和行为应答上提供了支持。
实验模型依据
为检验应激素质理论,我们进行了一系列的实验。用标准鼠种的群体作为实验对象。让新生鼠在未成年的21天中的前10天离开它们的母亲,成年后这些被剥夺母爱的鼠的CRF形成神经元的变化与抑郁症患者一样,例如应激诱导ACTH分泌升高以及在脑某些部位CRF浓度升高。鼠皮质醇水平也升高。该发现提示,在剥夺母爱的鼠中,CRF基因总是过度表达,CRF过量形成,我所在大学的合作者Plotsky确认了该实验。
Plotsky观察到了一个鼓舞人心的现象,用一种选择性5一羟色胺重摄入抑制剂Paxil治疗后,CRF降低至正常水平,消除了受体敏感和数目增多带来的抑郁效应,患者行为正常。
我们现在还不知道为什么抑制5一羟色胺重摄入会使HPA轴正常,但可以用5一羟色胺重摄入抑制剂治疗童年有心灵创伤的抑郁症患者。Plotsky还报道停药后HPA轴和CRF的异常又恢复,提示应长时间地坚持治疗以防抑郁症复发。
猴更接近于人,对它的实验也得到相同的结果。在新生猴出生的三个月内,对母猴和新生猴的饲养同时进行三项实验:一组提供足够的食物,一组食物较少,一组是不定期地供给食物。不定期供给组的母猴则非常关注于食物并很焦虑,基本上忘记了自己的孩子,正如预测的那样,不定期供给组幼猴活动力差,在新环境中显得孤僻而冷淡,成年后其脑脊液CRF浓度明显较高。
鼠和猴的实验数据,给临床和公共卫生提出了有价值的问题。在美国,仅1995年,就报道有三百万儿童受到虐待和疏忽,至少有一百万是加以证实了的。假如上述动物实验对人也一样,即虐待和疏忽对大脑发育有持续的影响,儿童会慢慢产生应激和CRF,在后来的一生中对抑郁症有易感性而成为其受害者。
如果该结论正确,研究者很希望用非伤害性技术确定产生CRF受体的神经元活性及受体数目,以确定出这些受虐待的个体将来患抑郁症的危险性,以及现在就用抗抑郁剂治疗和心理治疗能否对那些已显示特别敏感性格的儿童免于成年后患上抑郁症有所帮助。研究者也需要进一步研究对有虐待史的成年人是否有必要一直服用抗抑郁剂,现有的药物和心理治疗能否维持人的CRF形成神经元的正常活性。
然而,应激素质模型不能解释所有的抑郁症病例。因为并非所有的抑郁症患者都有童年受虐待和疏忽的历史,那些既有家族史又有童年虐待的人更有抑郁倾向,无家族病史者,尽管有悲惨童年及成年后创伤的经历,也相对能免于严重的抑郁症。相反有遗传倾向的人,尽管童年和成年的生活较顺利,也常常会感到在与抑郁症抗争。
上述表明在抑郁症的神经生物学研究中仍有大量工作要做。但迄今取得的大量成果已足以为新药开发提供思路。一些药厂正在研CRF受体阻断剂并试验该类药物的抗抑郁性能,还有一类有希望的药物是5一羟色胺的特异受体激动剂,这类化合物有强的抗抑郁效果,但不激活神经元上那些与抑郁症无关的5一羟色胺受体。
今后抑郁症的治疗方向,将建立在我们对情感障碍的生物学理解基础上。该领域的神经生物学研究还在继续,今后的治疗会更加有效,同时副作用更小。
抑郁症的症状
美国精神病协会认为,如果一个人在相同的两星期为一周期的每一天,都有以下5种或更多的症状,那么他就具有临床上的抑郁症指征了。这些指征必须包括前两个评判准则中的至少一个,必须导致日常生活的痛苦或受损。该症状不是来自药物治疗,药物滥用,病理状态(如甲状腺异常)或不完全的并发症。正式的标准参见该协会的心理障碍的诊断和统计手册(第四版)。
口一天中的多数时候情绪沮丧(对儿童和青少年,抑郁情绪可表现为易怒)。
口一天中的多数时候,对几乎所有活动的兴趣明显下降。
口食欲大增或大减
口失眠或睡眠过度
口运动时无精打采(可从手的拧动观察到),运动缓慢。
口疲劳,打不起精神。
口极端的无用感,或不该有的负罪感。
口没有判断力,无法思考或集中精力。
口反复地想到死或自杀。
成像在抑郁症研究中的作用
在过去的25年里取得的脑部成像方面的显著成就,使我们可以用非损伤性的成像技术作为研究抑郁症神经生物学的辅助手段,该技术也可能帮助我们揭示出解剖上和功能上易患精神障碍性疾病的标志物。
目前用来分析脑部结构的核磁共振成像技术或其它手段,尽管其真正意义还没弄清,已产生一些很有意义的发现。对躁狂性抑郁症(双相情感障碍)病人,特别是老年患者的副皮层灰白物质的研究揭示,与情感有关的某些区域(如基底神经节,丘脑,脑干)出人意料地有大量的亮点,亮点的过度集中通常反映了神经元的丧失,但哪种神经元从这些区域丧失仍不清楚。
同时,在长期抑郁症患者中,各种脑物质的体积减小。作为边缘系统一部分的海马就是一例(边缘系统是与情感,记忆有关的部分)。对抑郁症已缓解老年妇女的研究发现,她们的海马比其他同龄妇女的要小,该发现与动物实验数据一致:皮质醇慢性地过度分泌(发生在许多抑郁症个体)会破坏海马细胞。人们尚未弄清神经元在海马和其它区域是如何丧失的,又如何促进抑郁症形成,但做以下猜想是合理的:受影晌的神经元可能包含了对5一羟色胺及去甲肾上腺素有响应的神经元。正如正文所指出的,这些信号分子(神经递质)的减少在许多抑郁症病例中起了作用。
对脑部功能成像研究——当一个人处于静息或沉浸于某项工作时,脑部特异区域兴奋(点燃)——使我们产生了其它想法。例如,正电子发射成像技术证实,以抑郁症为主的患者与正常对照组比较,在脑的边缘和皮层区显示了不同的兴奋类型。更进一步地,对一在短期内经历抑郁和躁狂周期病人进行的研究发现,这两种状态球部的兴奋类型有巨大变化,以上研究为哪些脑部区域与抑郁或躁狂相关提供了重要线索。PET分析提示的边缘系统兴奋性增加——在左半球杏仁核——可能将是高度易感抑郁症的指标。
功能性成像技术也揭示神经递质等目标分子的浓度,从而可以针对不同的人在不同的脑部区域对这些目标分子的密度进行比较。近年来示踪性物质的研制发展也较快,示踪性物质可结合5一羟色胺重摄入载体(将5一羟色胺从突触移走)和其中的一种5一羟色胺受体以便示踪。示踪性物质的发展,对抑郁症患者的脑中5—羟色胺活性消除部位的精确定位提供了有价值的信息。功能性成像还可帮助弄清各种抗抑郁剂在脑部的具体作用。
成像技术用于研究抑郁症和优化治疗方案还刚刚开始。随着该技术的发展,对情绪障碍的理解会比以前有更大的进步。
图1.图中标示了抑郁症个体中常常发障碍的与情绪和其它功能——如食欲,睡眠,性欲,记忆一—相关的一些脑部区域。这些脑部区域除了垂体外,都广义地归为边缘系统,它们在正常情况下接收来自分泌5一羟色胺或去甲肾上腺素的神经元信号。对许多抑郁症患者,5--羟色胺或去甲肾上腺素回路的兴奋性降低。图中标示了一些5一羟色胺途径(箭头),分泌去甲肾上腺素的细胞来自脑桥色素核。
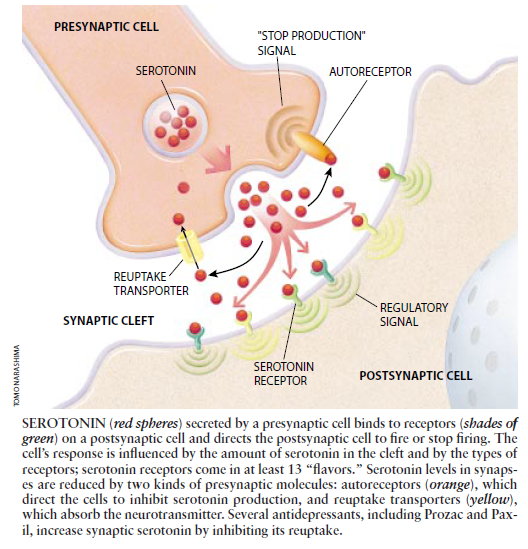
图2.突触前细胞分泌的5一羟色胺(红球)结合位于突触后细胞上的受体(绿色),指示突触前细胞的点燃或终止。细胞的应答受裂隙中5一羟色胺的数量及受体类型影响。5一羟色胺受体至少有13种。突触5一羟色胺的数量将被两种突触前分子所降低,即自分泌受体(橘黄色),它指示细胞抑制5一羟色胺的形成;以及重摄入载体(黄色),它吸收神经递质。一些抗抑郁剂如Prozac和Paxil,通过抑制重摄入增加突触的5一羟色胺。
图3.称为下丘脑一垂体一肾上腺轴(图中的实心箭头方向)的激素系统在应答应激时兴奋。大量证据揭示。此轴慢性的过度兴奋。特别是过度产生促肾上腺皮质激素释放激素(CRF)。是抑郁症形成的原因之一。例如给动物脑中用了CRF后,产生了类似于人抑郁症的症状
图4.该PET断层扫描来自一个经历了抑郁(上),情绪异常高涨(中),情绪回落(下)周期的抑郁症患者脑部图像,它显示了两种状态的不同兴奋类型。兴奋水平由蓝(低)到绿到黄到红(高)表示。
图5.PET成像发现,抑郁症患者左脑额叶前皮层和杏仁核的兴奋性增加。一些研究工作提示杏仁核兴奋性增加是将来易患抑郁症的指标。
请 登录 发表评论