一场网球赛导致了一种确定多糖序列的方法
10年前,基因统治着许多分子生物学家的头脑,但Sasisekharan是个例外。他看得更远,越过了DNA,越过了蛋白质,他看到了糖。多糖覆盖着蛋白质以及所有细胞的表面,然而那时的生物学家认为糖是惰性的,就像装阿司匹林的塑料药瓶对于治疗头疼的作用一样。而Sasisekharan则对此不以为然。他说:“我凭直觉感到这里面有某些重要的东西。”他是对的,尽管利用这个好机会进行研究需要团队合作。
20世纪80年代后期,Sasisekharan开始了他的攻读博士学位的研究工作,地点在麻省理工学院化学工程系Robert Langer的实验室。Langer的实验室拥有“发明工厂”的美誉。这经常让普通学生感到战战兢兢,但是Sasisekharan没有被吓倒。他向Langer提出要做一个无人问津的项目,于是Langer让他去自由地研究无性系肝素酶。这个课题曾经让以前的博士后和研究生束手无策。这种酶能切割包围在细胞外面的肝磷脂族糖。这样,储存在细胞外阵列中的生长因子(即细胞外一种类似组织的连接薄层)得以释放。医生使用肝磷脂来防止外科手术后血液凝结成块,以及治疗引起心脏病发作的血栓。
刚开始时,Sasisekharan打算采用一种基本方法:寻找一种化合物的成分序列,然后通过成分序列来揭示该化合物的结构,并最终确定该物质的工作机理。要想真正弄清肝酶素的化学本质,Sasisekharan需要一个帮手。出乎意料的是,他在网球场上找到了这样一位帮手。Venkataraman在麻省理工学院的化学工程系攻读博士学位,师从Hatton和K.Gleason两位教授。当他和Sasisekharan打网球时,两位博士生谈起了蛋白质。Sasisekharan非常诚恳地邀请Venkataraman帮助他研究肝素酶,而对方答应了。Sasisekharan说:“我让他首先制造出重组肝素酶,同时让他相信研究糖的重要性。”很快,Sasisekharan就揭示出组成肝素酶蛋白质的氨基酸的成分序列。
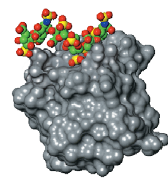
尽管如此,Sasisekharan自始至终想超越酶来探究糖的生物学作用。对肝素酶的研究很自然地使他产生了对这种酶所切割的肝磷脂族糖的兴趣。Sasisekharan首先要确定的是组成这种糖的构造单元的成分序列。然后,他希望通过这种序列来找到肝磷脂分子的三维形态。他多年前就开始为这项工作做准备了,当时,他的父亲、生物物理学家Viswanathan向他描述了蛋白质和DNA中的分子形态和相互作用的重要性。Sasisekharan强调:“我深受父亲思想的影响。”因此,像他的父亲一样,这位年轻生物学家很清楚:要想确定分子的性能,必须首先揭示其形态。
Venkataraman开始探索肝磷脂的结构。他曾说:“当我开始深入研究时,我发现关于其成分序列的资料非常少。”他和Sasisekharan需要一种快速而准确的方法,用以确定组成肝磷脂和其他大分子多糖的结构单元。肝磷脂的成分序列似乎很简单:仅仅是二糖的重复排列,或者两个单糖连接在一起。尽管如此,每个单糖可以有四种修饰位置,从而产生l6种可能的变体。因此,两个单糖可以组合成32种不同的“口味。”人类基因仅有4种基本结构单元,而蛋白质有20种结构单元,因此乍一看,糖似乎要复杂得多。
在取得博士学位之后,分别作为助理教授和助理研究员,Sasisekharan和Venkataraman在麻省理工学院再度合作。他们计划开发一组能够确定多糖成分序列的工具。首先,他们需要命名不同变体的糖。一个双糖单元有32种可能的变体,即使短链分子也会陡增到上百万种可能的组合。Venkataraman的工程背景使得他更关注数量。他声称:“这的确是一个需要多个头脑进行合作的课题。我们回顾起来,Ram使用生物化学方法,而我使用工程方法,这一点至关重要。”Sasisekharan认识到确定复杂糖类成分序列的潜在价值,而Venkataraman则设计出一种方法,能够将复杂的化合物转换为大数目的结构单元串。
为了做到这一点,他们利用计算机来跟踪各种可能的组合,计算机能够对比各种分子序列,显示它们的相同点与不同点。必要的话,计算机的计算系统能让科学家确定一种多糖分子的每一种可能的排序。
作为对糖进行命名的一种方法,他们需要确定的是,如何将这些复杂分子切割或者分解成较小的片断以便于分析。Sasisekharan开发了许多其他类型的酶和化合物作为生物剪刀。这样,他们就在制造多糖序列工具的道路上完成了第二步。
他和Venkataraman用生物剪刀切割了肝磷脂,确定了它的组成片断的数目(这取决于特定的剪刀以及被测试糖的切割位置),并且使用质谱仪测出了每个片断的质量。然后计算机会发问:当采用这种生物剪刀切割肝磷脂分子时,在所有可能的成分序列中,哪几种序列能产生这种数量和质量的片断?这可以排除一些可能性。然后他们又采用其他的生物剪刀再重复上面的过程。
最终剩下的只有一种可能的分子序列:这就是肝磷脂的结构。1999年,他们两人发表了这项成果并申请了技术专利。“在过去,确定一种多糖的分子序列可以写一篇硕士论文,而现在我们只要一天就能搞定。”Venkataraman如是说[参见本刊2002年第9期Thomas Maeder写的《新药向糖挺进》一文]。
Sasisekharan和Venkataraman花了l0年左右的时间,终于研究出攻克关键问题所需要的工具:糖的结构如何影响其活性? 同等重要的是,他们知道其研究成果将给医学带来巨大的利益。例如,他们能够设计出副作用更小的肝磷脂。为了开发这项研究的商业潜力,Langer,Sasisekharan和Venkataraman成立了一家名为Mimeon的公司。公司吸纳了一位强有力的首席执行官Alan Crane,作为Millennium制药公司主管开发的副总裁,他通过两家公司的联合,给Mimeon公司带来了20多亿美元。
在近期,Mimeon将致力于肝磷脂业务,它已经形成了超过20亿美元的市场。肝磷脂最早是从狗的肝脏中提取的。从猪肠中提取的肝磷脂是一种很好的抗凝血剂。但这是一种静脉注射类药物,而且会减少某些病人血液中血小板的含量,因而会增加大出血的危险。一种称做低分子重量(1ow-molecular-weight)的较小的肝磷脂几乎没有副作用,但其抗凝血能力也较弱。然而,Mimeon公司的科学家通过修饰肝磷脂的结构,获得了一种更好的变种——它具有高抗凝血性且实际上没有副作用。它作用于多种化合物的临床试验将在2003年开始。
而且好戏似乎还在后头。Sasisekharan和Venkataraman最近报道,如果对覆盖在癌细胞上的糖分子做细微改变,将会杀死癌细胞。这有可能刺激一系列特效抗癌药的出现。过不了几年,我们就能知道,两个男人在网球场上的交流是否会给生物医学带来一系列的得分。
形态决定功能:肝磷脂的排序【彩色分子】使得研究人员能够确定其形态。因此也能确定它是如何与生长因子【灰色分子】相结合的。
请 登录 发表评论