通常情况下,面部肌肉扭曲是亨廷顿氏病出现的第一个征兆。随后,患有此病的人经常会心不在焉,无意识的摆出各种姿势,如果患者身心都承受着巨大的压力,该病的症状尤其明显。随着病情的进展,患者会不由自主地出现近似醉酒般的舞蹈动作,而且日益频繁,最终使人致残。患有此病的人会丧失料理日常生活的能力,而且脑部开始退化,无法进行拟定计划等思维活动。在疾病晚期,压抑和暴怒(最严重的患者还会出现痴呆和精神失常)的症状交替出现,把一个从前健康活泼的家庭成员、朋友或同事变成了一个终日痛苦、卧床不起的幽灵。
这就是对亨廷顿氏病的可怕描绘,这是一种遗传性功能失调症,通常侵袭那些处于黄金年龄段(30~40岁),携带致病基因的人群。由于目前尚未研究出有效的治疗方案,所以这种疾病缓慢但无情地发展下去,15到20年之后患者将完全丧失机体功能,最终悲惨死去。虽然亨廷顿氏病主要损伤的是大脑的中枢神经系统,但大多数患者都死于长期卧床导致的心脏病或呼吸道并发症,甚至频繁摔倒导致的头颅损伤。
1993年,来自世界各国的58位科学家(包括马萨诸塞州总医院的James F.Gusella和当时在安阿伯市密西根大学的Francis S.Collins)组成的联合研究组发现了引发亨廷顿氏病的基因。此后不久,人们就能够对亨廷顿氏病患者的其他家庭成员进行遗传性测试,判断他们是否携带这种具有遗传性的突变基因。因为这种基因属显性遗传基因,通过遗传获得该基因突变形式的人注定会患上亨廷顿氏病,而且将其遗传给他们每个子女的概率都高达50%。一些人希望做这项遗传性测试,以便把今后的生活安排得更好;而另一些人情愿不知道为好。
为了给患有亨廷顿氏病的家庭带来希望,我们这些科技工作者也在努力了解突变基因引发这种疾病的原因,以及如何避开突变基因、实施对症下药的方案。我们发现亨廷顿氏病的基因突变具有双重危害性:它不但编码了对神经细胞有害的异常蛋白,而且导致这种蛋白丧失促使一种关键的生长因子产生的能力,从而使大脑的某个特殊部位得不到正常的营养供给。动物实验以及早期的人体临床试验表明,涉及生长因子的治疗可能对这种危害性有一定的抑制作用。然而,近期的研究结果只对亨廷顿氏病的病理情况做了部分解释,对其复杂性的研究仍需要继续进行。
从亨廷顿氏病到“亨廷丁”基因
亨廷顿氏病以美国俄亥俄州的一名内科医生乔治亨廷顿(Huntington)的名字命名。1872年亨廷顿详尽报道了他和父亲(也是一名医生)对纽约长岛的一个家庭进行观察时发现的一例特殊遗传性疾病。他注意到病人在无意识状态下会做出奇怪且不协调的动作,因此将这种病称为“舞蹈病”(chorea),源于希腊文choro“跳舞”一词。今天,医生们将亨廷顿氏病当作大脑最常见的一种遗传性功能失调症,患者比率是万分之一。
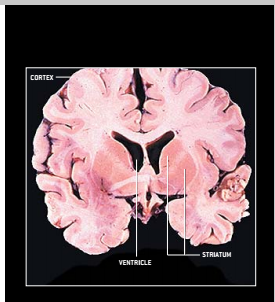
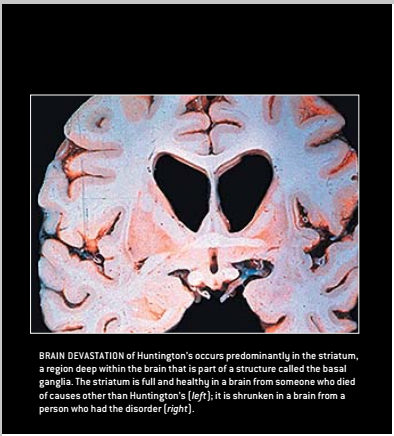
亨廷顿氏病的症状是由位于大脑纹状体的细胞或神经元的退化而引起的,纹状体是基底神经节的一部分位于大脑深处的一个区域(见右侧示意图)。正常情况下,这些神经元的功能是阻断从运动皮层(即支配运动的大脑区域)传来的兴奋信号。当这些神经元死亡后,运动皮层变得异常活跃,从而导致患者不由自主地做出各种动作。但医学界尚不清楚纹状体神经元的死亡引起精神失调症状的原因。
导致亨廷顿氏病的突变基因被称为“亨廷丁”(Huntingtin)基因,它位于4号染色体的末端。人体的基因是为合成蛋白质而编码信息的DNA双螺旋链片段。基因编码由4个称为碱基的单位结合组成,即腺嘌呤(A)、胸腺嘧啶(T)、胞嘧啶(C)和鸟嘌呤(G)。碱基相互组合成对,形成DNA螺旋链的横梯:A对T、C对G。当细胞需要合成新的蛋白质时,螺旋链自动解开、横梯分裂,这样细胞机器就能够识别编码。三个碱基形成的三联体编码是20种氦基酸中的一种,这些氨基酸以各种不同的碱基对链接,合成了人体内数百万种独特的蛋白质。
当最终锁定亨廷丁基因后,科学家注意到即使在正常人的身体中,该基因也包含了一种分子的残迹,其中的三联体CAG重复9到35次(这种扩张性的重复也可能出现在不同的基因中,也与其它几种神经退化性疾病有关)。但在亨廷顿氏病患者体中,这种残迹变得特别的长,在一些罕见的病例中不断延伸,CAG重复达250次。有趣的是,科学家发现CAG重复最多的患者比那些分子残迹短的患者发病时间早。CAG重复的数量在亨廷顿氏病家族中也可以代代递增(当突变的基因由父系遗传而来时,这种情况似乎更频繁),这种原因尚未查清。
亨廷顿氏病理论
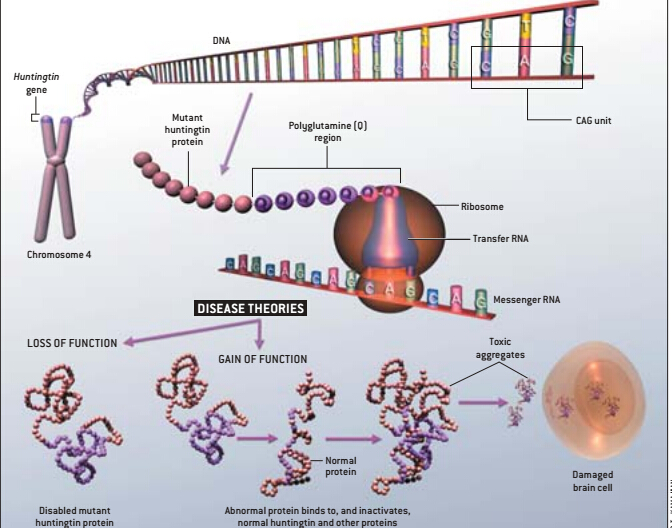
三联体CAG序列为氨基酸——谷氨酸盐编码,研究人员将其用字母Q表示。携带亨廷丁突变基因的患者体内含有亨廷丁蛋白质,这种蛋白质包含了36个以上的Q所组成的多谷氨酸盐片段。但是为什么蛋白质中的谷氨酸盐过多就会引发亨廷顿氏病呢?
最简单的解释是,过度伸延的多谷氨酸盐破坏了亨廷丁蛋白在大脑中完成正常工作的能力。这种功能丧失假说最初并没有被纳入考虑范围,因为早期的研究发现亨廷丁蛋白不但产生在纹状体中(这种疾病会导致该区域萎缩),也存在于大脑的其他部位,以及在亨廷顿氏病发病过程中不受影响的其它大脑区域。另外,人体的每个基因都有两个备份,一个来自母亲,另一个来自父亲,因此亨廷顿氏病患者仍有一个正常的亨廷丁基因备份,也应该能够合成数量可观的健康蛋白质。同样患有Wolf—Hirschom综合症(114号染色体短臂缺失综合症)的患者并没有显示出任何舞蹈病的症状,该综合症是一种罕见的疾病,特征是4号染色体(含亨廷丁基因的一个备份)的大部分区域缺失。
另一种功能增强假说认为,亨廷丁基因突变产生了一种有害的亨廷丁蛋白。根据这个观点,由亨廷丁基因突变形成的多谷氨酸盐过长的链改变了突变蛋白的形状,使其能够黏附在其他几种蛋白上,尤其是黏附在正常的亨廷丁蛋白上,使其失去功能。这种结合可以解释亨廷顿氏病属于显性遗传的原因。事实上,英国剑桥医学研究会分子生物实验室已故的Max F.Perutzll同事确定了突变亨廷丁的多谷氨酸盐延伸的链折叠成一种称为p薄片的形式,起到了蛋白间粘合剂的作用。柏林MaxDelbruck分子医学中心的Erich E.Wanker、伦敦Guy’s医院的Gillian P.Bates以及马萨诸塞州总医院的Marian DiFiglia他们的同事已经观察到突变亨廷丁蛋白在患有此病的小鼠大脑中以及死于亨廷顿氏病患者的纹状体和皮质神经元中积聚的情况。
然而,这些积聚情况如何导致亨廷顿氏病患者的神经元受到损害,这仍是医学界激烈争论的焦点。一种假说认为,蛋白酶体(用来摧毁已损耗或有害蛋白质的细胞结构)因突变亨廷丁蛋白的形态发生变异而无法将其除掉。导致的结果是,突变的亨廷丁蛋白毫无限制地积聚并杀死细胞。但功能增强假说却不能轻易地解释纹状体以外的大脑区域为何没有受到该病影响的原因。相反,其他假说则认为亨廷丁蛋白积聚并非与亨廷顿氏病的起因有关,它可能代表了一种保护细胞的防御机制,从而避开多谷氨酸盐的有害影响。研究这些积聚作用对了解亨廷顿氏病是非常重要的,找出阻止其形成或将其分离的方法有可能帮助研究人员研究出治疗该病的新药。Wanker和同事最近做了一个实验来识别具有潜能的药物,以阻止突变的亨廷丁蛋白形成积聚。
另一个研究方向是鉴别那些在纹状体内呈显性,并能够与亨廷丁基因相互作用的分子。如果这样的分子陷入积聚蛋白中,就可能产生毒性。研究人员迄今已经鉴别出三组与亨廷丁基因相互作用的蛋白质,但是似乎都与突变亨廷丁基因的毒性无关,也无法解释为什么在亨廷顿氏病中仅有纹状体神经元会死亡。
亨廷顿氏病患者的救星

为了解开这个谜,我们和其他研究人员(包括哥伦比亚大学的Scott Zeitlin)已经开始研究大脑中正常亨廷丁基因的功能。我们首先运用基因工程把额外的正常亨廷丁基因备份或突变的基因植入实验室培养皿中生长的神经元内,并检测试验效果。2000年,我们报道了过量产生正常亨廷丁基因的细胞在缺乏生长介质或在其它易导致其死亡的条件下能够持续生长。我们也发现,正常的亨廷丁基因能够停止分子的阶梯式反应,保持神经元的活性,而这种阶梯式的分子运动通常导致细胞凋亡(apoptosis),也称作程序控制的细胞死亡。由此我们推断出,正常的亨廷丁基因是神经元的救星。
Zeitlin及其同事通过培养所谓的“条件性基因敲除小鼠”(conditional knock out mice,这种小鼠一旦进入成熟期,其亨廷丁基因的两个备份就被切断)而进一步扩大了这些研究发现。当基因失去活性后,小鼠便停止产生亨廷丁蛋白,从而导致严重的大脑损伤。
Zeitlin小组还证实了在小鼠生命中不同阶段中断亨廷丁蛋白的产生可以导致大脑神经元,以细胞凋亡的方式死亡。此外,研究人员指出,缺乏正常亨廷丁蛋白形式的小鼠与表现出突变形式蛋白的小鼠具有非常相似的神经症状。这个观察结果表示,正常亨廷丁蛋白的缺乏和突变亨廷丁蛋白的存在可能是同一问题的两个不同方面。
然而,对小鼠的研究仍无法解释为何纹状体神经元是亨廷顿氏病所选择的目标。为解开这个谜团,我们和其他科研人员转而对脑源性神经营养因子(BDNF)进行研究,这是一种对纹状体神经元的发展和成活非常重要的生长因子。BDNF主要产生于皮层神经元细胞体内,然后沿着大脑中两个区域的神经纤维到达纹状体。据此,我们开始寻找亨廷丁基因和BDNF之间的关系。
有趣的是,我们发现正常的亨廷丁基因能够刺激实验室中培养的神经元产生大量的BDNF。尤其是,亨廷丁基因似乎能“打开”对BDNF编码的基因开关(也称启动子)。这样便将BDNF基因激活,从而促使神经元产生更多的生长因子。相反,突变的亨廷丁基因无法刺激BDNF启动子,结果导致BDNF数量的减少。我们也从加拿大不列颠哥伦比亚大学的Michael R.Hayden和同事进行的基因工程小鼠实验中观察到了亨廷丁基因和BDNF之间的联系。我们发现,过度产生正常亨廷丁基因的小鼠其大脑中的BDNF数量升高,而那些携带突变亨廷丁基因的小鼠却没有这种情况。
以此为据,目前我们可以推测出,亨廷顿氏病是一种非常复杂的功能失调症,这与我们早期的假设不完全相符。亨廷顿氏病基因突变不但产生了能直接杀死大脑细胞的毒性积聚蛋白,而且还使大脑中能够刺激BDNF的正常亨廷丁基因丧失。这两个方面的确有某种联系。1999年,美国波士顿伯利翰妇女医院的Robert M.Friedlander;同事在基因工程小鼠试验中观察到,具有突变形式的亨廷丁基因能够破坏正常形式的亨廷丁基因。如何保护大脑?对亨廷顿氏病的复杂性有了较深的了解之后,我们现在能够设计更好的治疗方案。目前使用的药物仅能缓解部分症状,并有严重的副作用。确实,这些药物的功效往往是顾此失彼,改善了一种症状但却使另外一种恶化。虽然医生通常给亨廷顿氏病患者服用镇静剂来控制他们的“舞蹈动作”,但这些药物同时也降低了大脑神经传递介质多巴胺的作用,使病人的忧郁症状加重。而抗忧郁药物可缓解忧郁症状,但某些类型的药物却能使舞蹈病加重。医生用所谓的安定类药物来治疗病人的幻觉和精神失常,但是使用剂量必须很小,因为这些药物也能诱发痉挛性运动。这几年美国和欧洲的研究人员一直在进行力路唑(riluzole)的实验,力路唑是一种用于治疗神经性失调疾病——肌萎缩性侧索硬化症(ALS,或称Lou Gehrig氏病)的药物,但其特殊的行为模式尚在研究之中。然而,这种药物对各类失调症的疗效仍然具有局限性。
更多治疗亨廷顿氏病的新尝试把目标放在用胎儿组织移植的方法来替换受损的神经元,或者对其注射、输入诸如BDNF一类的神经营养因子。这是第一种新方案,而且已经在早期亨廷顿氏病患者中取得了令人鼓舞的效果,但使用流产胎儿获取所用的组织仍然是道德伦理争论的焦点。例如,法国克雷代伊市(Creteil)卫生与医药研究学院(INSERM)的Marc Peschanski和他的合作者已经给5位亨廷顿氏病患者的纹状体内移植了胎儿神经元,其中3位患者在运动神经和智力功能方面已取得了明显的改善。新的临床试验正在更多患者中间进行。同时,为了解决胎儿细胞源有限的问题,以及围绕这个问题的道德争论,研究人员正试图在实验室中培养神经干细胞以备移植手术之用。但是,干细胞没有胎儿细胞成熟,而且干细胞是否能够完全发育并与患者受损大脑结合也是一个悬而未决的问题。同时,由患者体内其他神经元产生的突变亨廷丁基因是否能破坏由移植胎儿或干细胞产生的正常亨廷丁基因也尚不清楚。
第二种基于动物研究的方法显示出睫状神经营养因子(CNTF)能够防止纹状体细胞死亡,但是把足够量而且具有活性的生长因子传送给大脑却极为困难。诸如BNDF和CNTF类的蛋白质经口服后进入胃内便会被破坏掉;而通过注射或输液的方式,它们有时又无法越过防止循环血液中的物质进入大脑的细胞屏障。据此,瑞士洛桑联邦技术研究院的Patrick Aebischer设计了一种基因治疗方案,他与同事把内含基因修饰细胞并可释放CNTF的半通透性胶囊植入大脑右室。在黑猩猩脑中发现该胶囊能够持续释放CNTF后,Aebischer的研究小组同Peschanski的小组合作,共同探讨在少数患者当中做试验的策略。CNTF在病人体内的试用早于BDNF,因为人们发现CNTF具有保护纹状体细胞的功能,而这要比发现BDNF优点的时间早几年。目前,不同的研究小组正计划在动物身上实验BDNF,并根据实验结果决定是否将其用于亨廷顿氏病患者。
BDNF启动子也为研究治疗亨廷顿氏病的药物提供了一个目标。模仿亨廷丁基因的自然功能并开启BDNF基因的那些药物可能会将突变的亨廷丁蛋白去除。此类药物如同在亨廷丁蛋白的“下游”,因而可能不会影响患者正常的亨廷丁蛋白同其异形蛋白的积聚。事实上,我们预测亨廷顿氏病的药理治疗需要依靠那些既能干扰突变亨廷丁基因的毒性,同时又能恢复正常亨廷丁基因有益作用的药物。也许在解开亨廷顿氏病的谜团之后,我们可以为患者的下一代带来希望。
请 登录 发表评论