癌的遗传学基础
Webster K. Cavenee,Raymond L. White
遗传陷的累积显然可致正常细胞癌变,而癌变细胞则变得日益危险。
受癌症打击的病人似乎感到他们一直在被一相异的力量所侵袭,但恶性肿瘤实际上是由我们自己的组织所引起的。事实上,目前有确切证据表明,癌肿通常起源于一个单一的细胞。该细胞由于一系列遗传改变而发生了显著的变化。
一个健康细胞有很规则的形状,与其周围列整齐的细胞相适应。它对环境的指令做出响应,仅当外部的刺激信号和抑制信号的平衡有利于细胞分裂时,它才产生子细胞。但是复制(或生长)的过程常有遗传突变的危险,即发生可能损害细胞调节途径的随机的变化。假如单一突变发生,那么这个看起来与正常细胞相似、对外部信息反应稍微迟钝一些的新近损害细胞有时可发生无序的细胞分裂。
遗传损害的累积最终可导致子细胞对外界信息全无应答并呈现出恶性肿瘤的征象。尤其是丧失了特有的外形和界限,停止对生长抑制信号的应答,从而获得不受控制地复制的能力。产生的肿块进而可压迫和损害其邻近的健康组织。更为严重的是,它能够侵入器官间的屏障并发生转移,于远处出现新的癌灶。过去20多年所进行的研究已开始鉴定出许多参与从正常到形成癌肿这一进程中的基因。继续进行的研究正进一步证实和发展了早期的学说,即癌肿发展主要是因为细胞的某些类型的基因受到了不可逆转的损害。它也为改善诊断和治疗提供了机会。
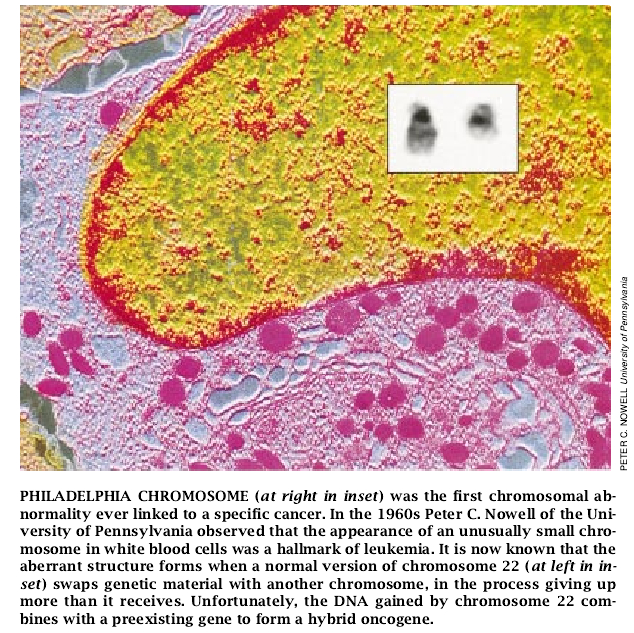
对肿瘤进展的新观点反映了各种研究路线的趋同。而其中最老的研究方法仍然是免不了煞费苦心地用显微镜来观察细胞。例如,到1914年,德国细胞学家Theodor Boveri从恶性细胞有异常染色体的观察中已推测任何导致这类畸变的因素会引起癌肿。

70年代后随着新的染色技术的出现以及设备的改进,更为特异的显微观察使得区别23对染色体的每一对成为可能,这些染色体含有形成人类性状的所有基因。(除了精子和卵子以外,所有的人细胞都携带有两套染色体——一套从母亲遗传而来,另一套从父亲遗传而来。)用染色方法可使每一条染色体显示出其特有的明、暗带,根据条纹的不同可将不同的染色体区分开来。
通过比较正常细胞与肿瘤细胞的染了色的染色体,研究者们注意到癌肿的许多不同的遗传异常征象。肿瘤的染色体常常是断裂了的,且某些片断结合到另外的染色体上。各个染色体呈现多倍复制而不是正常的二倍复制。还观察到整个的染色体(有时是其内部的片断)似乎完全消失了的现象。遗憾的是,直到70年代,研究者们通常缺乏为了确定染色体重排是致癌的原因还是其发展的副产品所需要的工具。
两次击中
表明基因起了作用的另一类完全不同的证据来自于对某些家系的观察,这些家系对某些癌症的患病率非常高。当某种疾病以一种可预测的模式“累及”家族时,这通常与遗传缺陷有关。
但某些癌肿显然会发生遗传的发现也引起了若干错综复杂的问题。通过精子或卵子遗传给子代的遗传缺陷应该出现于人体的每一个细胞。那么,为什么具有遗传疾病的人通常仅患一种或几种癌并且仅在分散部位呢?此外,家族性癌的存在必然意味着更为常见的散发性疾病(非家族性癌)也具有遗传基础吗?或者散发性癌是否完全是由与遗传无关的过程引起的呢?
1971年,由现在在费城Fox Chase癌症中心的Alfred G. Knudson提出的学说似乎对这两个问题提供了答案。但是,他的这一理论经过大约10年的时间才被人们广泛接受。Knudson竭尽全力对成视网膜细胞瘤的病因进行研究,该病是在视网膜上发生的罕见的儿童期恶性肿瘤,一般发生于6岁前。他发现本病有时发生于双眼。但单眼受累最为常见。此外,双眼受累的儿童常常有患成视网膜细胞瘤的近亲。
通过比较每一型发生年龄的统计学分析,显示出双侧型成视网膜细胞瘤诊断出的年龄通常比单侧型的早。年龄分布曲线也揭示,成视网膜细胞瘤是由在不同时期出现的两种细胞缺陷引起的。双侧型的第一个缺陷可能是被遗传的,从受精的时刻起就出现了所有的体细胞。单侧型初期缺陷可能是发育时或更晚些时候出现的,或许仅在视网膜细胞上。然而,这两种情况中,只有在视网膜细胞有了一次突变的情况下再发生第二次独立的突变才能形成肿瘤。Knudson的这个所谓“二次击中”学说表明不仅是对成视网膜细胞瘤,而且实质上对所有癌均是正确的,尽管常需二次以上的击中。
需二次击中——现在已知它们构成了对基因的损害——解释了为什么有癌倾向家族的病人并非全身均患肿瘤:仅仅一个遗传缺陷遗传给后代只是使其有可能患癌症,但不直接致癌;还需要第二次突变。Knudson关于散发病例和家族病例的病因可涉及同一类生化异常的直觉也被证实。但是,甚至早在70年代。他的学说也为下列看法提供了依据:旨在发现罕见的家族性癌中的遗传畸变和其它细胞畸变的研究也能掲示导致散发性恶性肿瘤的过程。
癌基因发挥主要作用
当许多研究人员集中对家族性恶性肿瘤的遗传学进行研究时,确信基因是癌的原因的另一些研究人员正采取不同的方法寻找与癌有关的基因。多年前就已经知道,病毒能导致动物的肿瘤。这种联系于是激励人们为鉴定由病毒携带的致癌基因及寻找受影响的宿主基因而进行大量研究。这些研究结果惊人地揭示,与恶性肿瘤有关的基因常常是病毒在侵染人们的过程中获得的人基因的变异形式。其它时间病毒激活通常是静止的宿主基因。
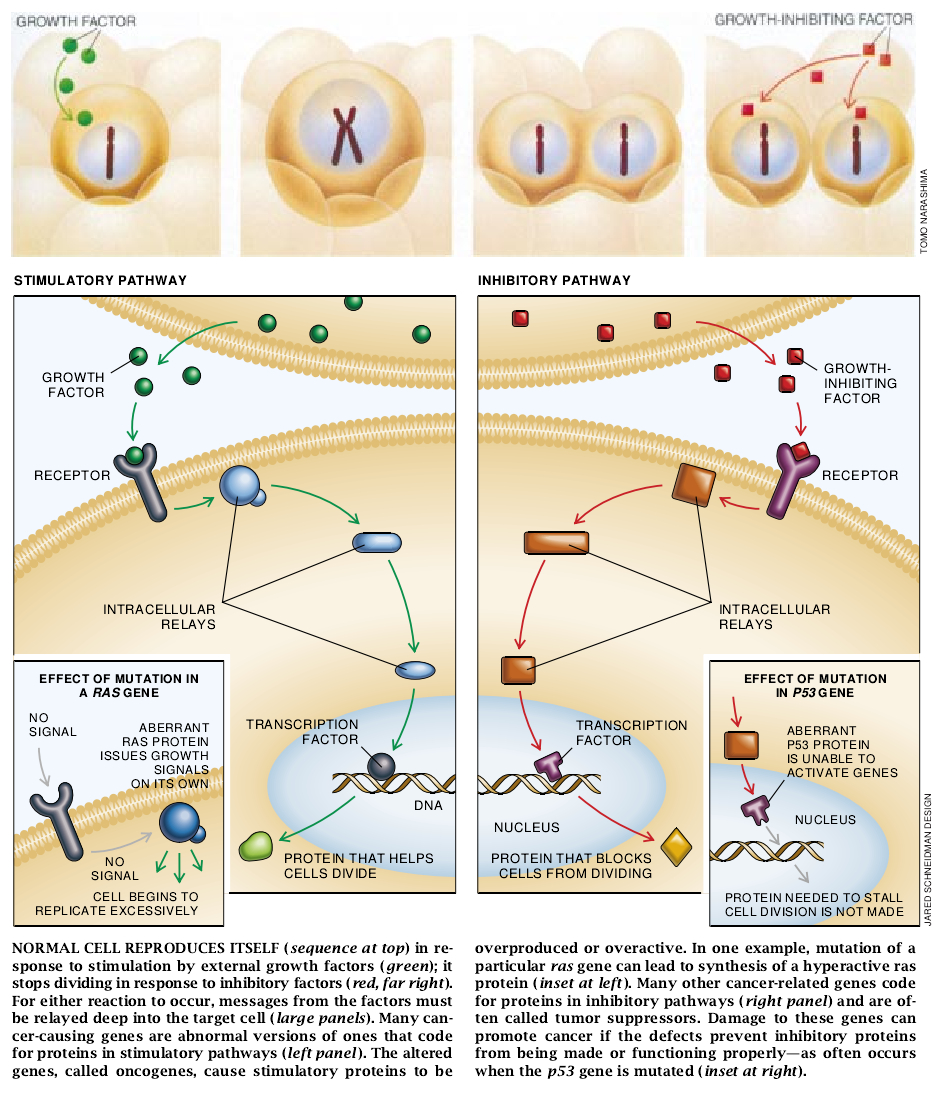
这些被病毒夺取和激活的基因——现在称为原癌基因——的正常形式携带了规定促使细胞复制的蛋白质成分的密码。这些生长促进基因以多种形式起作用。某些基因决定从细胞表面伸出的受体的氨基酸序列并结合到称为生长因子的分子上。当与这种因子结合时,受体发出最终引起复制的细胞内信号。另外—些基因编码细胞内蛋白质,并指导细胞内生长信号的传播。还有一些基因则编码控制细胞分裂的蛋白质。
病毒基因与人的某些基因有相同结构这一发现引起人们注意到这样一种可能性,即人类肿瘤——包括那些不是由病毒引起的大多数肿瘤——可能发生于使原癌基因转化成了致癌形态的突变。研究表明,这些原癌基因中仅一个拷贝(等位基因)的改变就足以转化某些生长在培养物中的细胞类型(也就是使其变为癌性的)。此发现与上述看法是一致的。这样的显性突变引起细胞过量表达正常蛋白或产生一些变异的激活蛋白。在任何一种情况下,出现的结果都是即使并未从外界传入信号时也会导致细胞内刺激性信号的增加。
随后的研究证实了癌基因的作用——同时也使事情复杂化了。值得注意的是,1982年和1983年,法国和美国的研究人员进行了一些类似于最初的细胞培养实验的研究。但有一个明显的差别。因为正常细胞不会在培养基中无限制地生长,这些较早期研究依赖于在培养基中具有长时间增殖能力的啮齿动物细胞。为消除这一可能产生混淆的影响,尼斯大学的Francois Cuzin,麻省理工学院的Robert A. Weinberg和当时在纽约州科尔德斯普林港实验室的H. Earl Ruley探讨了是否单个癌基因也能引起正常的啮齿动物细胞的转化。
他们发现,必须在至少二种原癌基因中存在突变,而且只有某些突变的结合会导致恶性肿瘤。这些结果揭示,个别癌基因虽然可能很有效力,但不能由它们本身引起肿瘤。然后研究人员开始着手研究是否人肿瘤携带有在培养物中能转化细胞的那些类致肿瘤改变及其组合。
一时间癌基因似乎可以解释大多数癌肿病例。由于在人类肿瘤中发现了一打以上的癌基因,从而使这种观点得到强有力的支持。然而,其结果最终令人失望:仅仅20%的人类肿瘤证实是有单个预期的改变,而且没有一个具有在培养细胞中发现的那种成对配合的改变。当时,使人可能患家族性癌症的遗传突变看起来也不是癌基因。这些结果强烈暗示整个过程尚未阐明。
肿瘤抑制基因的作用
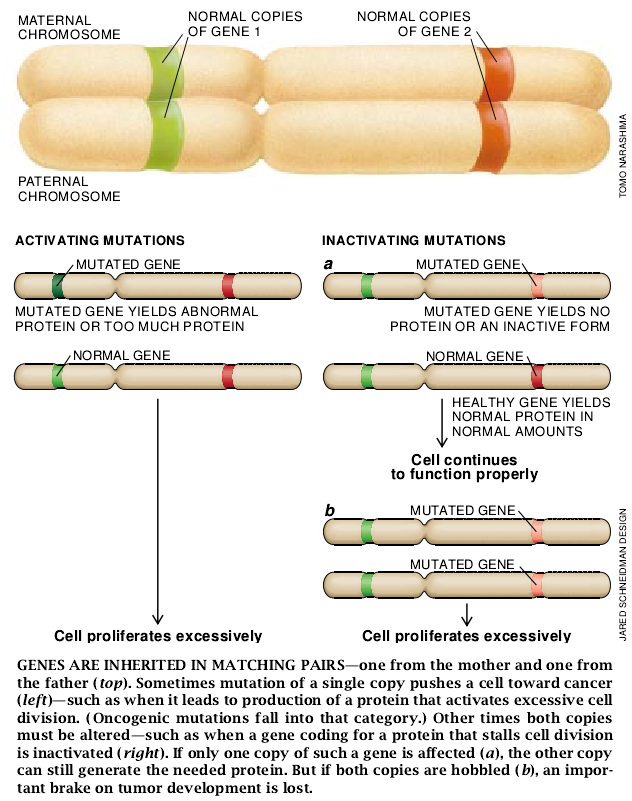
甚至在这些线索吸引更多注意之前,我们两人就开始怀疑另外一类基因的损害对癌肿发生可能起了作用。这类基因后来被称为肿瘤抑制基因,因为其中多数编码抑制细胞增殖的蛋白质。与激活癌基因的突变相比较,我们认为这些基因的突变是隐性的:仅当两个等位基因都被损害或丢失时,它们才会影响细胞功能。在检验这种观念时,我们依赖为追踪家系中的基因和染色体遗传这一更为广泛的目的而研究出来的新技术。
早在80年代初期,在犹他大学进行合作研究时。我们就认识到我们的技术——涉及追踪组织中的遗传标记(能鉴定出的DNA片断)——能用于确定由正常细胞携带的染色体片断是否在肿瘤中丧失了。例如,假如肿瘤中一染色体的某一特定区域缺失,我们就能观察到一个已知同该区域一起迁移的标志也不见了,从而发现这一块失。
我们的实验按照明尼苏达大学的Jorge J. Yunis和耶鲁大学的Uta Franeke较早期研究确定了重点,此项研究表明,第13号染色体上的一个基因可能与成视网膜细胞瘤有关。利用我们的DNA标记技术,我们得以在1983年揭示在散发性和遗传性成视网膜细胞癌的细胞中第13号染色体的一些大片断丢失了。这一新的证据强烈支持下述看法:Knudson所假设的“二次击中”包括等位基因的物理或功能的丧失,继之以正常拷贝的损失或受损。第13号染色体上缺失的DNA,现在称为RB(成视网膜细胞瘤)基因,于1986年由Weinberg实验室的Stephen H. Friend分离到。
其后研究已显示RB基因的隐性丧失同样发生在其它癌肿。更重要的是,DNA的失活或丧失现在已被证明是迄今为止所检査的每一例实体癌的发生中之主要特征。乳腺癌、前列腺癌、肺癌、膀胱癌、胰腺癌和其它许多癌都以多个肿瘤抑制基因的破坏或消失为标志。
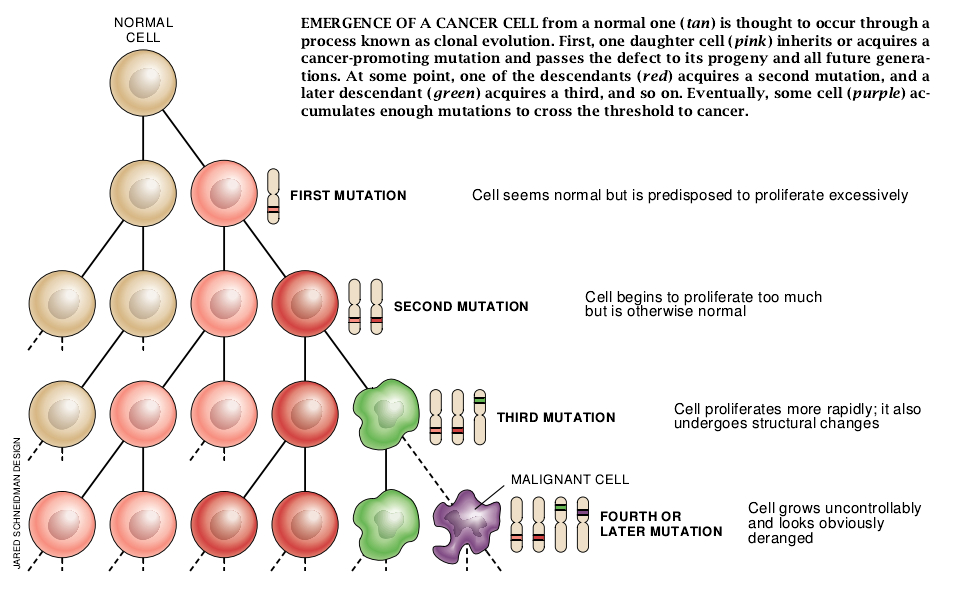
随后到80年代后期,有明显的证据表明原癌基因和肿瘤抑制基因二者的突变可能参与癌肿的发生。推测某些类型的癌起源于这些基因突变的结合似乎是合理的。但是突变是在同一细胞中累积起来的,还是某些突变影响一个细胞,而其它的突变影响其它的细胞呢?50年代由伦敦Chester Beatty研究所的Leslie Foulds提出的70年代由宾夕法尼亚大学的Peter C. Nowell加以发展的肿瘤进展模型揭示,假如两类突变都与肿瘤的发生有关,它们会聚集在一个细胞以及其直系后代中。
按照这一方案,癌肿被认为是通过称为克隆进化的过程而出现并变得更加危险。首先,单一细胞经历了一次突变。此突变在引起正常细胞停止复制的情况下仍能使细胞分裂。因为不适当地分裂的细胞复制它们的DNA并且对其子代给出完全相同的一套复制信号。所以下一代细胞发生相同的改变并呈现同样的不适当生长。其后,这些细胞或其子代之一经历了进一步增强其逃避正常调控的能力的突变。或许使其能穿透周围组织并进入血流。这一突变也传递给子细胞。这种过程的重复能使一个细胞积累起它为了转移并在其它器官中建立癌灶所需要的突变。
假如这一理论是正确的,这将意味着绝大多数肿瘤细胞会具有相同缺陷。既然如此,对抗这些缺陷中的一种或多种的疗法对所有或绝大多数癌细胞会是有效的,这是为根除任何恶性肿瘤所必需的基本的特征之一。由于这一原因和其它原因,我们打算研究看是否能找出肿瘤克隆进化的证据。我们中的一位(White)首先集中对结肠癌进行研究,而另一位(Cavanee)对脑肿瘤进行探讨。作为这一工作的一部分,我们必须鉴定涉及这些癌肿的许多基因。
结肠癌的遗传学
White着手于对结肠癌进行研究,部分原因是由于结肠癌通常是从一很明确的前体(即结场息肉)出现的,假如癌以克隆形式发展,在肿瘤发展早期阶段出现的突变预期会存在于晚期阶段,每一连续阶段将会有另外的突变为其特征。为了用实验检验这一预期设想,必须从连续的各阶段中收集标本并比较其基因。对结肠疾病,标本很容易获得。当一个开始是微观的息肉逐渐增大而变得更不规则时,胃肠学家就很容易发现它并为治疗目的的而切除它,这样实验工作者也就容易得到息肉了。
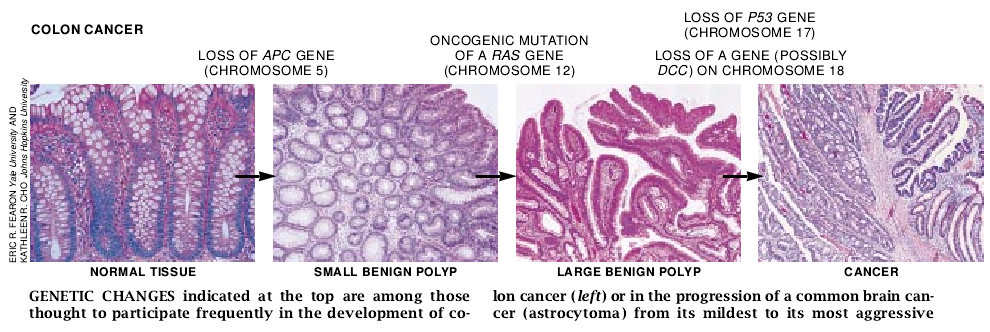
结肠癌适合于我们的目的的另一原因是,对称为家族性腺瘤样息肉病这一罕见疾病有遗传倾向的家庭已经被发现而且适合于研究。在受累的个体中,结肠上有成百上千个息肉构成地毯样改变,其中一个或多个到中年就可能癌变。很明显,某个基因的遗传缺陷——称APC(表示“腺瘤样结扬息肉病”)——对息肉形成是必须的,因而对这些病人发生结肠癌也是必须的。也有可能APC基因出现缺陷是最单期阶段之一(如果不是第一阶段的话),它导致许多散发结场痛病例。假如这一基因能被分离出来,这些设想就能被检验,因此研究人员将会得到为评价结肠癌是否以克隆形式发展而需要的基因中的至少一种。
1987年,犹他大学的White实验室的Mark Leppert在伦敦帝国癌症研究基金会的Walter F. Bodmer及他的同事通过运用前面介绍的标志技术分别揭示,APC基因定位于第5号染色体长臂中部的附近。由White实验室合作进行的深入细致的工作,以及由另外两位研究人员——东京癌症研究所的Yusuke Nakamura和约翰霍普金斯大学的Bert Vogelstein——所进行的研究最后揭示了该基因精确的位置。这些研究还鉴定了出现于散发和家庭结肠癌的几种遗传的APC突变。这样该研究解释了结肠病发展的初期过程。此外它还使遗传和散发肿瘤中常有相同基因发生突变的这一推测得到进一步的证实。
这些研究小组还发现APC基因上所有与癌相关的突变导致不完全蛋白产生。很明显,假如细胞保留有一个正常的APC等位基因,并制造一定数量的完全APC蛋白,细胞就能相对正常地起作用。但假如两个等位基因都受损,对复制的必不可少的抑制作用就消失了。APC基因的精确功能尚未明了,但既然它已被掌握,它的正常功能及其在癌症中的作用将很快会得到确定。
多重性缺陷
APC基因灭活后紧随的步骤仍然是不淸楚的。然而,在许多病例中,某一原癌基因的单一等位基因后期突变似乎促进息肉发生恶变。如Manuel Perucho在科尔德斯普林港实验室观察到的。这一基因是几种ras基因之一。在这一基因的指令下制造由的正常蛋白位于细胞膜下,并从生长因子受体传递刺激信息到细胞质的其它分子上。其突变形式不等待自外界来的信息,而是发出自己的生长信号。
Vogelstein和他的研究组已证明,较大息肉和结肠癌常常仅携带另外两个肿瘤抑制基因的突变拷贝。一个是p53,位于第17号染色体,现在认为许多不同的癌都涉及到这一基因。这一基因的正常蛋白产物通过各种生化途径发挥作用(包括使一个细胞修复损害了的DNA的过程)。另一个位于第18号染色体,它可能为DCC基因。DCC编码存在于细胞表面并帮助细胞互相粘附的蛋白。
APC基因的遗传改变出现得早且持续下去,而其它的基因改变仅在晚期出现,这一发现与克隆进化理论相符合。但是这个结论起初是统计性的,是基于检查从许多不同病人切除的组织而得来的。这种方法不能决定性地证实出现于一代细胞的突变传递到相同细胞的后代。然而,另外一种方法提供了更令人信服的结果。
有时于癌肿边缘能鉴定出产生癌肿的息肉。通过比较息肉和邻近癌肿的DNA,Vogelstein证明息肉山现的每一次突变也出现于相应的癌肿,正如肿瘤是由克隆进化形成的情况下所预期的那样,而且癌肿总是包含息肉中未发现的突变,也正如在另外的突变导致癌肿侵袭加强的情况下所预期的那样。例如,某些息肉具有ras突变而没有p53缺陷,但自息肉发展而来的癌肿有这两种突变。迄今为止尚无有力证据表明为了使息肉转变为癌,ras、p53和DCC基因的突变必须以某一特定次序发生,虽然ras突变首先发生的情况似乎相当常见。
脑肿瘤揭开奥秘
尽管获得了这些令人鼓舞的发现,结肠癌的研究有一个很大的分析局限性。为真正揭示某一细胞克隆的基因正经历进行性的改变,需不时地检查同一个肿瘤。在结肠癌病例,癌肿几乎总是在诊断作出的早期阶段就已切除,这样的治疗其临床效果好,但妨碍了以后的观察。出于这一考虑,Cavenee寻找一种其肿瘤切除后常在同一部位再发的更具侵袭性的癌肿。1978年,当他在麦克吉尔大学路德维希癌症研究所时,他与他的合作者选定称为星形细胞瘤的癌肿——源于脑部最常见肿瘤——进行研究。
脑部癌肿的定义与其它组织癌肿相比稍有差异。在这一器官,细胞不一定要侵袭结缔组织或转移就能使人致命;在一个对生活起关键作用的部位的增殖常常就足以使病人致命。因此,在脑部的绝大多数肿块都称为癌。Cavenee研究小组检查了星形细胞瘤从低度恶性至中度恶性阶段的进展情况,按肿瘤大小、形状及组成细胞结构来确定恶性程度。
1987年,当研究人员开始这一工作时,他们尚无结肠癌形成的遗传变化的蓝图。因而他们是按为进一步研究个别病人作好准备的目的而进行研究的。他们从许多不同的病人获得肿瘤,按照进展疾病的阶段或程度分组,比较在每一个阶段发现的遗传紊乱。
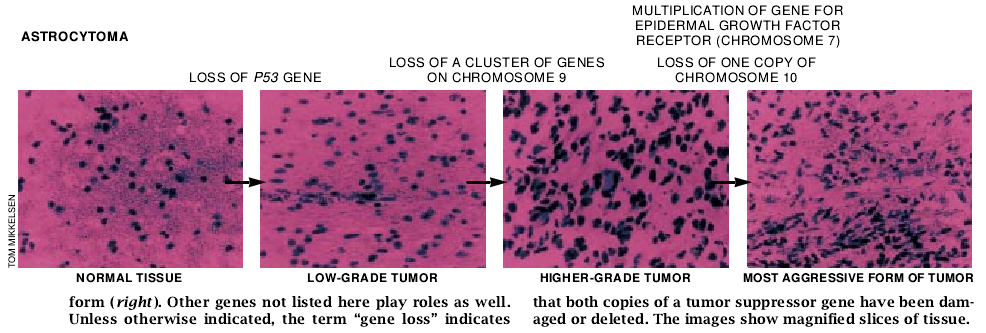
随后的4年多时间中,他们取得了良好的进展。例如,他们发现各种不同程度的肿瘤的第17号染色体上他们仍未鉴定出的基因有失活改变。然而,最早阶段肿瘤呈现此突变的比率与所有其它阶段是相等的;这一规律是这个突变出现于早期并被保留下来的一个征兆。假如一个突变通常发生在疾病晚期阶段,在晚期阶段的频率就会增加。到了80年代末期,Vogelstein的实验室确立了第17号染色体上p53基因的突变是人类癌症中最常见的改变。其后Cavenee的组织标本分析证实了他的一个猜想:第17号染色体的突变实际上是p53基因的一个缺陷。
注意到在其它脑肿瘤中第9号染色体的一特定区域缺失了之后,Cavenee研究组的C. David James与斯德哥尔摩的路德维希研究所的V. Peter Collins也合作检査了这些染色体。中-晚期阶段(但并非早期阶段)的星形细胞瘤常显示这一染色体两个拷贝有缺失。因而,这种染色体缺失可能促使肿瘤从较早阶段向中期发展。丧失的部位含有一簇编码称为干扰索的蛋白质的基因。这种蛋白质能引起免疫系统对疾病细胞的注意,所以其基因的缺失可能有助于癌细胞逃避免疫攻击。失去的区域可能还包含二个新近发现的称为多重肿瘤抑制1和2基因,其蛋白产物与调控细胞分裂有关。这些基因中任何一种的消失都可能促进各类癌肿的发展。
组织研究也扩展了由Genentech公司的Axel Ullrich和伦敦路德维希研究所的Michael D. Waterfield和以色列魏茨曼科学研究所的Joseph Schlessinger提出的报告,即星形细胞瘤染色体常携带特异决定表皮生长因子受体的基因的一个以上的拷贝。因为每一拷贝能用于制造蛋白质,细胞在它们表面将携带额外的受体。而过多的受体能引起细胞对生长因子的存在做出过度反应。这一改变似乎参与了促进肿瘤从中期向晚期进展。
最后,Cavenee组发现,实际上所有终末阶段的肿瘤都失去了第10号染色体一个拷贝,而早期阶段罕有丧失。这一模式表明这种缺失可以使疾病进展至最严重阶段。不过,令人遗憾的是,我们仍然还不知道缺失染色体上的哪一个或哪几个基因对疾病进展是最重要的。
到1991年,这些结果揭示脑肿瘤的形成至少包含有p53基因的失活,第9号染色体上一个基因丢失,表皮生长因子受体基因致瘤扩增,以及(在很晚期阶段)第10号染色体上至少丢失了一个拷贝。但是,证明星形细胞瘤是由这些或可能是另外的细胞缺陷所引起的更有力的证据,尚需检查单个个体癌肿随时间的遗传改变情况。
大约在这时,Tom Mikkelsen加入Cavenee的实验室并承担比较原发星形细胞瘤与同一部位后来再发肿瘤的遗传物质的研究。这一研究于早期是不可能的,不仅因为涉及的基因不明而且也因为难以获得配对的肿瘤。开始在一个医疗机构就医的病人当癌肿复发时可能去其它地方就医。假如内科医师认为手术不能延长生命,对复发肿瘤也不主张切除。幸运的是,有两位杰出的临床医师——加利福尼亚大学旧金山分校的Mark L. Rosenblum和德国弗莱贝格阿尔伯特路德维希大学的Karl Schwech heimer保存有一些冰冻组织,其中有若干配对的肿瘤组。
Cavenee感到满足和高兴的是,对这些组织的遗传学分析——与Vogelstein的David Sidransky合作完成——符合克隆进化理论的预言。原发肿瘤比复发肿瘤突变机会较小。这些改变包括了已在过去低度肿瘤分析中鉴定的一次或更多次遗传突变(例如第17号染色体损伤)。最重要的是,在离度肿瘤中不仅发现了低度肿瘤中的所有遗传损伤,还发现了更多的遗传缺陷(在早期研究中鉴定的那些类型的缺陷)。鉴于并非显而易见的一些原因,星形细胞瘤的改变似乎比结肠癌的改变遵循更确定的遗传突变次序。
下一项工作
单一谱系细胞中正常调节细胞增殖的基因的缺陷的累积会导致癌肿并使其变得更危险,我们已经描述的结果对此见解提供了强烈支持。除此之外,其它类型的基因——许多尚未鉴定出来——改变也能促使肿瘤生长,侵袭局部组织并发生远处转移。遗传改变了的细胞的周围环境中激素和其它因子几乎肯定会增强细胞增殖的失控。
问题仍然存在。为什么不同细胞的癌变需要各种不同类型的基因突变的组合呢?5种或更多的突变怎么可能在细胞内累积?毕竟,一个细胞若已经拥有了一个与癌相关的基因突变,再于该基因上发生另外一次突变的可能性很小。
新近发现的另一类型遗传性结肠肿瘤(遗传性非息肉病结肠癌)的遗传畸变对上述问题可给出部分答案。受损基因编码的蛋白能区分和修复当复制细胞DNA被复制时所发生的复制错误。假如这些修复基因本身受损,传递给子代细胞突变的数量将显著增加。随后子代细胞就可能将携带有更多突变的DNA传递给后代。修复基因的缺陷于是可起到促使晚期肿瘤具高度侵袭性的作用,甚至可解释某些肿瘤可迅速发展并致死的原因。
某些基因的突变假如发挥多重作用,也同样加速肿瘤进展。在这一点上,p53基因损害很明显地起到了比促进细胞增殖更多的作用。某些突变似乎降低细胞本身限制血管形成的能力。当额外的血管在肿瘤中生长时,它有助于滋养肿块并对恶性细胞扩散至远处起导管作用。类似地,变异基因产生的变异蛋白有助于肿瘤细胞抵抗放疗的破坏作用。
随着研究人员对导致和加速特殊类型癌肿的遗传改变的特异组合获得日益明确的认识,他们的研究结果应该指明有益于诊治病人的方法。当突变以相当确定的顺序发生时,对病人肿瘤中的突变的鉴定有助于阐明疾病的阶段并针对病人的特殊需要作治疗。此外,对原发肿痏中突变基因的认识可能有助于更早地检测某些癌肿的复发,也就是找出在尚未形成可检测的肿块的组织中已出现的突变,从而检测出癌肿。
对癌肿遗传学基础的深入了解预期可引入新药物,这些药物有对抗特定突变的作用,因而可减慢肿瘤发展或消灭肿瘤。一些证据揭示不一定需要纠正每一种突变的作用;只需要对一种或两种基因这样做就足以有效的消灭变异细胞。
正常细胞癌变并不断变得更危险的过程无疑比迄今已了解的更为复杂。但是,对特异癌肿发生的遗传改变基础进行持续不断的研究似乎是揭开这些复杂事物的奥秘并获得新的治疗线索的合理途径。
【刘长安/译 李文/校】
请 登录 发表评论