加速评估有重要价值的药物
David A. Kessler,Karyn L. Feiden
传统的临床试验方法可能延误救命治疗方法的利用。目前食品药物管理局的管理人员正在试图使速度与误差的风险相平衡。
1994年春季,一群艾滋病(AIDS)活动分子聚集在马萨诸塞州罗克维尔市食品药物管理局总部时Parklawn大楼的三楼,他们对食品药物管理局的高级官员提出一项特别的请愿:不要过快地批准治疗由人免疫缺损病毒(HIV)引发的疾病的药物。没有任何熟悉前十年所发生的各类事的人能预测这一转变。只是在近年才开始有一些激烈的活动分子包围Parklawn大楼,要求使用几乎才结束试管试验的药物。面对即将逼近的死亡,患有艾滋病的人们有权大声疾呼去迎接治疗风险。面对惨淡的治疗情景,实验性的药物是一线希望,而许多艾滋病患者都不愿接受对使用药物的任何限制。
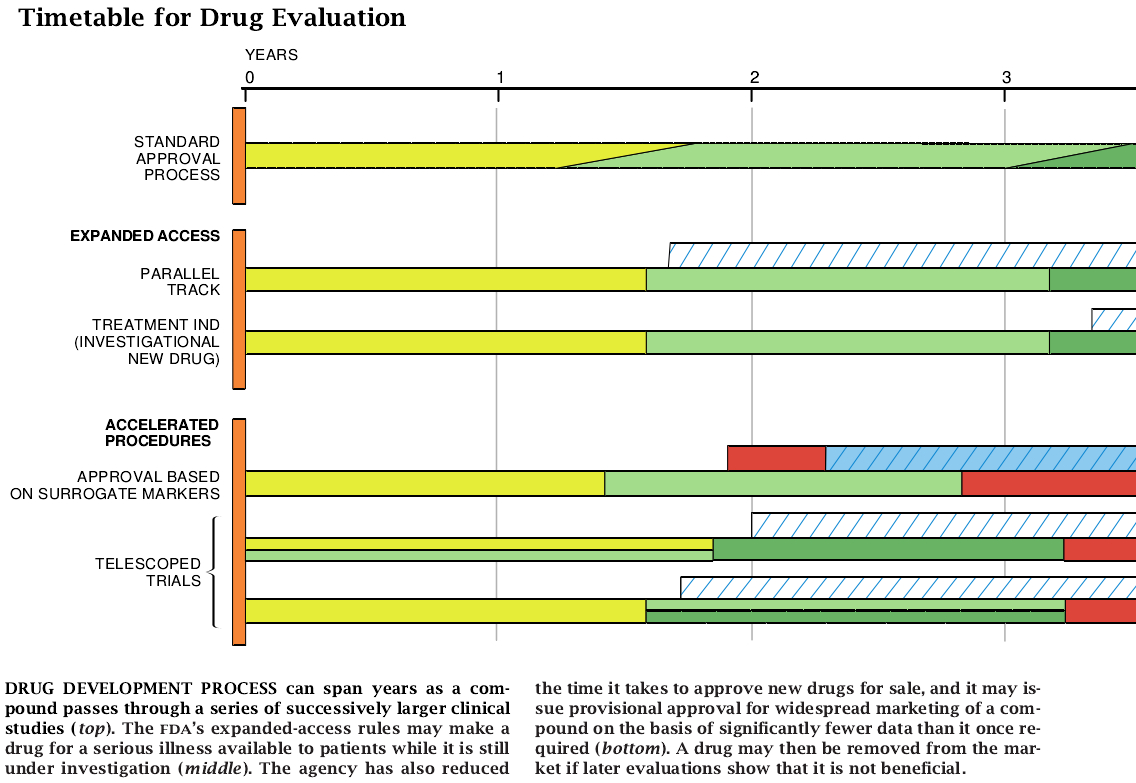
有希望的药物一般得花费几年时间去试验:从产品负责人提交申请产品鉴定,直到药物广泛使用所需的时间额外要花去近两年。鉴于对开发和评估新的药物所需时间长度的担忧,食品药物管理局在将新药物投放商售的方式方面作了一些急剧的改变。廿世纪八十年代末期,食品药物管理局提出了一项法规,扩大对未鉴定的但有希望的治疗药物之采用权。1992年食品药物管理局采用了一则规章,在收集安全性和有效性的全部资料之前即应允许批准药物。这些优先权只适用于对严重病症和威胁生命的疾病所使用的药物,借以平衡危急病人对由食品药物管理局负责确定是否使用这些药物的紧急需要。
这些政策在加速新药物的利用中是否已大大地取得了成功呢?去年春天聚集于食品药物管理局的艾滋病活动分子们耽心对这个问题的回答已开始位于次要地位。他们关心的是病员和病员的医生不知道如何才能最适当地使用现存的抗病毒性的艾滋病的药物。他们希望讨论可了解更多的关于实验性治疗药物价值的方法和立即掌握——当每种药物应该投放时,药物用于何种病人以及用多少剂量。缺乏这些资料,新的药物也许就不会得到应用。
尽管这些活动分子的告诫,反映的只是艾滋病病员群体内的一种状况。但不容置疑的是,要使一种药物尽快得到广泛使用,则意味着它开始是在没有完全了解药物性能的情况下就使用。食品药物管理局在陈述了这些意见之后,坚持把治疗药物尽快地投放给病员手上,但它评估新产品仍按当时所规定的合法标准进行。

正常的批准阈限
根据法律,食品药物管理局担保在美国所使用的治疗药物是安全而有效的。在所提出的使用条件下,治疗药物已知的和潜在的好处必须超过它的风险。绝大多数新的治疗药物要经过一系列的临床试验才能出售。在每个阶段,研究人员逐步扩充较大的病员群体,并积累更多的有关安全性和有效性方面的数据。一旦研制药物的公司认为它已有充分的信息,它就向食品药物管理局提交这一新产品的申请;食品药物管理局每年大约要接受100种新药的申请。
食品药物管理局通常要求在人类中至少有两组对照(比较)试验,以作为一种药物有效的证据。虽然可能变得很明显的是一种药物也许相对较早就在使用,但一般要以较长的时间来搜集其它一些重要信息,如对不同剂量的反应、不常发生但有重要的负效应之频率,以及对特殊类型的病人(如肾功能衰竭或其它疾病)需要改变剂量。某些罕见的副作用只有在产品(药物)被广泛使用之后才可能逐渐变得明显起来。

鉴于这些原因,药品公司通常以三个阶段研究出一个产品。第一阶段试验,以少数健康的受试者来检测药物,以确定有多强的耐药能力以及药物是如何被代谢的。他们也寻找短期的效应,如血压的变化(在这一阶段,效能的证据只是一种次要的关系)。在第二阶段中,研究人员用病员进行研究。使用的药物意在治疗,以鉴定其有效性和出现比较常见药害反应的比率。依照当时的情况,治疗小组可以与用接受安慰剂(一种无医疗作用的中性物质)或用已知有效的药物的组群进行比较。一般,当医疗已知是用于改善生存或阻止不可逆转的危症时,不能使用安慰剂。
以早期试验结果为指导所设计的第三阶段试验,可能包括数千病人,并意在提供为批准所需的其它的决定性的资料。这些对照试验评估对不同剂量的反应、长期使用的安全性、药物的相互作用以及性别引起的应答差异。他们还把所需的其它数据汇总起来给药物以适当的标注,并规定其使用的条件。理论上,第三阶段的试验还将研究药物对由年龄、人种、并发症或其它因子而划分的人群作试验所产生的各种差异。许多试验是双盲的——即病人和研究人员都不知道谁接受何种疗法——以保障防止出偏差和让病员随机地接受不同的治疗。可是,长期安全数据则可能来自非盲的、无对照的试验。
上述试验可由药品公司或与医院、政府实验室或各大学有关的研究人员来进行;根据药物所进行的试验,负责人员可以直接登广告征集病员或等候医生作治疗安排。试验经费的来源同样是有变化的:多数情况下是由制药厂承担试验费用;国立卫生研究所也积极支持这类试验,病员或者他们的投保机构可以提供与试验有关的其它医疗护理的费用。在有些情况下,获得药物或研究支持也许是决定试验在哪里进行和怎样进行的最关键的因子。
对最多能提供一些边缘临床优点或治疗比较无害疾病的产品来说(如温和的止痛药)。任何要求都很少脱离一般的程序。然而,在某些紧急的情况下,食品药物管理局在批准或承认有希望的治疗药物之前。根据比较有限的资料,可以允许使用这种治疗药物。食品药物管理局要把许多因素考虑进行,其中包括病情的严重性,常规的治疗措施,对新的治疗药物的有效的信息。适当的试验设计以确保得到更多的结论性的答案,以及增加使用新药的风险可能使得更难确定药物是否有效。药品公司在得到最终批准之前,必须继续更多的有对照的试验。
速度和可靠性之间必然有一种折衷方案。根据初步的或不安全的资料进行判断就能增加出现重要负作用的机会,从而降低药物的使用价值或建议剂量中的误差将导致不适当的使用。而且,一旦药物已被广泛使用,确定最适剂量使用时期或药物间相互作用的控制研究。就更难执行。负责人员已不大有积极性去进行进一步的研究,而能够得到治疗的病人在没有签约的情况下对试验也可能不愿意参加。这些风险使之不可避免地要把研究继续进行下去,直到试验的药物在安全性和有效性方面与其它治疗药物达到相同的标准。食品药物管理局要负责确保试验主持人要完成这些试验。
尽早使用于治疗上
多年以来,食品药物管理局已允许癌症病人接受一些有希望的试验治疗药物。从1987年起,治疗用试验性新药(IND)章程允许对其它一些严重疾病有希望的药物,根据比完成上市批准所需要少得多的资料即可广泛分配。通常,临床试验过程正接近完成时,主持人员必须继续勤奋地进行上市的批准工作。在1992年颁发的最新“并轨”章程已经让未经临床试验考核和没有治疗选择余地的患有人免疫缺陷病毒病的病员,只通过私人医生及早的试验就可接受试验性治疗药物。
扩大使用权使那些患有难以医治的、威胁生命的疾病的病人能够得到治疗。不过,它也能妨碍对照试验的注册工作,并因此而妨碍不断的收集决定性的数据。
使用ganciclovir(—种杀癌药物)防止巨细胞病毒(CMV)视网膜炎(一种与艾滋病有关的威胁视力的机遇性感染),提供了一种能够纠正错误的一个适宜的榜样。这种未经审批的ganciclovir的广泛而不受控制的分销使病人和科学团体都确信这种治疗有效;研究人员由此而可以不进行使病人接受安慰剂风险的对照试验。经过多次辩论后,该项目负责人Syntex根据所采用的病历对照试验(即将使用ganciclovir的病人与使用ganciclovir前就已患CMV视网膜炎的病人之病程比较)得到了批准。回顾一下过去,看来就很明白,在药物广泛分销之前进行的小的随机试验,也许就会收集到较为严遙的有效性数据,并让药物提早几年得到批准。
应用Exosurf以防止或治疗导致早产婴儿死亡的一种主要透明体膜病,得到了应该釆用何种扩大使用权机制的更有信心的样板。Burroughs Wellcome与食品药物管理局交流了安慰剂对照试验的临时资料后,食品药物管理局评论员断定,上市的批准显然是根据秘密评定肯定的结果而判别的,接着食品药物管理局同意Burroughs Wellcome的停止试验的决定,在公司写上市申请报告时即允许Exosurf分销。
从食品药物管理局的角度来看,参加临时数据的分析是有潜在风险的——如果决定性的评论导致了拒绝,早早地终止Exosurf的研究就会形成失去得到更完整信息的机会。而这种药物看来有足够的机会取得重要的价值。幸运的是,在制药公司提交中请书后导致批准的全部分析恰好要五个月,这段时间对药物上市的准备足够了。
能够在扩大使用的基础上提供—种治疗药物的证据标准,在产品得到最终批准时变得更严谨。遵照并轨分销的药物必须是“有希望的”。临近审批决定时取名的治疗用试验新药(INDs)必然有证据表明它们“可能是有效的”。如果食品药品物管理局在试验完成之前实际上已批准药物上市,那么资料必须证明其益处的“合理的”可能性。在各种情况下,要不断聚集信息。无论谁使用药物都可以作为通过试验过程的窗口。最终必须满足最可靠的法定标准,在其研究中提供出实质性的证据。
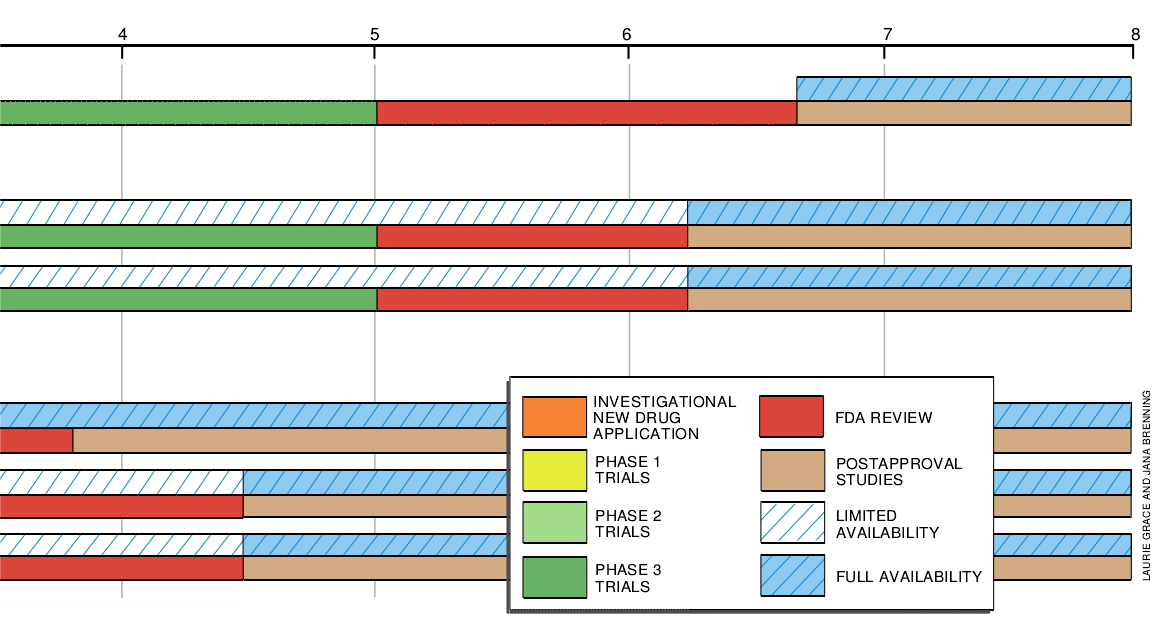
加速审批
研究人员应该测定哪些指标来确定药物的有效性呢?以威胁生命的疾病为例,死亡率是药物效力的最令人信服的指标;但当该病历经数年之久才死亡时,等待对死亡率的可辨认的影响可能导致无法接受的耽误。即使药物不能治疗病人,研究人员有时代之以检查最终论点,他们确信实验室或临床的测定值与实际的效益呈正相关。例如,降低血压或胆固醇的水平并未使病员感到病情轻松一些,但可以减少心脏病突发的危险。
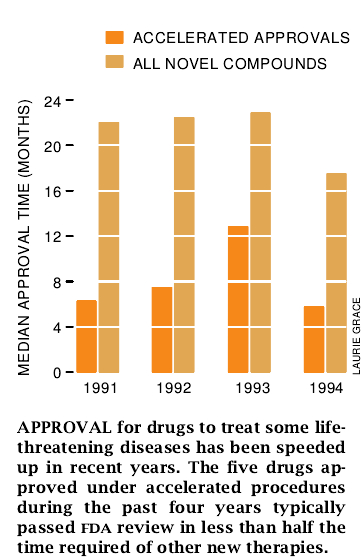
1992年12月,由于依照精确性尚未完全确立的可代替最终评论,而又没有更好的可供选择的疗法时,食品药物管理局定型化了它对用于严重疾病的药物加速审批的程序。在这种情况下,药物开发主持人必须委托进行对照试验以证实审批后的临床效果。通常在审批时此类试验仍在进行。如果这些效果遗失殆尽已成为事实,那么食品药物管理局可以尽快将此药物从市场上清除掉。这项规定既要冒所批准的药物最终证明是无效的适当风险,但也有大大加速对垂危疾病所使用的药物获得上市的好处。
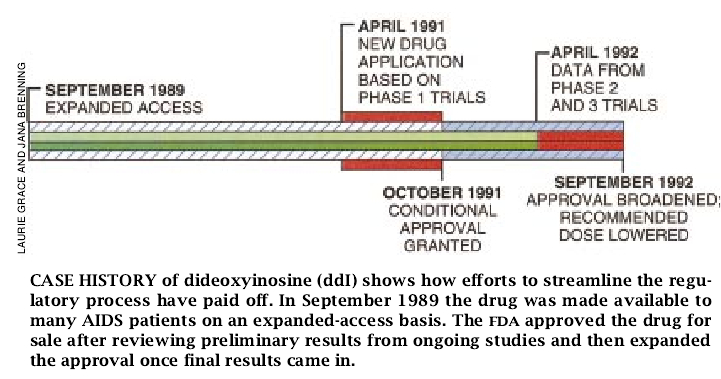
二脱氧肌苷(ddI,是一种抗病毒药物,其作用非常类似于叠氮胸苷即AZT)的评定和批准是这种加速审批章程的范例。1991年4月,ddI药物研究的主持人Bristol Myers Squibb向食品药物管理局提交了申请ddI上市的报告,其依据是得自早期临床试验,包括170名成年人和98名儿童的资料。像大多数早期试验一样,这些试验的目的不在于提供肯定有效的数据。没有对照组以及作为是临床效果的替代方法,研究人员只好测定病人的CD4+淋巴细胞计数(免疫系统功能的一种晴雨表)由于CD4+最终指标的不定性,所以这一可利用的信息似乎不可能成功地让药物得到批准;可是对叠氮胸苷没有反应的病员缺乏治疗药物,而当时正在进行的三个对照组要得到肯定性的数据需要等待近一年的时问,因而两者相悖。因此,食品药物管理局开始集中力量以获得更多的关于ddI对CD4+细胞作用的信息,以及CD4+细胞计数和临床结果之间的关系。而且,研究人员采用一种独特的、不定期的方法从正在进行试验的病人那里考察CD4+数据。
1991年10月9日,食品药物管理局以不太满意的选择为病人批准了ddI,主要是由于这种药物对CD4+细胞计数有正的效应,并且得知试验确已完成。这些最终得到的有说服力的临床数据证实了尽早批准,同时导致拓宽ddI的指标的标记性的变化。即使如此,CD4+细胞计数与HIV(人免疫缺陷病毒)病的发展和许多有希望存活下去的人之间没有密切的相关关系:这提醒人们,对药物的评估存在有可代替的最终指标再加上不肯定性。
国立心脏、肺和血管研究所的心节律抑制试验(CAST)表明怎样才是最不可靠的代替的最终指标。研究人员已经发现,心脏病发作后心室过早收缩的(一种电触异常心跳)病人似乎比没有这类收缩的病人更有可能死亡。由于直觉地来有理由相信,抑制这类收缩会减少死亡率,所以心节律抑制试验的结果是大为令人惊奇的。试验中的有些药物抑制了这种异常的心跳,但使用这类药物而死亡的病人为对照组的2.5倍。这种结果反映出所研究药物的毒性,或存在有某些未知的其它因素。
尚未受到重视的另一个风险是,研究人员由于对使用的替代药物没有影响而过早地摒弃一种药物。研究人员开始研究γ-干扰素时预料它会影响过氧化物的产生并通过血细胞而摧毁细菌,由此而减轻由典型性慢性肉芽肿病(儿童期发现的一种罕见的免疫失调症)感染而对生命的威胁。尽管γ-干扰素对这些实验室试验结果无影响仅在几周内就被测出,但作为预定的方案,试验仍在继续。试验结果是令人惊奇的:一年后,γ-干扰素已明显降低了感染率,而且对任何替代药物均无可检测到的影响。只是在临床的最终评论(指标)才让γ-干扰素的价值得到鉴别。
即使替代物有缺点,但它们的数据在架设沟通使用权(根据有希望的替代药物而提供的)和答案(临床效果确立时获得)之间的桥梁可能是有价值的。作为威胁生命的疾病之艾滋病,仍在继续探索最佳的替代药物之可能性。
灵活的试验设计
食品药物管理局正试图通过增加可以接受的试验设计范围来鼓励有效药物的发展战略。研究人员在不危及品质的情况下能够得以加速数据的收集。食品药物管理局鼓励研究人员与该局的代表会晤,以便研究计划能够得到评审;往往有可能尽管背离了传统的方法但仍然可保持科学的严谨性。
加速数据收集的一种方法是“大而简单的试验”。与传统的试验相比,这类试验在合格率、各种各样治疗小组的注册病员以及收集比较不够广泛的基础数据和结果方面都有较宽松的标准。结果,使病症范围较广的较多病人能够参与,而使研究人员在明显缩短的时间内能够进行非常大量的研究。
第一次国际梗塞存活研究(ISIS)就是一例,在10个国家中有16,000位病人在心脏病发作后给予静脉β-阻滞剂或配合安慰剂治疗。研究人员发现,在接受治疗的病人中,7天后死亡率下降15%(接受治疗的死亡率为3.9%,而未接受治疗的死亡率为4.6%),在以前较小规模的试验中未测出此种作用。这种试验是简单的,因为它只需要收集比较少的数据;但巨大的群体却允许测得较少的而十分有价值的效应。
这类试验在已充分了解其药物的毒性状况和作用机制之后一般是最可行的。这类试验能够鉴定出适度(中等)规模的各种效应,而这些效应在小群体内是不可能发现的。大规模的、简单的试验还可用于收集有关在临床使用中怎样使药物得到最佳配给的重要数据,而且还能在试验完成之后作为有希望的试验性治疗方法加以利用。最近有些观察人员已向食品药物管理局提出建议,在答应加速审批的前后,食品药物管理局考虑需要把这类试验作为完成上市后研究的手段。
登记研究的标准是另一个领域,对此,研究人员可以采取比较灵活的态度。历史上,研究人员曾尽可能地在治疗病人方面狭义地和孤立地规定过一些登记的标准。这些限制有一些优点,因为它们减少了变异性,并使之易于证明所研究的药物的效应。不过,在科学上来说,它们仍有不足之处。例如,在伦理上可能很难拒绝患有严重疾病的病人以有治疗潜力作为参试的条件,而且,这些限制可能放慢试验注册登记,在药物可能被最终使用的情况下,鼓励未登记的其它治疗药物的使用,并使试验的结果不能真实反映出实际的情况。由于允许取样样品规模的增加,可以采用非常广阔的登记标准,而且允许病人有权使用其它治疗药物。登记标准的这种灵活性在艾滋病药物试验中是特别重要的。
当病员正在采用多重治疗时,研究人员也许必须研究不同药物组合试验的毒性和好处,而不是进行单个药物的研究,以此研究新的药物是否要适当的加进一些现存的药物。测试多重介入的多因子试验设计正在作为一种快速、有效的积累知识的方式出现。在这种最简单的形式中,一组病人接受疗法A,一组病人接受疗法B,一组病人接受疗法A和B两者,而第4组病人什么也不接受。例如,在艾滋病患者中,就可以同时地评价不同抗病毒药物或不同抗病毒药物和其它药物阻止致病感染机会的效果。
因子试验设计之所以比两个单独的试验更有效,原因在于它能够通过简单的程序回答多重问题。然而,结果是难以解释的,因为药物间的相互作用其方式是十分复杂的。例如,一种治疗药物当其单独使用时可能没有作用,但当配合使用时就会有强烈的效果。大的试验规模和细致的统计将减轻这些难处。多因子设计还可使研究人员留心重要药物的相互作用。
在某些情况下,食品药物管理局可以根据一项研究的结果而不是两个独立试验的结果来审批药物。当试验在存活率或严重发病方面表现出特别有说服力的差异时,食品药物管理局就会做出这类决定,患艾滋病的病人用叠氮胸苷(AZT)所作的初步的多中心、双盲、安慰剂对照试验就属这种情况。在患艾滋病的病员中,接受安慰剂的有16人死亡,而接受氮叠胸苷的则只记载有1人死亡。根据这一结果,研究人员停止了试验,而叠氮胸苷则获得迅速的批准。
目前,研究人员按常规要进行临床结果的过渡性分析,在研究中考察了存活率或主要发病率,而得到预期结果后也可能停止试验。例如,在过渡性分析证明在服用了叠氮胸苷的艾滋病患者中明显地延缓了艾滋病的发展后,结束了两个关键性的叠氮胸苷的试验。这些成果导致1990年3月把叠氮胸苷列入人免疫缺陷病毒感染人群的广谱药物。
然而,根据过渡性分析做出决定仍必须谨慎,因为这种数据是不完整的,而且很可能缺乏足够的长期跟踪。1993年4月,英国和法国的研究人员报导,三年的跟踪时间表明,对无症状的艾滋病感染病人来说,长期使用叠氮胸苷没有明显的益处。尽管此种判定本身不是决定性的——已证明早期使用叠氮胸苷有一些后效——它强调说明相信过渡性分析时进行继续跟踪的重要性。
缩短试验
单是在第1阶段试验有时就可以收集通常在第2阶段中才收集的毒性数据和初步的、短期的有效性数据。这类试验一般比传统的第1阶段试验规模要大些,应该是随机的和必须包括合理的剂量范围。在有些情况下,很有可能把第3阶段试验省掉。如果药物的第2阶段试验表明对严重疾病的存活率或不可逆转的发病率有影响,那么食品药物管理局就可以得出结论,即使药物的风险仍需进一步评估,但治疗的效益超过风险。
可是,缩短试验是要冒风险的,特别是在剂量反应信息不足和往往只依靠短期跟踪小样品的病人的情况下更是如此。如果已有的成果包括低剂量病人群体,使得叠氮胸苷获得初步批准以低剂量使用,那么医生们根据早已掌握叠氮胸苷的临床效果的资料,就可以以较低的、非常小的毒性的剂量来达到,而病人也许会忍受住小的副作用。虽然初步证实,用增加了存活率来证明批准是合适的,但精确的评定须待以后才能做出。幸运的是,对其它两种抗艾滋病病毒药物ddI(双脱氧肌苷)和ddC(双脱氧胞苷)的关键性的试验是根据叠氮胸苷的教训而设计的,它包括高剂量和低剂量双管齐下。
根据这些情况的不同,许多试验设计之一对于研究新药来说可能是最合适的。在食品药物管理局和研究人员对临床试验计划进行评审时,我们将继续加深我们的认识,究竟哪些方法才将能在合适的时间得到尽可能完善的数据。
在平衡中求生存
面对着严重的或威胁生命的疾病之际,在用药之前需要得到有关有应用前途的治疗药物之最佳信息,但这必须与尽快能获得有用的产品相协调。按理论上来说,食品药物管理局只有根据成熟的、已证实对病人有实效的、完全可再现的数据才会批准一个新药。虽然如此,但也不可避免地遇到某种药物非常重要,以至于获得批准或在强烈限制下广泛使用,但仍需要足够的基本数据。
当这种加速批准得以出现时,研究人员、临床医生和病人都必须了解这些风险。虽然食品药物管理局尚未撤消加速批准权,但很显然我们最终将允许加速推广未曾使用(研究)过的药物。病人也将为使用无效药物而浪费宝贵的时光;他们甚至还可能受伤害。这种风险强调,在加速批准得到同意之后仍需要继续进行临床试验。不完善的或带有错误的数据既不能用于病人也不能作为知识使用。对所有可能加速新的治疗药物使用相关联的机制来说,食品药物管理局对安全性和有效性的承诺仍然是不变的——所有批准的药物,即使是对那些可能致命的疾病的药物。最终都必须接受同样严格的标准。
【赵裕卿/译 刘义思/校】
请 登录 发表评论