研究人员现在能够建立这样一种小鼠,这种小鼠可携带任何已知基因的任何预选的突变。这种工艺正在变革哺乳动物生物学的研究。
我们机体的每个细胞的核里都有一本规定其功能的指令手册。尽管每个细胞所具有的“指令手册”都是相同的,但是不同类的细胞,如肝细胞或皮肤细胞却利用指令手册中的不同部分来详细地确定其独特的功能。也许最值得注意的是,这种“指令手册”含有一种信息,这种信息可使单细胞胚胎(受精卵)变成胎儿,随后再变成新生儿。当婴儿在机体和智能上渐趋成熟时,他(或她)仍然利用“指手册”内的这种信息。我们每个人都各具特色,因此,我们的这本“指令手册”也各不相同:它确定了我们的大部分机体的以及许多行为上的特点,正是这些特点把我们区分为个体。
这种不同寻常的“指令手册”也就是人们熟知的基因组是以核苷酸的形式书写成的。四个核苷酸一腺嘌呤(A),胞嘧啶(C),鸟嘌呤(G),胸嘧啶(T)——构成了整个字母表。传递信息的DNA中核苷酸精确的顺序正好像传递含义的某个单字中字母的顺序。在每个细胞的分裂过程中,整本“手册”被复制,其拷贝由母细胞传给它的两个子细胞。人和小鼠的这本手册各包含30亿个核苷酸,如果代表核苷酸的字母以每页300O个字符写出来,那么以每卷1000页计,这本手册将达1000卷之多。因此,需要有一本极复杂的手册才能使受精卵变成一个人或一只小鼠。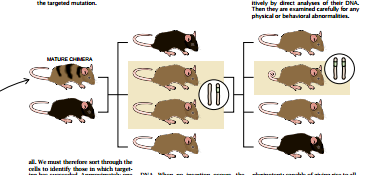
最近,我在犹他州立大学的同事们和我研究出了一项技术,可用来在活小鼠的每个细胞内特定地改变指令手册中的某个字母、某个句子或某几个段落。我们重写手册中的几个部分并鉴定改变后的指令对小鼠发育或发育后功能的后果。这样就能够了解控制这些过程的程序。
指令手册里的功能单元是基因。我们特定地改变选定基因的核苷酸顺序,从而改变了它的功能。例如,如果我们推测某个特定的基因是参与脑发育的,那么我们就能够产生出正常基因已“丧失功能”。也就完全丧失了活力的小鼠胚胎。如果这一失活作用使新生小鼠有了一个畸形的小脑,那么我们就能够知道这个有疑问的基因是形成脑子的这一部分所必不可少的。把特定的改变手段用于被选定的基因的核苷酸顺序的过程叫做“基因靶”。
从小鼠基因靶试验中了解到的许多情况必将有利于人类,因为人和小鼠估计大约有99%的基因是相同的,而且可用来达到非常相似的目的。早已在小鼠身上使用此种技术后搞清楚的情况不仅包括人胚胎发育的各个阶段,而且还包括我们的免疫系统形成和抗感染的各种途径。利用基因靶方法还会继续揭开诸如人脑是怎样工作的,以及基因受损怎样会引起疾病等各种奥秘。在今天的计划中,这项技术将被用来建立胆囊纤维化、癌症以及关节炎在内的人类各种疾病的小鼠模型。
基因靶方法之所以令人激动还有另外一个原因。它预示我们将从基因组研究计划中扩展所获得的知识。这项大规模的举措旨在确定小鼠的和人的基因组里每个基因的核苷酸顺序(每个基因组里大约有200,000个基因)。现在我们只了解人和小鼠的极少量基因的功能。基因的核苷酸顺序确定那些必定会串联在一起组成某种特定蛋白质的氨基酸。(蛋白质实现细胞里的大部分活动。)蛋白质的氨基酸序列可提供有关在细胞中所起各种作用的重要线索:例如,这个蛋白质是起酶的作用呢,还是作为细胞的结构组分或传递信息的分子。但是氨基酸序列单独还不足以显露该蛋白质在动物生命过程中所执行的特定任务。而基因靶方法却能提供这种信息,从而使我们大大地加深对基因及其蛋白质功能的了解。
![1505627611680606.png ]121AHMZPGXS3SNT%YJOPMV.png](/resources/image/20170917/1505627611680606.png)
基因靶为研究人员提供了研究哺乳动物遗传学,即确定基因怎样介导各种生物学过程的一条新的途径。之所以需要这一技术是因为在分析简单的有机体内生物学过程方面极为成功的遗传学的经典方法已不适用于像哺乳动物这样复杂的有机体。
例如,如果遗传学家们需要了解单细胞生物,如细菌或酵母怎样复制其DNA时,他们能够使成10亿或更多的个体去接触伤害DNA的化学物质(诱变剂)。他们只要选定合适的诱变剂的剂量,就能够保证该群体中的每一个个体携带一个或多个突变基因。遗传学家们能够从这一突变了的细菌或酵母的群体里鉴别出不能复制其DNA的个体。利用这么大的突变群体就可能找到在DNA复制所需要的每个基因中都带有突变的个体。(有100多个基因参与像复制细菌或酵母的基因组这样复杂的过程。)一旦鉴别出这个别的基因,就能够确定它们在DNA复制中的作用,如哪些基因是决定DNA拷贝的,哪些基因是控制拷贝的精确度和速度的。
![1505627625287712.png }0PP7L%{364MUWI]Z[C8{E4.png](/resources/image/20170917/1505627625287712.png)
类似的方法也一直被用于较为复杂的多细胞生物。遗传学家们最常用的是生活在土壤里的细小的蠕虫Caenorhabditis elecans和黑尾果蝇(Drosophila melanogaster)。但是即使在比较简单的多细胞生物里.要鉴定参与某个具体的生物学过程的全部基因也是比较费时的。
许多因素增加了上述工作的难度。其中之一是基因组的大小。大肠杆菌的基因组只含3000个基因,而黑尾果蝇的基因组则至少含20000个基因;小鼠的基因组所含的基因数则是果蝇基因组的1O倍。基因越多越复杂,因为这些基因形成更为错综复杂、相互作用的网络。要在这样的网络里追踪任何一个基因的功能都是—项棘手的任务。
此外,多细胞生物比较大,所以实际上限制了能用于诱变试验的个体数。在1O亿多个突变的细菌或酵母里寻找特定类型的突变体是相当简单而又不费劲的。相反,即使筛选100000个突变的果蝇也将是项大型的试验。相比之下,为了筛选小鼠的特定突变,实际的限量约需1000头小鼠。
鉴别和研究多细胞生物里的基因,从逻辑上来讲,其困难还将增加,原因是大多数细胞生物是二倍体——它们的细胞携带着大多数基因的两个拷贝;一个来自父体.另一个来自母体。为了存活,大多数基因有两个拷贝是值得的。如果一个拷贝发生了有害了突变,那么另一个拷贝通常能够补偿.因此不会引起严重的后果。但是,多一个拷贝意味着突变只有在两个拷贝都受损害时才能引发解剖上和生理上的缺损。研究人员使各自基因的一个拷贝中都带有突变的双亲交配,从而取得了这样的个体。这类交配所得的后代中大约四分之一将携带基因的两个缺损拷贝。因为要进行交配,所以分析工作就会被延误。

尽管面临着这些挑战,在完整的动物身上鉴别选定的突变肯定是开始阐明和分清生物学过程赖以实现的诸多步骤的一种最有效的方法。此外,如果我们想要了解只在复杂的有机体内进行的过程(如引发复杂的免疫应答).就必须在这些有机体内进行这样的分析。鉴于这些原因,对哺乳动物的发育、神经功能、免疫应答、生理学和疾病等感兴趣的遗传学家们都转向了小鼠。从遗传学家的观点来看,小鼠是理想的哺乳动物。小鼠的体型小.繁殖量大,而且可以作为人的大多数生物学过程的最好参照系。
另一方面.能在小鼠身上进行的基因操作的可行度相对于有可能用简单的有机体进行的可处理性来说是极为有限的。正因为存在着我在前面描述过的各种障碍。所以不能把经典技术实际用到小鼠身上。为了鉴别出在参与所研究的某个过程的基因中带有缺损的突变小鼠,研究人员必须付出极高的代价去筛选l0000—100000头小鼠。代之以这类小鼠的是遗传学家们过去曾研究了在小鼠集群中自发产生的突变小鼠。研究人员敏锐地观察和坚忍不拔的研究,结果是意外地收集到了大量小鼠突变体。对于继续进行研究来说,这是无法估价的资源。
但是,这些得来不易的小鼠也有其不足之处。现在收集到的突变小鼠在其基因组中没有隐藏随机的突变样本。相反,它们中包含着数量不相称的可引发生理学和行为方面容易观察到的各种异常现象的突变。其结果是,在收集到的这些小鼠中有许多影响外皮颜色的突变,而没有见到能影响早期发育的突变(因为这些突变往往导致胚胎未能检测到的死亡)。
此外,关于导致突变小鼠外观缺损的基因的分离工作的劳动量极大,通常需要协力工作几年。研究人员不需要找到参与的基因就能够推断出涉及生物学现象的许多步骤。但是不分离到这些基因,他们就不能够在分子水平上取得进展。特别是,他们不能够确定由突变基因编码的蛋白质的性质,而且也不能够鉴别这些基因活动所在的细胞。
基因靶使研究人员得以克服这些困难。现在,研究人员可以选定需要改变的基因。实际上,他们已经能够监视某个基因是如何被修饰的,从而可以按预定要求制造突变以解决有关该基因功能的细节问题。关于选择哪个基因供突变处理的标准,所依据的是研究小鼠或其他动物后获得的知识。例如,现在都直接分离在新形成的小鼠心脏里活动的基因。这样,基因靶就可使研究人员有可能确定这些基因中的每—个在心脏发育中所起的作用。另外,我们还能够搞清楚已知能引导黑尾果蝇发育中的神经元通道的那组基因是否存在,以及它们在小鼠身上是否也起类似的功能。
初始的做法往往是分离基因以判断这样做对没有这一基因产物的有机体的后果。后果也许很复杂,而且也许会影响到许多方面。引入比较稳定并且已被确定的、可能只影响基固多种作用之一的突变,就可以进一步看清该基因的功能。不久,遗传学家们必将能控制基因的开关。这样的开关将使研究人员在小鼠的胚胎发育和出生后发育的过程中启动和关闭基因。例如,某个假设的基因可能是决定一组神经细胞的产生和其特有的作用方式的。去掉这个基因将会使脑形成缺少这些神经元,因此不可能再对该基因在成年的动物体内的活动作出判断。但是,如果能控制该基因的开关,那么就可以说这个基因在发育过程中开启而使神经元得以形成。然后在试验动物成年后再关闭这个基因。这样就使研究人员有可能判断这个基因在成年动物的神经元中所具的功能。
基因靶技术是在近15年里开发的。70年代末,我曾用极细的玻璃针把DNA直接注入哺乳动物细胞的核里作试验。玻璃针是用液压显微操纵器控制的并在高分辨率显微镜下把玻璃针指向细胞核。后来证明,这种做法特别有效。3—5个细胞里有一个得到了功能型的DNA后,继续分裂,并把这个DNA稳定地传递给它们的子细胞。
当我跟踪细胞这些DNA分子的去向时,一个出人意外的现象引起了我的注意。尽管这些新引入的DNA分子是随机地插入受体细胞的染色体之一的,但却可能有不止—个分子被插入进那个位点,而且所有的分子都是—个走向。就像任何语言中的单字都有一个走向(英语中是从左朝右读)一样,DNA分子也是这样。看来,在细胞完成随机插入之前,细胞核里的某种机制实际上已把所有被引入的DNA分子以同一走向缝在一起了。
我们继续证明细胞是利用一种叫做同源重组过程来到这种连锁的。同源重组只对具有相同核甘酸顺序的DNA分子起作用。这种分子是一个接一个地排列的。然后,两个分子被切开并在切开的一端相连。这种连接精确到使连锁点的核苷酸顺序不致被改变〇
未料想到的观察结果意味着所有的小鼠细胞,也许乃至所有的哺乳动物的细胞都具有完成同源重所需的机构。与此同时,没有理由去推测体细胞(不参与性繁殖的细胞)会有这种机构。此外,我们知道这种机构非常有效,因为我们有可能用显微方法向细胞注入100个同样顺序的DNA,而且细胞还将以同一方向把它们组合在一起。我立即意识到,如果我们能够在新引入的我们所选定的DNA分子和细胞染色体中的同样DNA顺序之间利用这一机构实现同源重组,那么我们就将能重写细胞的指手册。
在这一前景的鼓舞下,我在1981年向政府申请经费用于试验基因靶的可行性。使人失望的是,被负责审査这项拨款申请的科学家否决了。他们认为,要使新引入的DNA顺序在1000卷基因指令手册中找到与其匹配的顺序,几乎是不可能的。
![1505627676425301.png KWHEK%B]E$X6AW~O)~JSM{B.png](/resources/image/20170917/1505627676425301.png)
尽管遭到了拒绝,我仍决定使用我从另一个科研项目得到的经费。这样做是冒风险的。如果试验失败,我将没有理由再申请经费了。值得庆幸的是,当我再次申请进行这项研究用的经费时,我已能充分证明基因靶确实适用于细胞。正是审査我第一次申请的那些科学家中许多人现在都显示了一种幽默感。他们在评论我的这一次申请时是这样开头的:“我们很高兴你没有听从我们的劝告。”
在细胞里怎样实现基因靶呢?第—步是克隆所要研究的那个基因并在细菌内进行增殖。这—步骤可提供含有该基因的纯DNA源。下—步,在试管里改变该基因的核苷酸顺序使之达到试验目的。这种改变了的基因叫做靶载体。
把这个靶载体用几种方法中的任何一种方法引到活细胞里。它一旦进入细胞核后,就会和构成细胞的同源重组机构的蛋白质形成复合体。它会在这些蛋白质的协助下,找遍基因组的所有顺序,直到找到其同类靶为止。如果它真的找到了靶,那么它就会靠近郡个基因并取而代之。
令人遗憾的是,只在少量处理过的细胞里实现了靶基因的置换。靶载体通常被随机地插到了非匹配的部位或者根本未被整合。因此我们必须查遍细胞以鉴别出达到靶的那些细胞。一百万个被处理的细胞中,大约有一个细胞完成了所需要的靶置换。
![1505627700832409.png R9_%R01Y7YCAE5}O]RM}8QG.png](/resources/image/20170917/1505627700832409.png)
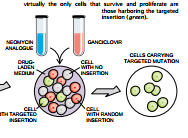
为了大大地简化寻找这个细胞的工作,我们利用了两个“可选标记”。一开始就把这两个标记引到靶载体里去。可选的“正”标记能促使已整合的靶载体(或者在靶位或基因组里的随机位置上)存活和生长。可选的“负”标记则有助于去掉大部分已在某个随机位置上整合进靶载体的那些细胞。
正标记通常是抗新霉素(neo)基因,将被安置在也存在于此靶基因中的DNA之一侧。负标记通常是取自癌疹病毒的胸昔激酶(tk)基因附着在靶载体的一端。实现同源重组时,克隆基因的未改变片段连同夹在它们之间的neo基因能取代染色体里的靶顺序。但是tk基因留在配对的顺序区域之外,不能进入染色体而被细胞降解。与此相反,当细胞随机地插入靶载体时,它们能和基因一起把整个载体组合进DNA。在未实现插入时,载体和它的两个标记都会消失。
我们不需要直接检验DNA以鉴别这些不同的结果,而是把这些细胞培养在含有两种药物的培养基里。这两种药物是新霉素的类似物(G418)和抗疱疹药ganciclovir、G418能杀死在染色体中没有正neo基因的细胞.即未能整合载体DNA的细胞。但是它能使携带随机插入物或靶插入物的细胞存活下来。同时,ganciclovir能杀死携带疱疹tk基因的细胞,即隐藏着随机插入物的细胞。结果是,实际上只有带目标插入物的细胞能够存活下来。(具有“正的可选择”的neo基因和没有“负的可选择”的基因的细胞)。到1984年,我们已经证明有可能在培养的小鼠细胞里存在特定的靶基因。然后,我们准备进一步利用这一技术去改变活细胞的基因组。为了实现这一目标的,我们利用由剑桥大学的Matthew H.Kaufman和Martin J.Evans开发的特定细胞。这些细胞是取自胚胎的干细胞(ES)。这类细胞取自早期的小鼠胚胎。这些细胞能够无限期地培养在培养皿里,因此是多能的:能产生各种类型的细胞。
简而言之,我们借助上文描述过的方法生产了在一个选定的基因的—个拷贝里带有靶突变的ES细胞。然后,我们把这些ES细胞注入早期的小鼠胚胎里使胚胎得以按我们的要求去发育。由此而产生的小鼠在成熟时将会生产出由ES细胞产生的精子。我们将这些小鼠和正常的小鼠交配后取得了对突变来说是杂合的后代:这些后代的每个细胞里,其基因的两个拷贝里的一个带有突变。
这些杂合体在大多数情况下将是健康的。因为它们的第二个未受损伤的基因拷贝仍将正确地发挥其功能。但是这些杂合体和它们携带同样突变的兄弟姊妹们交配后会产生纯合体,即在基因的两个拷贝时都携带靶突变的小鼠。这样的小鼠会呈现出异常现象,而这些异常现象将揭示靶基因在其所有的组织中所起正常功能。
当然,这种方法容易总结,但不易实行。为了真正地去进行这项研究,我们首先把经我们修饰的ES细胞注入尚未附着到母体子宫上去的胚泡期的胚胎中。正因为我们是依据皮毛的颜色来确定试验过程是否按计划进行的,所以我们选择这样一些胚泡,由这些胚泡发育成的幼鼠的皮毛颜色将不同于由获得ES细胞的品系生下的幼鼠。
干细胞是从带有agouti基因的两个拷贝的棕色小鼠身上分离到的。这个基因即使只表现在—个拷贝中时,也会使鼠毛黄黑相间而形成棕色。(这些色素是在另一些基因的控制下产生的。)因此,我们通常选择在正常情况下会发育成黑色小鼠的胚细胞。(如果从双亲那里遗传下来的agouti基因受到损伤,小鼠皮毛就成黑色。)然后我们使含有修饰了的ES细胞的胚胎在代理母亲体内成长。
如果一切进展顺利,那么这些改变了的ES细胞将在此期间重复繁殖,把它们所有基因的完整拷贝都传递给它们的子细胞,这些细胞和胚胎里的同类细胞相混合而形成小鼠的大部分组织。其结果是,新生小鼠成了嵌合体:它们是由来自外来ES细胞和来自原有胚胎的细胞组成的。我们在那些本应是黑色的皮毛中观察到了大块棕色皮毛后立即就鉴别出了这类嵌合体。如果这些小鼠不带取自ES的细胞。那么它们将不可能全部成黑色。因为它们缺乏功能性的agouti基因。
但是只检验嵌合体还不能够确定ES细胞是否能产生生殖细胞,即把靶突变传递给未来各世代的载体。我们只是在进行到下一步时才弄清楚了这一点:产生了在所有的细胞中隐藏着该突变的一个拷贝的杂合体小鼠。为了生产这样的小鼠,我们使嵌合体雄小鼠和没有agouti基因的黑色雌鼠交配。如果给卵授精的精于是来自ES细胞的,那么其后代将是棕色的(因为所有这些精子都携带agouti基因)。如果精子来自原来的胚细胞(这些细胞没有功能性的agouti基因),那么产生的后代将是黑色的。
因此,当我们看到棕色幼鼠时,我们就知道由ES细胞携带的基因已传给这些后代。这样,我们就能够考虑在杂合体小鼠同胞之间进行交配以产生带有靶基因的两个缺损拷贝的小鼠。但是,首先我们必须判定这些棕色幼鼠中哪些带有突变基因的拷贝。我们的做法是直接检验其DNA的靶突变。在杂合体同胞之间进行交配后,有四分之一的后代将携带该基因的两个缺损拷贝。我们再次分析其DNA以挑选出杂合体。这一点是寻找靶突变的两个拷贝。然后仔细地检验这些小鼠是否有什么能提供有关受破坏基因的功能的生理的和行为的异常现象。从克隆基因到产生在该基因中有靶突变的小鼠的整个过程大约耗时一年。
现在世界各地的实验室都在利用小鼠进行体内靶基因试验,以研究一系列生物学问题。从1989年以来,已经生产出25O多个带有选定的基因缺损的小鼠品系。已有结果的几个例子将说明这些小鼠能够提供哪些信息。
我在自己的实验室里,我们利用了同源异型基因即Hox基因。这些基因起着万能开关的作用,以保证机体的不同部分,如肢体、器官以及头颅的各部分形成在适当的部位并具有正确的外形。用果蝇的同源异型基因进行的研究已经得到了有关其活动的线索[参见“机体设计的分子设计师”《科学1994,No.6》]。但是还有许多问题没有搞清楚。例如,果蝇只有8个Hox基因,而小鼠和人则各有38个Hox基因。也许,Hox基因族的扩大在由无脊椎动物向脊椎动物的进化过程中起了关键的作用:提供更复杂的机体所需的额外机构。那么所有这38个基因到底起什么作用呢?
在基因靶变成现实之前,没有办法去解答这些问题,因为还没有人找到过在38个Hox基因里的任何一个带有突变的小鼠。我的同事们和我现在正在为确定每个Hox基因的功能而开始一项系统的研究工作。然后我们将试图确定这些基因怎样形成相互作用的网络去引导我们机体的形成。
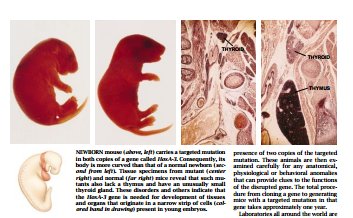
作为这项研究计划的一个部分,我们发现有目的地破坏Hox A一3基因会导致多重缺损。带有这—基因的两个突变拷贝的小鼠在出生时即因心脏和由心脏向外伸展的血管发育不全所引起的心血管机能障碍而死亡。这此小帮在出生时,它们的许多组织,包括胸腺和甲状旁腺(没有此种腺体)、甲状腺、骨骼和头下部的软骨以及结缔组织、肌肉和喉部的软骨等都出现畸形。
这些畸形各不相同,但都拥有一个令人惊奇的共同点:这些受损的组织都产生于原来聚集在发育中胚胎上部中一个狭窄区域内的细胞。例如,心脏的退化部分在心脏占有其胸部较后位置之前就定位在这个区域了。因此,HoxA-3基因的任务是监督在这狭窄区域里产生的许多组织和器官的结构。
出人意料的是,在人类的遗传性疾病Di George综合征中发现了去掉小鼠HoxA-3基因模拟物后产生的异常现象。该病患者的染色体分析表明,人的HoxA一3基不是罪魁祸首:受害情况在远离该隐藏的HoxA一3基因的染色体上显示基因损伤。但是,现在我们知道,引发该综合征的基因所起作用是或者干扰HoxA一3基因的活动,或者干扰由HoxA一3基因活动引起的一系列活动。此外,现在已经可以得到终于能够为治疗该病提供线索的小鼠模型。这个事先未料到的好处又一次强调说明了基础研究的价值:由好奇心驱使而获得的研究结果,往往导致具有高度实用性的方法。
免疫学家们和发育生物学家一样也因使用基因靶而得益匪浅。他们现在正在用这种方法阐释能影响人体最主要的两类防御细胞(B淋巴细胞和T淋巴细胞)的发育和活动的50多个基因的各别功能。
癌症研究者也受到这种方法的鼓舞。研究人员通常知道某个特定基因里的突变往往是一种或一种以上肿瘤所共有的。但是他们不知道这一基因的正常作用。利用我们的分离技术来搞清楚该基因的作用有助于揭示这个基因的突变是怎样引发恶性肿瘤的。
p53肿瘤抑制基因提供了一个恰当的例子。肿瘤抑制基因是这样一些基因,这些基因的失活会导致肿瘤的发展和恶化。人类80%的癌症也许都会出现p53基因的突变,但是直到现在都还没有搞清楚这一正常基因的确切功能。有目的地破坏p53以分析小鼠纯合体后表明,p53的作用也许像一头看家犬,它阻止健康细胞分裂一直到修复存在于细胞里的任何一个受到损害的DNA为止。这种DNA的受损害状况往往是我们遭受的经常性的环境危害所造成的。功能性p53基因的丧失会失掉这种防护,从而使受损害的DNA得以传递给子细胞,参与癌症的形成。
还有其他许多病都适于使用基因靶法进行研究。人类大约有5000多种疾病可归因于基因缺损。研究人员只要鉴别出与这些疾病有关的基因和突变就能够在小鼠身上精确地创造出同样的突变。而这些小鼠模型反过来必将使我们有可能详细地跟踪查明因基因差错而引发疾病的一系列事件。深入了解疾病的分子病理学必将使我们有可能开发出更有效的治疗方法。现在正在设计的模型中有在囊性纤维变性基因中携带不同突变的小鼠。
为了研究会导致中风和心脏病发作的动脉粥样硬化,现在也已经开始使用基因靶法。和囊性纤维变性不同,动脉粥样硬化并不是由单基因中的突变引起的。许多基因的缺损连同环境因子一起会促使动脉内形成斑块。尽管如此,现在已经通过改变参与处理甘油三酯和胆固醇的基因来建立有希望的小鼠模型。我还预料不久将开发出可用于研究心脏病和中风的另一个病——高血压的小鼠模型。现在看来已经鉴别出参与这些疾病的发展的基因。
随着对引发疾病的基因了解得越来越多,自然会想要利用基因疗法来纠正这些缺损。在这种情况下,通常用于基因疗法的技术都依靠把健康的基因随机地插入染色体,以补偿受损伤的基因。但是这些插入基因的功能往往不如它们能定点到染色体上指定的部位时那样有效。基因靶原则上则能够解决这个问题。但是,在使之能够用来纠正患者组织里的缺损基因之前,研究人员可能还需要建立能参与形成成年人的那种组织的细胞培养物。这类细胞像我们研究的ES细胞叫干细胞一样,是存在于骨髓、肝、肺、皮肤、肠以及其他组织里的。但是关于分离和培养这些细胞的方法的研究工作仍需用幼小细胞进行。
为把我们的方法用于基因治疗,还存在着某些技术上的困难。在这些困难被克服之前,基因靶法将可通用于有关哺乳动物的神经生物学方面的研究。早已制备出带有会影响其学习能力的靶突变的小鼠。随着被鉴别的神经特异性基因的增多,这方面的研究步伐肯定会加快。
我们能够预料到基因靶技术将会继续得到改进,即使在几年前难想像的方法,而今已有可能用来操纵哺乳动物的基因组。为了明显地助于阐明作为哺乳动物某些复杂过程(如发育和学习)基础的那些机制,研究人员将必须发挥其全部聪明才智,小心翼翼地决断哪些基因要改变,并且利用会带来大量答案的方法去修饰这些基因。基因靶为基因纵操开辟了广泛的可能性,只要我们想像得到的我们就能做得到。
请 登录 发表评论