线粒体的DNA与衰老和疾病
Douglas C. Wallace*
染色体以外的所谓“线粒体”的细胞结构的DNA缺陷会引起一系列的疾病,其中或许包括使老年人致衰的名种疾病。
一个看上去健康无病的男孩5岁时莫明其妙地开始丧失听力,到他年逾18岁以前,听力就丧失得一干二净了。在听力还未完全丧失的过渡期间,据诊断,他患有活动过度和偶发性癫痛发作。到23岁时,他的视力也衰退了,还患有白内障、青光眼和进行性视网膜退化症。在5年内,他经受了多次癫痫大发作,并出现了肾功能衰竭。他在28岁时死于肾病和全身性感染。
他的问题的根源在于一种基因的微小缺陷,但致其死亡的并不是每个细胞核都有的染色体DNA的长线形串中人们熟知的基因的缺陷,而是其细胞的一发电厂—线粒体一一的人们不大了解的DNA的小环的异常。每一个这种小环均含有线粒体产生能量所必需的37种分子的遗传蓝图。
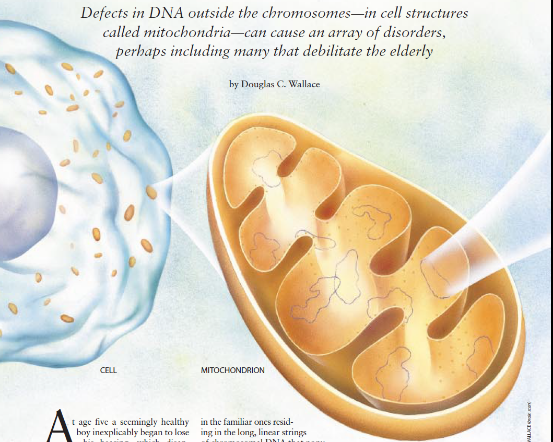
从1963年起,科学家们就己知道。动物的线粒体含有自身的基因,然而只是到了1988年,这些基因的缺陷才同人类的疾病联系起来。1988年,笔者在埃默里大学的实验室将几个家庭的一种年轻成年人的视觉缺失(即勒伯尔遗传性视神经病)的根源追溯到一种线粒体基因的微小遗传性突变。大约与此同时,伦敦的神经病学研究所的伊恩·霍尔特、安尼塔,哈丁和约翰,摩根一体斯将线粒体DNA分子的相对大的区段的缺失同进行性肌病联系在一起。
如今,埃默里大学以及其它地方的研究人员已经知道,线粒体DNA的缺陷会引起或促致各种各样的疾病,其中一些其症状虽说并不明显,但却有可能是灾难性的。或许具有更普遍的意义的是,线粒体DNA的突变性至少同一些(或许是众多)糖尿病和心力衰竭病例有关。此外日益增多的证据表明,线粒体的基因受损有可能在衰老过程和人的晚年常见的慢性变性疾病(如早老性痴呆症和各种运动障碍)中起作用。
最近,线粒体的DNA因其它原因而吸引了人们的注意力。通过对比全球不同人口种群的线粒体DNA的碱基对顺序(即人们熟悉的DNA“阶梯”上的不同“梯级”即编码单位),科学家们现已获得关于解剖结构上的现代人类的进化与全球性迁徙的振奋人心的线索(参见本文最后一幅插图〕。法医学研究人员发现,较小规模的对比不仅对鉴别在战斗中失踪的士兵(以及其他一些死亡已久的人)遗体有用,而且对确定受控犯罪嫌疑人是否确实应对归咎于他们的罪行负责也有用〔参见本文后面的框内文字)。
尽管大多数生物学家在最近以前对线粒体DNA都不大注意,但据预测,线粒体的遗传物质的突变却有可能对人类疾病产生影响。细胞—乃至组织、器官以及总的来说整个人体—发挥功能所必需的能量的约90%都是由线粒体提供的。
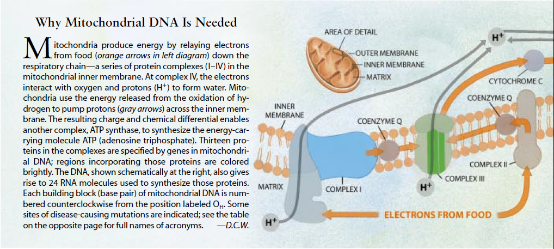
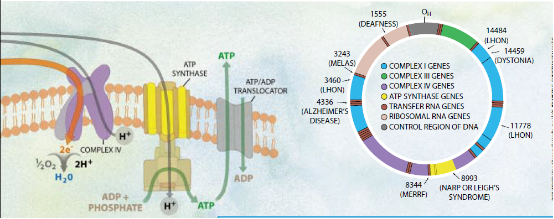
线粒体通过一个错综复杂的过程产生能量,该过程涉及电子循着一系列的蛋白质复合体(总称“呼吸链”)的传递。这种传递间接地使另一种复合体(即ATP合酶)能够合成ATP(即腺苷三磷酸)一运送能量的分子。
早先,逻辑联系说明,任何能够严重有损于线粒体的腺普三磷酸的产生的事物都有可能损害乃至杀灭细胞,从而使机体组织机能失常。并导致症状出现。事实上,早在1962年,罗尔夫·勒夫特及其在卡罗林斯卡(Karolinska)学院和斯德哥尔摩大学的合作研究者就曾报道说。线粒体的能量产生功能受损会引起一种致衰性疾病。最后,问题清楚了,最容易因细胞能量减低而受损的组织和器官是中枢神经系统,以下按敏感度高低依次是心脏、骨骼肌、肾脏和产生激素的组织。
最初,科学家们在核基因的突变上二寻找对线粒体疾病的解释、核基因中的一些导致产生线粒体的成分。然而,到80年代初期时,研究人员认识到,线粒体的DNA为许多重要的分子编码,它规定了成为ATP合酶亚单位的13种蛋白质(即氨基酸链)以及呼吸链复合体的结构,并且确定了有助于在线粒体中制造这些亚单位的24种RNA分子。上述这些发现意味着,能够破坏线粒体蛋白质或RNA的线粒体DNA突变有可能能够损害线粒体的能量产生能力并引起疾病。这一猜测后来得到1988年的那几篇报道的证实。
奇特的遗传法则
从1988年起,研究人员揭示了产生于线粒体DNA缺陷的多种综合征的几个显著特征。例如,上述综合征时常是遗传性的,尽管其遗传方式不同于产生于核基因突变的疾病。此外,线粒体DNA缺陷引起的综合征比核基因突变引起的疾病更加难以预料。
当然,众所周知的支配着核基因疾病遗传规律的生物学过程是从精子使卵子受精开始的。由这一结合形成的单细胞胚胎的最终结果是一个单核,它带有两组匹配的携载着基因的染色体,其中一组是来自母亲的约10万个基因(沿着约30亿个碱基对分布),而数量相等的另一组基因则是来自父亲。这个单细胞及其后代反复复制.以形成一个发育充分的胎儿。细胞分裂之前,先复制其染色体,这样它们才能把完整的一套父系染色体和母系染色体传给每一个子细胞。这样人体的每一个细胞一开始就带育相同的墓因乃至相同的突变。
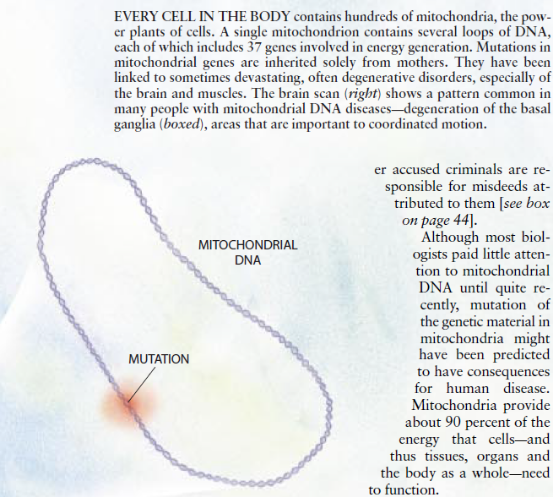
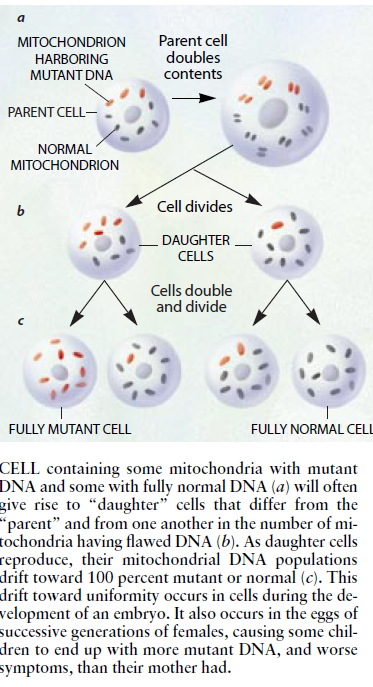
相反,每一个线粒体DNA环中沿16569个碱基对分布的基因则是通过母体(即其卵子中的线粒体)遗传的,而精子则没有持久的遗传作用。此外,每一个卵子以及体内所有共它细胞都带有数百个线粒体,每个线粒体则带有好几个线粒体DNA分子。尽管每个细胞在分裂之前都会使其线粒体以及线粒体DNA分子的数量增加大约1倍并将为其子细胞提供大约同等数量的线粒体和线粒体DNA分子,但最初的细胞则不会规定将哪些线粒体传给子细胞。
因此,若是受精卵的一部分线粒体DNA中带有一种突变(一种称为“异质体”的疾病),则一个子细胞就育可能继承较大比例的带有突变DNA的线粒体,而另一个子细胞则有可能继承较大比例的带有正常DNA的线粒体。按照概率律的原理,随着细胞继续繁殖。出现在子细胞中的线粒体DNA群体将向均匀性〔即同型异源性)变化,从而往住包含占压倒多数的正常分子或突变分子。
因此,山异质卵子产生的胎儿会有一些组织富含正常的线粒体DNA,同时也会有其它组织富含突变的线粒体DNAo此外,带有异质细胞的妇女的卵子其突变线粒体DNA所占比率可能不同,其子女的组织的突变分子的程度和分布以及他们显示出的症状的严重程度乃至性质也可能有显著的不同。然而,因同质突变而患病的不同个体都会显示出相似的症状。
疾病的显著特征
虽然会引起疾病的线粒体DNA缺陷时常是遗传性的。但这类缺陷有时也会自发地产生于卵子内或胚胎发育初期。和遗传性突变一样,后一类突变会随着胎儿的发育广泛分布在体内,在这种情况下,线粒体DIVA的突变有可能产生相当深远的影响。线粒体DNA的突变还会在人的整个一生中在组织中形成,有可能在不同的细胞中产生出不同的突变,甚至还有可能在同一个细胞中的不同线位体DNA分子上产生出不同的突变。这类突变称为”体细胞突变”。
体细胞突变的累积或许有助于解释在遗传性线粒体DNA疾病上时常观察到的两个特征。生来就带有线粒休DNA突变的人时常是在延迟了数年有时甚至是数十年之后才发病,并且其症状通常会随着时间的推移而日益严重。笔者及其同事提出,许多遗传性线拉体DNiA突变只是对线粒体的功能有细微的影响。这就使得体内各部位的组织至少新时能够产生所需要的能量。然而,在人的一生的进程中日益增加的随机的体细胞突支的累积,进一步降低能量的产量,直到最后一定的组织的能量产出降低到远低于继续发挥正常机能所需水平为止。到那时候,该组织的运作开始失常,各种症状开始出现。随着体细饱突变的进一步累积,细胞的能量产出继续降低,各种症状也日益加重。
实际上,遗传性休细胞突变的致病方式,看来不仅限于直接降低能量产量。随着呼吸链对能量产生的参与,称为“氧自由基”的有毒副产物也不断释放出来。这些氧的衍生物都带有一个未配对的电子,因而具有很强的反应性,能够杀伤细胞的所有各种组分,包括呼吸链蛋白质和线粒体DNA。任何阻碍电子流过呼吸链的物质都会提高其转移到氧分子的比率,从而促进自由基的产生。于是,单单一个突变大概就能激起电子传输受阻的反复出现,从而导致自由基产量和线粒体DNA突变不断增多。
通常,一种严重的线粒体DNA突变—严重抑制能量产生而在生命之初引起危及生命的疾病的突变一一最终将证明是异质的,也就是说,人们将发现,突变的基因与该基因的正常形式在患者的组织中共存。这一模式的原因在于,严重的同质突变(存在于所有组织中的一个待定的基因的各个拷贝中)会大大减低能量产量,以致在胎儿出生之前就造成了致命的后果;因而人们从未在患者身上见到这类突变。相反,严重的突变若是异质的,则突变的基因的正常拷贝有可能提供足够的能量,让患儿的生命维持到儿童期或更晚。较为轻微的疾病既可以由异质突变也可以由同质突变引起,这类突变只会使能量产量略有减低。
轻微的突变与严重的后果
在下文中,笔者将先描述由线粒体DNA的遗传性(或胎儿期)突变引起的病例。虽说这些疾病中几乎没有什么属于众所周知的常见病,但其研究已为线粒体DNA突变如何引起疾病提供了重要的见识。然后,笔者将就目前人们对下述诱人的可能性—遗传性体细胞线粒体DNA突变在衰老过程和常见老年病上起着重要作用—的认识作一番总结。
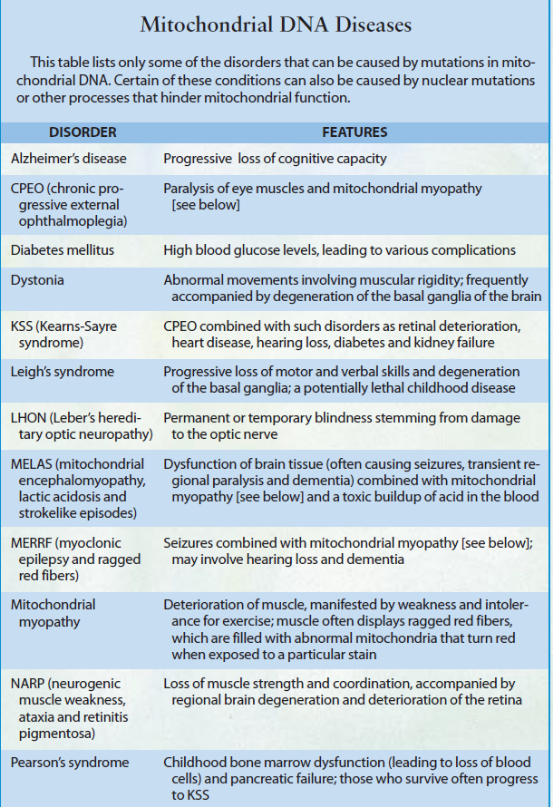
各种遗传性突变都是用一个单独的碱基对替换了编码蛋白质的基因中的另一个碱基对,从而使得一个不正确的氨基酸替换了被编码的蛋白质中的一个正确的氨基酸。一个这类“误义”突变显著说明了下述规律—异质线粒体DNA突变时常会以完全不同的方式在不同的人身上表达出来。这一突变一一对8993号位置的碱基的替换—会导致一个ATP合酶亚单位(产生ATP的复合体)中的一种氨基酸替换。
就一个有四代人可供研究的家庭而言,同一种突变会使其中的几个人患上视野外周轻度视网膜变性(即眼点视网膜炎),会使另一个人患上重度视网膜变性和中枢神经系统变性,还会使两个倒霉透顶的男孩患上可能致命的儿童期疾病—利氏综合征。这种毁灭性的重症的显著特征是基底神经节(大脑中对于协调运动很重要的一个部位)相当迅速的变性。显然,这一家庭内在症状上的差异在很大程度上应归因于患者组织内突变线粒体DNA分子所占比率的差异。那些突变线粒体DNA分子所占比率较高的家庭成员其ATP产量也较低,而其疾病的范围则较广。
某些遗传性碱基替换必须到达同型异源体后才能致病,这些突变会产生出更可预测的后果。如今人们已知道的作为大多数莱伯氏遗传性视神经病(即所谓的“LHON”)病例基础的遗传性缺陷即属于此类。LHON的症状最初是在视神经的中央区域停止发挥机能而导致视野中心视力丧失的情况下变得明显起来的。这一变化通常发生于成年初期,有三种线粒体DNA突变有损于呼吸链初级阶段的电子传递,这三种突变合起来引起全世界约90%的病例。带有两种突变中的任何一种的患者普遍患有永久性视力丧失,而那些带有第三种突变的患者则有时能恢复一些视力。
许多线粒体DNA具有的病理性碱基替换突变都会破坏RNA分子,而RNA分子则是线粒体用来构建蛋白质的机构的一部分,因而这些突变会同时干扰多种不同的线粒体蛋白质的合成,并有可能显著降低ATP的产量。由于这个原因,生来就带有这类所谓的蛋白质合成突变的患者最后会患上严重的多系统疾病,并且时常同时兼有中枢神经系统和肌肉两方面的异常。
笔者在本文开头曾提到那个在28岁时死于肾功能衰竭和感染的年轻人,该病例反映了蛋白质合成突变的潜在致死性。致其死亡的是一种点突变,即一种转移RNA分子的基因中的一个碱基缺失了。在正常情况下,这种RNA分子将氨基酸亮氨酸带给线粒体内正在合成的蛋白质。上述突变或许产生于其母亲的生殖细胞,因为其母亲的非生殖细胞(血细胞)的检查结果表明。其中仅含有正常的线粒体DNA。

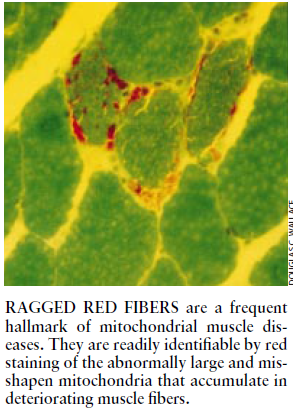
研究结果证明,上述同一基因的其它10种突变能引起一系列的重病。例如,其中3种突变会导致线粒体肌病,这种进行性肌肉衰弱症的特征是存在着破损红纤维,即退化变质的肌肉纤维中充满了畸形而有缺陷的线粒体。它们在接触到一种特定的染剂时会变成红色,其中两种遗传缺陷会引起心肌异常肥大和进行性变质(即肥大性心肌病)。其中5种突变会损害多个系统,引起一组总称为“MELAS "(线粒体脑视病、乳酸酸中毒及中风样发作)的症状,一种会引起MELAS的突变还会引起约占总病例数1.5%的糖尿病,并且甚至会在突变含量很低的情况下引起糖尿病。
尽管线粒体DNA的许多遗传性蛋白质合成突变会在患者很小时致其于死地,但有一些这类突变却是相对无害的,只是在垂暮之年才会表现出症状。在大约5%的患有晚年才起病的早老性痴呆症的欧洲人中,发现了上述突变的一个例子一一为一种转移RNA分子编码的一个基因发生的一种突变,这种RNA分子的职能是转运氨基酸—谷氨酞胺。
通过消去或复制大量遗传物质而同时影响多种基因的线粒体DNA突变也已被鉴别出来了和碱基替换一样,这些“重排”突变会引起严重程度各不相同的多种疾病。
大规模的DNA突变
在研究得最多的涉及重排突变的疾病中,有两种疾病的显著特征是眼肌麻痹和线粒体肌病,它们是慢性进行性外眼肌麻痹(通常在20岁以后发病)和基恩斯氏塞尔氏综合征(发病时间有可能比前者更早,病征可包括视网膜变性、心脏功能障碍、矮身材和各种其它的症状)。重排突变也是许多皮尔逊氏综合征病例的发病原因,患有这种病的儿童无法生成血细胞,很小的时候就要依赖于输血,并患有胰腺机能受损。若是患这种病的儿童得以幸存,则他们最终会患上眼肌麻痹及其它和基恩斯氏塞尔氏综合征有牵连的疾病。遗憾的是,患有上述疾病中任何一种的患者其病情都会随着时间的推移而日益严重,并且在许多情况下都会死于呼吸衰竭或其它系统性机能障碍。
患有上述病症中任何一种的患者其细胞可能含有混合的线粒体DNA分子,其中有些DNA的碱基有缺失,有些DNA的碱基又被复制了。然而,只有碱基缺失或许能够解释为何从一开始这些疾病就是重症。缺失碱基的DNA必然包括转移RNA分子的基因;读者将会记得,这意味着能量产生所必需的多种不同蛋白质即使真的产生出来了,也是以错误的方式产生出来的。上述疾病之所以会随着时间的推移而出现特有的恶化,据认为部分原因在于某些组织(即肌肉和由不分裂细胞构成的其它组织)有选择性地复制了不完善的(即“缺失的”)线粒体DNA。
虽说至今无人知道,为何缺失的线粒体DNA在不分裂的组织中会被有选择性地复制,但到目前为止,人们已提出了两种推测。其中之一认为,由于带有缺失碱基的分子比正常的DNA分子要小,其复制所花时何也较短,因而数量就大大增多了。第二种解释与肌纤维的内部构造有关。每条肌纤维都是由多个融合的肌细胞组成,因而也就含有多个细胞核。多方面的研究结果都意味着,当一个细胞核发觉其周围出现了能量欠缺(如由突变线粒体基因引起的)时,该细胞核就会通过激发起附近任何一个线粒体的复制来努力补偿能量欠缺。遗憾的是,这一反应恰好促进了引起局部能量欠缺的线粒体的复制,从而使得这一问题越来越严重。
一些时候以来,引起线粒体疾病的上述缺失的根源一直使科学家们感到困惑不解。虽然线粒体疾病可由一代传给另一代,但缺失的线粒体DNA本身却很少具有遗传性,这或许是因为所含多为缺失的线粒体DNA的细胞或胚胎总要死亡。这一问题的答案看来在于含有基因复制的线粒体DNA分子。这些分子含有产生能量所必需的所有各种基因,因而它们不会直接造成问题。然而,由于这些分子具有内在复制机能,它们可能经历的过程(可能是内配对和重组)最终会导致破坏性缺失。
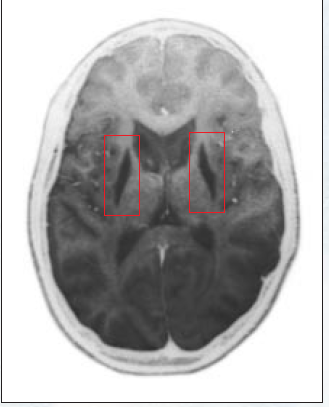
有时,遗传性线粒体DNA缺陷会引起早熟类型的疾病,这类疾病会在以后的年月困扰许多人,其中包括糖尿病,耳聋、心脏病、肌虚弱、运动障碍和痴呆等。此外,某些线粒体DNA突变己被证明会引起部分早老性痴呆症、肌张力障碍(一种进行性运动障碍)及其它神经变性疾病。这些摸式连同许多晚年变性疾病都与涉及能量产生的蛋白质复合体活性降低有联系(正如许多线粒体DNA疾病一样),这一事实意味着,神经、肌肉或其它组织的线粒体能量(ATP)产量的进行性降低有可能是促致衰老及各种与年龄有关的变性疾病的一个重要因素。
衰老及与年龄有关的疾病
即使是在生来就带有健康的线粒体和核基因的人中,有几个因素仍有可能使线粒体的能量产量随着年龄的增加而降低。长期接触某些环竣毒素是其中的一个因素。许多毒性最强的毒素都是通过抑制线粒体来危害于人的,另一个因素有可能是体细胞线粒体DNA突变的终生累积。
“衰老缘于线粒体”一说认为,随着我们生存和产生ATP,我们体内的线粒体也会产生出氧自由基,它们不仅会无情地杀伤我们的线粒体,同时还会使我们的线粒体DNA发生突变。就生来带有健康的线粒体基因的人而言。这种体细胞线粒体DNA突变的随机累积最终将会使一个或更多人体组织的能量产量降低到远低于维持健康所必需的水平,如果这人活到了足够的年龄的话。在这样做的过程中,体细胞突变和线粒体抑制有可能促致正常的衰老的常见征兆,如记忆力、听力、视力和精力的减退丧失之类。
就那些能量产量已受到减损(不管是由遗传性线粒体突变或核突变,还是由球藻毒素或其它因素引起的)的人而言,由此而产生的体细胞线粒体DNA受损将会使能量产量更加迅速地降低到必需的水平以下。这样.与那些能量产生能力最初未受到任何减损的人相比,这些人就会更早地显现衰老的征兆,并且会更加迅速地发展到重病阶段。
是否有证据能够说明,随着人的年龄的增大,能量产量会越来越低,而体细胞线粒体DNA突变则会越来越多?是的,确实如此。许多小组的研究结果都已证明,随着年龄的增大,至少一种(可能还有另一种)呼吸链复合体在大脑、骨骼肌、心脏和肝脏内的活性越来越低。此外,据发现许多组织尤其是大脑(以记忆和运动控制区最为显著)内的线粒体DNA的各种重排突变也是随着年龄的增大而越来越多。研究人员还得以证明,骨骼肌、心肌、皮肤和其它组织的线粒体DNA重排突变也是随着年龄的增大而越积越多。和遗传性线粒体DNA疾病有牵连的某些碱基替换突变可能也是随着人年龄的增大而越积越多。
所有上述研究报告都认为,虽说几乎没有什么突变能在34岁或40岁以前达到可测知的水平,但它们是在下述年龄之后是按指数律增加的。一些关于衰老的肌肉的研究把这种增加部分归因于已发生缺失的线粒体DNA的有选择性的增多。
提供支持的研究结果
对晚年患有慢性变性神经病和肌病的患者的组织的分析研究特果也为下述假说提供了支持—这些疾病中的一些可能同体细胞突变的累积有牵连。例如,亨廷顿舞蹈病患者会由于核DNA有一种特定的遗传性突变而丧失运动控制力,并会在晚年变痴呆。然而,与健康的同龄人相比,这类患者的脑部也会显现出较大程度的线粒体DNA缺失,这一迹象说明,患者的体细胞线粒体突变率提高了。核突变和体细胞突变很有可能联合起来抑制了脑细胞的能量产量而在成年期引起各种症状。
正如笔者在上文指出的那样.一定数量的早老性痴呆症病例也已被归因于先天性线粒体DNA突变。然而上述这些突变没有引起直接的症状这一点意味着,光靠它们自身可能并不足以引起疾病。使遗传性突变的致病效应雪上加霜的后天性线粒体突变可能又是一个缺少的
环节。事实上,早老性痴呆症患者的脑组织线粒体DNA体细胞突变量看来高得异乎寻常。
一个特别令人感兴趣的可能性是,困扰着数百万4U岁以上美国人的B型(即成年期发作的〕糖尿病中,有很大一部分的病根在于仍待发现的遗传性线粒体DNA缺陷。这种类型的糖尿病患者虽说还有胰岛素分泌到血流中,但其量却不足以满足机体所需。众所周知.糖尿病有家族遗传性,并双亲中时常是母亲患病(正如同线粒体DNA的遗传途径一样)。此外,研究结果已经确证,已知的线粒体DNA重排和碱基替换突变时常会引起B型糖尿病。显然其它一些突变可能也会产生同样的后果。一种似乎可能的引起糖尿病的机制是,通过减少ATP的合成,线粒体DNA突变使产生胰岛素的细胞得不到适当地分泌胰岛素所必需的能量。
另一种令人感兴趣的假说认为,体细胞线粒体DNA突变的产生加快了动脉粥样硬化患者的心力衰竭。随着被动脉粥样硬化班块部分闭塞的动脉的缩窄,动脉会暂时阻塞而阻断流向心脏的血流,并使心肌缺氧,这种状态称为“局都缺血”。没有氧,呼吸链就会停止运作,反而在血流和氧返回(重新灌注)心脏时进发出一阵氧诌由基.据料,这种迸发会损坏心肌中的线粒体DNA,并会抑制用于收缩的ATP。心脏已因慢性局部缺血和重新灌注而膨大的患者显现出高度的线粒体DNA受损,这和上文所说的情况是一致的。
对啮齿动物的多项研究支持下述猜测:线粒体DNA突变的加速累积会加快衰老进程。摄食受到限制的动物无论保持健康的状态还是存活的时间都比自由取食的动物要长(参见本刊1996年5月号Richard Weindrach所撰“摄食热量限制与衰老”一文〕。寿命长而摄食受到限制的动物所产生的氧自由基较少,所累积的线粒体DNA损害也比自由摄食的同胎动物要少。有待完成的工作
若是自由基损害确定加剧了体细胞线粒体DNA突变而影响了衰老的速度,那么,阻止线粒体产生自由基从而保护线粒体DNA的治疗就有可能减缓衰老业延迟与年老有,关的疾病的发作。这类治疗或许包括终生的防氧化剂治疗(例如,辅酸Q或维生素C或E治疗)。这方面的谈物研究结果鼓舞人心。
另一种减缓衰老的办法想必是抑制肌肉和其它组织中突变线粒体DNA的增加。为了达到这一目的,研究人员正在努力弄清上述分子敲相互作用,而细胞核就是通过这科相互作用察觉局部能量欠缺和促进其附近的异常线粒体的复制的。
10年以前,几乎没有生物学家想象得到,线粒体DNA的突变不仅同数十种神秘的疾病有牵连。同时和衰老以及各种各样的慢性变性疾病也有关系。如今。对线粒体DNA的研究不仅正在为多种疾病的产生机制提供新的线索,而且更加可贵的是,正在带来治疗这些疾病乃至防止其发展的新方法。若是事实证明,人们对线粒体DNA突变在衰老和患病上所起作用的推测是正确无误的,那么对线粒体生物学的进一步研究应有巨大的潜力来减除许许多多的人类病痛。
用作法庭依据的线粒体DNA
D. C. W
1996年9月3日。在美国田纳西州的查塔努加一名27岁的男子被发现犯有杀害一个四岁女孩的罪行,证明他有罪的主要依据是通过分析发现他的唾液的线粒体DNA和在其受害者身上发现的毛发的线粒体DNA一致。这是线粒体DNA被允许作为法庭证据的第一个案例。线粒体DNA检验正在越来越多地应用于死者姓名和遗骨的查找核对。例如美国正在主办一项计划,其目的在于鉴别早已死于五十年代初朝鲜战争的士兵遗骨的身份。此外,线粒体DNA检验结果不仅证明了1991年在俄罗斯发现的遗骨属于沙皇尼古拉二世本人,还证明了1882年4月以杰西·詹姆斯的名义埋葬的那个死者事实上正是那个众所传闻的匪徒。(因此其余各个声称是詹姆斯的人就全是骗人的。)
科学家通过对比线粒体DNA分子(尤其是没有基因的控制区)中的碱基对顺序来进行这类检验。控制区的顺序通常有几个位置因人而异。如果比方说在谋杀案受害者或强奸案受害者身上发现的毛发的D NA与被控嫌疑人的DNA没有什么差别,那么该毛发就十之八九是受控嫌疑人的。同样,若是在战争中失踪的士兵遗骨的线粒体DNA与其同胞兄弟姐妹的DNA很接近.那么就可以得出结论:该遗骨属于一个失踪的亲属。
在能够获得足够的核DNA的情况下,人们仍然宁愿选择核DNA对比因为这样更容易找出明显的相似之处和差异。然而,可利用的组织(如一根头发、一块骨骼或一枚牙齿)时常缺乏合用的核DNA,却含有大量线粒体DNA。
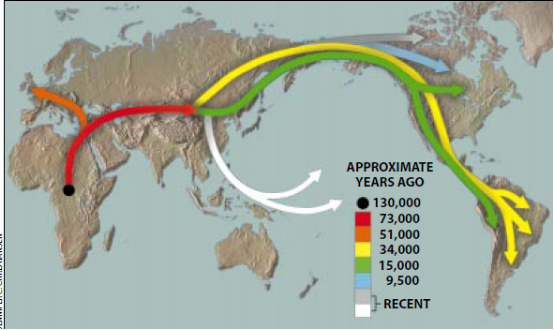
线粒体DNA揭示的人类迁徙过程
对世界各地的人类线粒体DNA分子的对比分析使得遗传学家能够勾画出解剖结构上的现代人的几次大迁徙的概况。由许多家实验室进行的上述对比分析还给各个大陆的人类种群所处的时代标出了大致的年代,尽管不同的研究小组倾向于不同的年代(这是由推算方法不同造成的)。
根据笔者实验室的数据推算出来的时间表意味着,大约距今13万年时,古人(Homo sapiens)在非洲出现。大约距今7.3万年时,最初的一次走出非
洲的迁徙把人类带到了亚洲(红色箭头所示〕。大约距今5.1万年时,另一批人类离开中东,最后在欧洲拓居〔橙色箭头所示)。
始于亚洲的几次迁徙浪潮把早期现代人带到了美洲。大约距今3.4万年时,一些漫游者穿过西伯利亚和阿拉斯加.随后往下穿过北美洲和中美洲,到达了南美洲〔黄色箭头所示)。这些人就是现代的古印第安人的祖先,他们分别是亚利桑那州的皮马人、墨西哥的玛雅人,以及委内瑞拉的约诺玛米人(Yonomami)。大约距今1.5万年以前,始于亚洲的第二次移民浪潮绕过西伯利亚内地,在到达阿拉斯加之前可能是紧靠着海岸行走。然后在南、北美洲分散开来(绿色箭头所示)。他们同原有的人类种群融合在一起.从而产生出现代的说美洲印第安语的古印第安人。
大约距今9500年以前,一次始于西伯利亚的迁徙将纳一德内(Na一Den)语族(说该语族语言的人包括加拿大西北和阿拉斯加的阿塔帕斯坎部族(如多格里布人)和美国西南部的阿帕切人及纳瓦霍人)的创始人带到了北美洲(蓝色箭头所示)。将爱斯基摩人和阿留申人带到北美洲的迁徙(灰色箭头所示)以及将岛民带到太平洋地区的迁徙(白色箭头所示)距今时间更近,但尚未根据线粒体DNA的数据准确地确定出年代。
全球迁徙史之所以能够通过线粒体DNA的比较分析重构出来,是因为随着妇女从一个大陆迁徙到另一个大陆,她们的线粒体DNA的非致病性突变也会一个接一个地逐步累积起来。因此,一个大陆的线粒体DNA碱基对顺序最终就会显然不同于另一个大陆的线粒体DNA碱基对顺序。把一个大陆的相关的碱基对顺序分为可识别的“单组”(haplogroups),再对各个不同大陆的单组进行对比,就能确定不同地方的妇女的亲缘远近。此外,还能确定哪些地区最先有人拓居,这是因为一个大陆的线粒体DNA碱基对顺序的差异越大.就表明有人拓居的历史越悠久。据知,非洲的人类种群历史最长久,因为他们的线粒体DNA差异最大,亚洲人、欧洲人及各个美洲土著种群的线粒体DNA差异则依次越来越小。
然而.各个大陆有人拓居的确切时间却只能估计.这是因为时间的早晚取决于线粒体DNA分子的突变累积率。这一比率相当稳定,但人们对它的认识并不准确。线粒体DNA的突变看来是大约每隔2000年到3001〕年发生一次。本图所提供的各个年代是按突变速率大致为上述范围的中间值这一假设推算出来的。
除了揭示全人类的环球迁徙模式之外,线粒体DNA的比较分析结果还意味着,早期古人取代了在其新家园遇到的所有各种更为原始的人种(如尼安德特人),不过一些人类学家对此结论还有争议,他们认为,古人的人科祖先是100多万年以前出现在非洲的,然后,他们在整个东半球成扇状分散开来,并分别在各个地区进化成古人的各主要人种。
〔参见本刊1992年B月号“学术争论:现代人类起源于何处”专栏的文章〕
〔张牛 译 郭凯声 校〕
请 登录 发表评论