建造进入细胞的门
Bayley H*
细胞外膜的作用比只是内部盛物质的容器所起的作用要大——它起分子门卫的作用。细心地调节着什么东两该流进什么东西该流出。营养物质和其它需要的化合物放行人内:不需要的分子被拒之门外:而废物则从细胞排出。然而。在物种之问的永无休止的战争中,病原细菌已形成了一种能彻底攻破细胞的防御系统并破坏进出平衡的能力。
战斗中所用的武器山病原菌释放的、钻孔进人细胞膜的蛋白质分子组成,这种细胞膜允许外来物质冲进和某些细胞内容物泄出。有趣的是,人类避开了许多以相似武器展开的这些攻击:免疫系统还利用了它自己所谓的成孔蛋白质的性质击破坏外束细胞。
在我的研究小组中。我们正在研究的不仅是这些蛋白质如何起作用的基础科学,而还研究它们在生物技术和医学上的潜在应用。理论上,我们希望派遣我们自己设计的分子守门人。用这种方式。我们能用会损伤细胞外膜,使它们对化疗更敏感的蛋白质去轰击癌细胞。或者我们能创造包埋在它们内部、有人造孔隙的合成膜以起生物传感器种药物传递剂的作用。
细菌的成孔蛋白质显示出一系列的特征。我将在本文中讨论的蛋白质α-溶血素是普通细菌金黄色葡萄球菌分泌的。该细菌可引起葡萄球菌感染。这种蛋白质通过形成直径约为2纳米的孔一一足可供如蔗糖这样的小分子通过。但包括大多数蛋白质这类大分子来说又太小——而攻击靶细胞。相反,来自链球菌的链球菌溶血素一O能够作成直径越过3O纳米的孔。如象α-溶血素那样,链球菌溶血素一O通过刺破细胞膜而引起细胞受到损伤或死亡。
称作S-层(S—layer)蛋白的另一种蛋白质能提供一种对细菌的防御性外膜;它形成带有许多开口(尺寸大致均匀的)的平片,其开口宽度为2至6纳米之问,这取决丁细菌的种类。这些平面上的孔允许选择的营养物质到达细胞膜以运人细胞。
钟形孔
在我的研究中。因几种理由我已选择研究蛋白质α-溶血素。它只通过细菌培养而大量产生(如需要可生产几克):结构很小,只有293个氨基酸结构单元,使它通过重组DNA技术可直接改变。而且,其它蛋白质相比其分子是极为稳定的,编码蛋白质的这种基因的结构系当时在Biogen公司 J Gary S。Gray和当时在I1内瓦大学的Michael Kohoc于1984年所发丧。儿是在1996年。现在在哥伦比亚太学的J.Eric Gouaux以及他的研究小组才测定r这种α-溶血素孔的三维结构,证明了它以7个α-溶血素分子的钟形复合物的形式存在[见图3左h部的插图]。
德国迈因茨大学Sucharit Bhakdi的研究小组所作的研究表明,α-溶血素可能以两种方式组合成孔隙。某些细胞(如兔的红血球)在其表面有α-溶血素结合的特殊受体;这些受体可以激发孔隙形成或有助于把此溶血素结构确地定位在细胞膜I。然而很方便地,甚至在缺乏这种受体时。α-溶血素分子也仍能发挥其功能;在人造膜(由称作类脂的两层分子作成)I,这种蛋白质自己组织(即自组台)成孔隙。当同某些实验室的与普通去污剂有关的化学物质混台时,这种蛋白质也将图像组合。白组台为寻求基丁α-溶血素制造J品的生物技
“有缺损“
因为它允许用其它自然发生的氨基酸乃至用实验室制造的非自然氨基酸置换蛋白质中的氨基酸。因此我们能够在α-溶血素中加入许多潜在的触发剂和开关,并探索哪一种会起作用。
原则上,分子开关可以是生化物质(酶活化的)或化学物质(被小分子与该蛋白质结合所活化)。用如加热或光照这样的物理刺激引起活化是另一种可能性。正如已经证明的那样,所有三种方法对Ⅸα-溶血素都是成功的。
在马萨诸塞州什鲁斯伯里市乌斯特实验生物基础研究所(我在那里开始这项研究)的BarbaraJ。Walker的帮助下,我已把生化触发剂引入α-溶血素中,第一次我把小的多融链——11至53个氨基酸——加人一般能穿透细胞膜的蛋白质之中心束。这种附加的断片封闭了孔隙的开口:接着用称作蛋白酶的一种酶处理蛋白质,剪掉这附加的部分,而使孔隙形成。
生化触发剂可能被用来制造只穿透选择的细胞之α-溶血素。例如,经专门改进的溶血素,在那些被遗传工程安置在蛋白质结构内的抗体断片(被选择用来识别癌细胞)帮助下可被引向一个肿瘤。当这些杂交的蛋白质到达癌细胞时,被癌细胞释放的蛋白酶能够活化孔隙的形成。(转移的癌细胞分泌一种称作肿瘤蛋白酶的酶,它帮助细胞从原发肿瘤中逃逸出和帮助细胞在新地点定殖。)这种改变了的溶血素会开始把孔钻人癌细胞中,因而增加它们的穿透性,此后也增强对各种细胞毒性药物的敏感性。作为这个范围的一个步骤,我的研究小组的Rekha G.Panchal创造了一种被肿瘤蛋白酶活化的突变α-溶血素。
最终,或许可能插入一个生化开关。它能起动和终止孔隙形成活性,而不只是起动它。位于伯明翰市亚拉巴马大学的DanW.Urry利用磷酸化反应在酶的帮助下改变了合成蛋白质的形状,然后把它恢复到它原来的构型。我们已开始采纳Urry的方法以产生能使我们反复开、关α-溶血素孔隙的生化开关。
化学触发剂
我们也已把第二种触发剂引、被某些小的、高反应性分子活化的α-溶血素的结构中。我们相信这种技术能够适应于生产用于生物传感器中的灵敏的人造膜,而这种生物传感器是用来检测包括杀虫剂和神经毒气在内的有毒分子的。我的实验室里的研究人员已设计出了Ⅸα-溶血素的突变体,它包埋于脂质体(由类脂双分子层膜作成的微型囊)的表面内,而且当一种高反应性有机化合物永久附着到该结构的遗传工程区域时装配人一个开孔。这种沟渠的开启能够以通过孔隙释放的荧光染料(在组合时放人脂质体内的)来进行检测。
我们还开发了一种可通过金属离子与这种蛋白质结合而能重复开启和关闭的化学开关。这样一种开关对于用生物传感器进行重复测量是有用的。用组氨酸的5个拷贝置换蛋白质中心束上5个各种各样的氨基酸产生了锌和其它金属离子能与蛋白质结合的位点,因而能阻止孔隙的形成。当金属离子被移除肘,孔隙的组合继续进行。一旦洞打开,该离子由于与中心沟渠相结合并阻碍其它分子通过而能再次封闭孔隙。封闭和再封闭过程可以无数次重复进行。
这种所谓的H5结构(5个组氨酸的简写)以及与我的伍斯特研究小组的Walker和Stephen Cheley建立的溶血素相关的其它结构作为监测金属污染物的高反应性生物传感器可能是有效的。事实上,我们一直在与国家标准和技术研究所的John J—Kasianowicz合作开发这种装置。美国海军对快速和连续测定海水中的金属离子也非常感兴趣一一它希望设计能检测从敌舰浸出来的痕量金属的追踪系统——因而海军研究局已资助了我们这方面的研究。
蛋白质工程技术的新进展和α-溶血素结构方面的新信息已使我的实验室的Orit Braha及她的同事通过制造并非全部亚单元都是一致的孔隙来对H5分子加以改进。在一个例子中,6个亚单元未被改变,而1个亚单元含有金属离子能结合的位点。当这金属离子结合肘,电流(应用一个电位场通过孔隙送出的)就改变。这种电流的波动给出了所存在离子的浓度和本性。特别是,来自一个孔隙的脉动信号能够被用来同时测量几种金属;一系列的传感器能处理物质的复杂混合物。这些传感器的另一个优点是它们的尺寸:因为只在一个孔隙上结合就足以获得电流读数,所以这些传感器可以是极小的。
可对成孔蛋白质作数千种(如果不是数百万种)不同的改变,会产生异常多系列的电位生物传感器。我们目前也正在开发非金属物质的传感器。Kasianowicz及其同事最近已证明,当如DNA这样的单束大分子通过孔隙移动时,它们也能被检测出来。
用H5所得出的研究结果提供了生物技术和基础科学之间相互作用的实例。这种结构不仅提供了传感器的原型成分,而且也揭示了关于孔隙如何发挥功能的信息:用H5进行研究有助于证明,天然蛋白质的中心束衬在孔隙的内部。
光学开关
在考虑设计能被第三种开关一一物理刺激一一活化的←溶血素时,我注意到,有天然发生的膜泊攘,它们能被机械脉冲或加于整个细胞壁的电压进行物理活化。但是存大多数情况下,以光进行活化是具吸引的选择:光不干扰许多天然过程。而它能用于灵敏的空间控制和瞬时控制。
此外,我从1974年至1979年存哈佛大学Jcrcmy R.KnowlcsA实验率作为研究生而度过这段时闭的。该实验室是开发研究朋于研究膜蛋白质结构的光敏化学物质。凶此,当间隔多年之后。光化学和膜蛋白质存我的研究小组中被再次结合时(但有完全不同的重点)我并不感到吃惊。
我们的方法基于砷基苯化合物的光敏结构,这种化合物被当时存牛津大学的Jack A.Barltrop于六十年代首次丁有机合成,而且后来被当时≠E耶鲁大学的Jack H.Kaplan及其同事应用于小生物分子。我们开发的叫作溴硝基米己酸(BNPA)的溴基苯衍生物存蛋白质结合后将停止孔隙形成过程。
为了实现这一目标。我的研究小组的研究人员存蛋白质的关键位点首次引入了一个半胱氨酸。当此半胱氨酸与BNPA反应时。此蛋白变为无活性的。把这种蛋白质暴露丁紫外光照射——其波长之对大多数细胞几乎无损伤——它的活性可以再生。最终。研究人员或许可能制造出能够被某一波长的光开启而被另一波长的光关闭的成孔分子。他们也可能制造出混合开关,在其中蛋白质能被光开启。而被金属离子关闭。
但是。目前的技术直接用于实验牢:研究人员往往必须使组织样品中被选择的细胞成为多孔的。而同时又不改变细胞的其它任何特性。按照这种方式。可以引进探测细胞活性的小分子,而关键性蛋白质仍保留存内。存我的实验窜里。通过把光照射到选定的细胞上我们已能使神经元收集品中的单个神经元成为可渗透的。暴露存光照下的工程溶血素穿透选择的神经元:其余的神经元则没有被触动。使复杂的光学装置,将有可能使H受光照射的细胞的一个区域内的神经元成为可渗透的。
成孔蛋白质最令人振奋的应用之一是药物的传送。例如。药物能够存脂质体内被输送。而在儿前所提到的任何触发技术的帮助下根据指令而释放的药物通过人造孔隙移植到膜中。此外,生物药物研究人员对用胶囊包封酶乃至包封整个细胞抱有很大的兴趣,因为这种包封可使酶免受患者免疫系统的攻击。一旦酶穿梭到理想的位置,它们能够被用束破坏存某些有遗传失调(如苯酮尿症,即身体不能适当地代写苯丙氨基酸)的人体内J生的有毒物质。那种疾病可最终导致神经细胞损伤。
胶囊包封的细胞可以被来传送如依赖胰岛素的糖尿病这类患者所缺乏的激素。具有人造孔隙的膜内之药物、酶和细胞将对药物传送的去向、时闭和数量提供一个控制值,这会明显改善现有的技术。
有完全不同性质的其它细菌成孔蛋白质——包括链球菌溶血素-O和S-层蛋白——在我们的实验室和其它地方也正在被改造。维也纳农科大学的UweSleytr 其同事已经在过滤装置中采用了S一层蛋白形成的、天然发生的孔片。博尔德市科罗拉多大学的KenDou。glas和Noel A.Clark以及波士顿大学的Kenneth J.Rothschild柏研究中这些平片也起模扳的作用以便由金属蒸气沉淀形成纳米级的栅格。
在我的实验室中,我们试图把触发剂和开关加入设计的孔隙中——只是松散地建立在天然结构上的多肽一正如加利捅尼亚大学圣迭戈分校的Maurice Mental及其合作研究者所开拓的那样例如,根据α-溶血素结构设计的蛋白质可能有附加的用途,如果它们能被作成选择性破坏微生物的外膜则可作为抗微生物剂。
在整个α-溶血素的蛋白质工程本身尚有许多工作要做。例如,我们目前正在研究改进α-溶血素孔隙(用作生物传感器元件的)的机械稳定性和热稳定性的技术。研究人员也正在研究化学改性以减少α-溶血素的免疫原性一它的引起免疫系统攻击的趋势——做微生物疗法之用;免疫原性现在作为所有生物疗法的主要障碍而存在。
如果这些困难够解决。这种技术能会具有更多的未来可能性。成孔蛋白质可能在分子电子装置中用作导电元件。虽然按照现今的标准蛋白质对于这种作用来说是相对较大。但它们的确具有复杂的特性。如能识别其它分子,这是不能掺人无机材料内的能力。α-溶血素和S一层蛋白质容易形成的二维晶体在正在形成的纳米技术中可能起有序排列分子的模扳作用。甚至可能设计其允许某些分子通过的膜。而可用来形成高选择性滤器。以纯化如药物、污染的水或血液这样的物质。成孔蛋白质领域只是才开始开辟。
图1人应孔隙能穿过细胞膜或山两层脂肪(即类脐)组成的人选膜。山改进的细菌蛋白质浴血浓的变体形成的这仲i句来能够被设计用来控制药物或其他分子通道。

图2由许多蛋白质作成的微型孔隙。作者已研究了一般能形成大约直径为2纳米的孔口的α-溶血素衍生物。可是某些变体其直径可能长到6纳米(a)。蛋白质链球菌溶血素一O能够作成宽度超过30纳米的孔(b)。第三种蛋白质S一层蛋白形成均匀尺寸的孔片:c图中所示的孔径约3纳米。
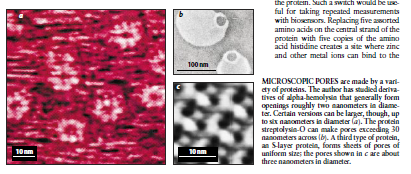
图3当单个α-溶血素分子(a)附着到膜的表面(b)时部分成为一个洞。一旦7个分子会聚(c)在每个亚单位中心的氨基酸薄束钻洞进入膜中形成沟渠(d)。这种钟形孔隙的三维结构只是最近才用x-射线衍射晶体分析法测定的(左端困);每种颜色代表不同的α-溶血素亚单元。
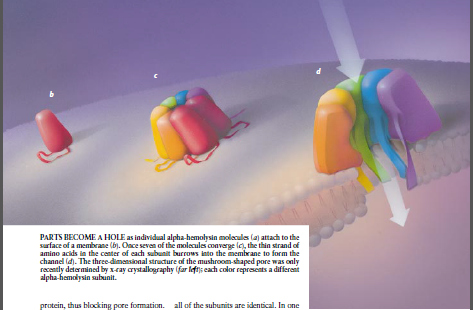
图4穿刺癌细胞将使它们对细胞毒素药物更容易渗透。研究人员正在开发α-溶血素的一个变体。其中包括能识别癌细胞上受体和防止孔形成的抗体断片。当改变了的溶血素到达癌胞时。肿瘤蛋白酶——所有肿瘤分泌的蛋白质——将剪去抗体断片(a)。在7个蛋白质亚单元会聚后(b)孔口就开启(c)。
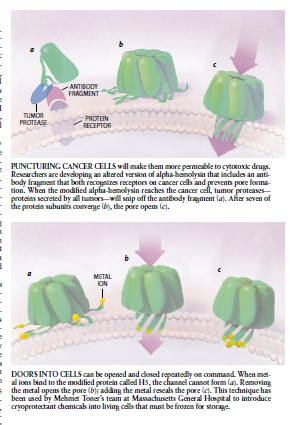
图5进入胞的门可根据指令重复打开和关闭。当金属离子与叫作H5的改变了的蛋白质结合时。沟渠不能形成(a)。除去这金属可打开孔口(b);加入金属可再次封闭空口。(c)马萨诸塞总医院Mehmet Toner的研究小组用这种方法把冷冻保护化学剂引入必须被冷冻贮藏的活细胞中。
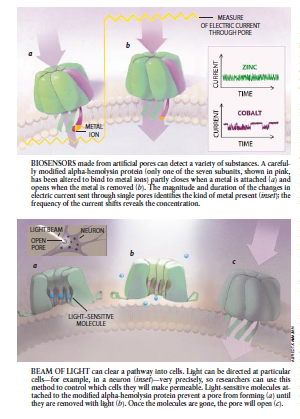
图6 由人造孔作成的生物传感器能够检测许多物质,仔细改性的α-血素蛋白(只是2个亚单元中以紫色所示的-个已被改变为可与金属离子结合的),当金属被附着时部,分快朗(á),再当金属除去时部分开启(b)。通过单孔送出的电流变化的幅度和持续时间可鉴定所存在金属值种类(插图);电流变化的频率可揭示其浓度。
图7光束能消除进人细胞的通道。光能够被非常精确地引向特殊的细胞——例如一个神经元(插图),所以研究人员能用这种方法控制那些细胞使之成为可渗透。附着到改进的一溶血索蛋白质的光敏分予阻止形成孔隙(a)直到它们被光除去时为止(b)。一旦该分子被消除,孔隙将开通(c)。
请 登录 发表评论