干细胞面临的挑战
撰文/Robert Lanza和Nadia Rosenthal
干细胞技术唤起了人们的期望:重新生成体内衰竭的组织和器官以及治疗迄今为止基于药物治疗效果不好的疾病。虽然有关干细胞神奇特性的众多报道使患者受到鼓舞,但许多著名的科学研究结果在发表后受到质疑,其他的研究资料也在关于从人类胚胎获得干细胞的性质的争议中发生了扭曲。
种种争议和相互矛盾的主张已经引起大众(包括众多科学家)的困惑。干细胞疗法在医学上是否可行?如果美国和其他国家立即解除法律和资助的禁令,那么明天医生就能用干细胞治疗患者吗?可能性很小!只有克服众多技术障碍、弄清许多未解之谜,干细胞疗法才能安全地实现其愿景。例如,仅鉴定真正的干细胞就是一项棘手的工作,科学家在能够判断调控干细胞的多项技术的可靠性并分享实验结果之前,必须要知晓所研究的细胞不仅具有作为各种类型细胞源头或主干的能力,而且它们本身还要有分裂潜能。对所有干细胞的深入研究表明,各种干细胞在形态上类似,只能根据其生物学行为加以认定。
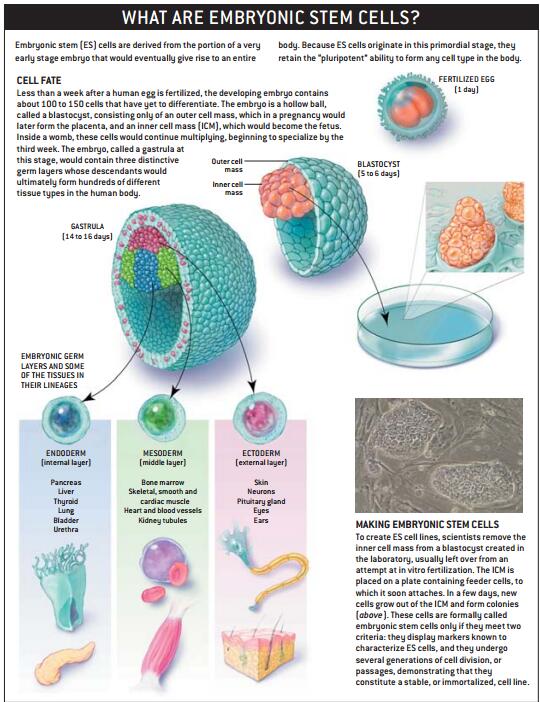
20多年前首次从小鼠分离成功的胚胎干细胞(ES)是最全能的,早期胚胎某种结构的细胞在正常情况下可发育、分化成具有三个不同的生殖细胞S的晚期胚胎[参见63页图文],并最终终分化成体内所有种类的细胞,ES细胞就是从内细胞团获得的。这些细胞拥有生成体内任何种类细胞的能力,故称为多能细胞。
世界上多数现存的ES系,是从制备试管婴儿的未使用胚胎获得的。这些细胞的研究人员发现,它们通常是作冻溶之后被获取,在离体培养皿中分化成不同种类的细胞。但研究人员也逐渐明白,不是所有的人的ES细胞系都是相同的。
寻求ES细胞系的谱系
某心ES细胞系仅分化生成特定类型细胞,另外一些在体外培养生长缓慢。在研究中,为确保在使用这些细胞之前确定其多能性,两种在非人类ES研究中广泛使用的检测方法,已在美国和加拿大生物专家组成的小组提议下应用到人类ES的研究中,以期建立人类ES实验研究的标准。一是将人类ES细胞注人到动物体内,若形成的畸胎瘤(一种特殊的肿瘤)含有三个胚层所有种类的细胞,即可证实这些细胞具有多能性;第二种认定ES细胞的方法是标记这些细胞,然后将其注入到发育中的动物胚胎,当动物出生后,若标记的细胞出现在动物所有组织中,也可认定这些细胞是多能的。但应注意,这种检测人类胚胎干细胞的方法,将会产生体内所有组织中都含有人类DNA的杂合动物,而这样做将会产生伦理方面的纷争。更糟的是,即使通过了这种检测,也不能确保这些细胞在实验室中就能够分化增殖。
缺乏更可靠的辨别多能ES细胞的标记物的现实,激发了广泛的努力,以便在离体培养ES细胞的不同时间段,通过对众多基因农达的启动或关闭,来对基因进行分类。这样获得的基因表达谱不仅提供一种鉴定多能干细胞的方法,还可深入了解细胞千细胞谱系的特点。不幸的是,到目前为止,ES细胞的基因表达谱的研究结果还处在互相矛盾之中,因此寻找清晰的ES细胞标志物的工作正在继续进行。
显然,干细胞研究的目标是替代或再生成机体衰竭的组织器官,如糖尿病患者胰腺分泌胰岛素的细胞,帕金森综合症合成多巴胺的神经元。但诱导ES细胞分化成人们希望的细胞类型的技术仍有很大的缺陷。
置于培养皿中的ES细胞依靠自身的功能装置,自发地分化成各种组织的混合体。但在不同的时间加人不同化学物质,我们常常可诱导它们生成某种或其他种类的细胞,但他们似乎更易生成某些特定组织,例如迅速增殖生成可搏动的心脏细胞组织团块,但生成其他组织却相当困难。
促使干细胞发挥作用
因为我们对在胚胎发育过程中经常指导ES细胞选择待定分化通路的信号分子缺乏认识,许多研究者正在研究正常胚胎的微环境,以搞清可能的环境因素的作用。某些科学家试图绘制ES细胞分化时的基因表达谱,这些基因的表达或关闭可指导ES分化成特殊的组织类型。
但即使获得了似乎是人们想得到的那种细胞,也仅仅成功了一半。例如,ES细胞很容易在培养皿中生长出大量的神经元,但只有植入活体的大脑内,与周围的神经元建立联系并能相5交流信息.这此细胞才真正发挥了作用。2001年美_国家卫生研究院(NIH)的McKay,从小鼠ES细胞制备出含成胰岛素的细胞,这是干细胞研究渴望达到的目标,被一些干细胞研究人员认为是重大突破。但到了2003年,美国哈佛大学的A Melton重复McKay的实验,发现这些细胞本身并未产生胰岛素,而仅仅是从培养液中摄取了胰岛素而已。因此,找到能鉴定有真正功能的细胞的标记物,是干细胞研究领域的另--项迫切任务。
如果能简单地将干细胞注射到我们希望再生的组织和器官,让它们从周围环境中获得生长增殖所需要的信息,当然是最理想的方式。然而对干细胞疗法,这也是一种非常危险的方法,这些细胞可以形成畸胎瘤,或者你不想得到组织类别,或者两种情况都会发生。由干细胞生成的含有成型牙齿的畸胎瘤在动物实验中已有报道。
为避免ES细胞直接注射到患者的脑或心脏却意外地形成肿瘤或牙齿,就要千方百计地让它们生成托有特定功能的组织。许多干细胞研究者力求找到一条折衷的路线,在注射之前,诱导ES细胞分化到稳定但仍具有可塑性的前体细胞阶段。这样,就既避免了ES细胞的失控分化,又可利用环境中的有利因素来生成想要的细胞类型。
即使这些前体细胞适应了它们所处的环境并开始生成新的组织,它们仍会与器官移植一样受到患者身体的攻击。ES细胞也携带表面蛋白或抗原,免疫系统借助这些蛋白可识别它们并加以攻击。不同类型的抗原可能组合成许多复合物,这意味着可能需要构建由上万种ES细胞系组成的细胞文库,来与众多潜在的患者群的免疫系统相匹配。要创建如此庞大的细胞系,可能需要几百万个试管婴儿诊所弃用的胚胎。
一些研究者认为,不需要如此庞大的细胞文库,因为可以通过使患者对ES细胞或者诱导分化的细胞脱敏,或减低细胞本身的抗原性,以避免排斥反应,但这些精巧的技术尚有待于最后证实。目前用患者自身的遗传物质通过核转移或克隆技术,创建一个ES细胞系,是唯一可行的回避排斥反应的方法。但这些技术已激起相当大的争论,其技术本身也有众多的实际障碍有待于克服,但在再生功能衰竭组织的动物实验中,都取得了令人鼓舞的结果。
让细胞走回头路
克隆可看作是将胚胎的潜能返还给患者成年细胞的一种方法。人和哺乳动物是由200多种细胞构成的,一个细胞一旦发育成某一特定种类,在正常情况下不会走回头路。这就是所谓的终末分化。但也有例外,将未受精卵子的细胞核吸出,将体细胞核植入,经这样处理的卵子的生物学行为就如同受精卵一样,像正常胚胎一样开始分裂。从这种胚胎得到的ES细胞将含有供体细胞的DNA,这种体细胞内将重新排定分化程序——回复到干细胞状态,能够生成任何组织类型的细胞。
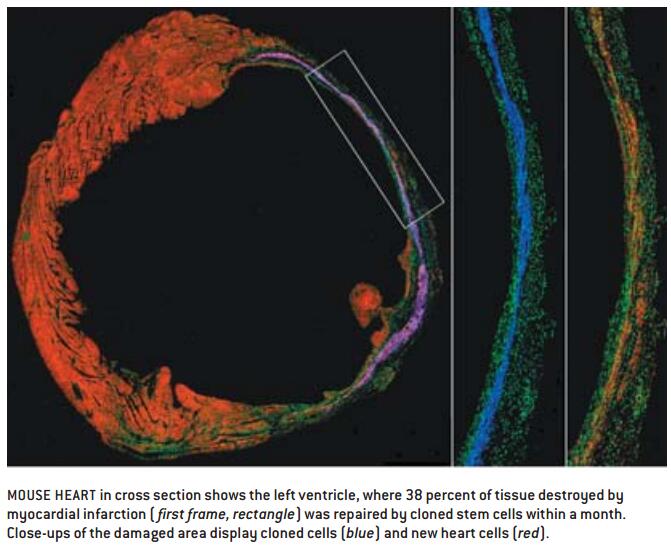
本文作者之一(Langa)最近表明,将克隆的小鼠胚胎的部分分化的干细胞,注入到供体小鼠心脏,这些细胞可自动到达因缺血而受损的部位,并在1个月内以健康的心脏组织成功替代38%的瘢痕[]见本页图。今年,应用体细胞核转移技术首次制备了一株人类ES细胞系。科学界的几位科学家已经开始思考并想弄明白,这项技术是否可利用灵长类动物的生理机能生产出治疗性干细胞,韩国汉城国立大学的黄武树(Woo Suk Hwang,音译)及其同事已经证明这是可行的。今年2月这个研究小组宣布,应用体细胞核转移技术,他们已经创建了1个人类胚胎,并离体发育成囊胚,他们从中获得了多能干细胞系。这一成就是一个重大的里程碑,同事也表明我们在这方面还有很多未知数。
因为有242个捐献的卵子可用,黄武树领导的小组可通过实验来检测各种技术,确定时间安排和选择各种实验条件。即便如此,也仅仅从200多个卵子中得到了一株ES细胞系。研究人员承认,他们并不能确定众多方法中究竟哪种方法是成功的关键,尚有许多关于卵子重新编程的神秘机理有待了解。此外,在构建和培养核转移过程中任何步骤都可能出错。
科学家未确定是否重新编程本身或是处理这些胚胎的方法可诱导基因突变,而后者可使最终生成的ES细胞衰老或恶性增生。因此,要解决这些潜在的问题,还需要进行更多的研究。在利用患者自身细胞构建ES细胞前,遗传性基因突变引起的诸如血友病或肌萎症的基因特异性修饰技术已成功地应用于人类ES细胞。这使得在植入干细胞前,为患者提供了一个安全纠正基因突变的手段。
经各种努力从克隆胚胎得到的动物,畸形或死亡率非常高。因此,在制备小鼠ES细胞时,常规从克隆胚胎得到的ES细胞的总体健康状态也受到质疑。但检测克隆的ES细胞的潜能时,通常将其注入到发育中的动物囊呸中,尽管最终得到的动物似乎十分正常。

这一结果提示,虽然生殖克隆因不可预测而不考虑用于人体,但核转移技术获得的ES细胞至少在治疗方面与常规ES细胞是相同的。应用匀核转移和试管婴儿胚胎不同技术获取ES细胞时,类似的安全问题也须解决。在--种称为单性生殖的方法中,一个未受精的卵经化学诱导可开始分裂,如同这个卵受了精一样。这些假胚胎样单性体比核转移的胚胎更易成活。在动物研究中,单性体在体外培养可牛成能分化成多种组织类型的ES细胞,其形成的畸胎瘤含有来自3个胚胎生殖层的所有细胞,因此也通过了畸胎瘤的检测。
与含有来自双亲各一套染色体的正常体细胞不一样,单亲体含有加倍的供卵者的染色体。此种加倍使得单性体含正常数量的基因,但植入子宮后不能成活。“单亲”还意味着单性体中抗原潜在组合数仅为正常的一半,较容易与病人的抗原相匹配。不到1000个单亲体产生的ES细胞系就可全部的美国人在免疫上匹配。
进行任何一种干细胞疗法的人体实验所要等待的时间,既取决于尚未解决的科学难点,同样还取决于政治因素[参见本页框文]。已搞清楚而可控的从ES细胞得到的细胞系,如合成多巴胺的神经元或眼底视网膜色素上皮细胞,在两年内可用于临床实验。同时,超常再生潜能的胚胎千细胞的出现,使人们更努力去寻找与成年正常伤口愈合有关的类似细胞。
隐藏的潜能
损伤后皮肤即刻开始自身修复。与蝾螈再生长出断离的尾巴一样,人类肝脏可在数周内再生至原重量的50%。我们体内的红细胞更新率达到每分钟3亿5千万个。我们知道在这些快速再生的组织中,增殖的干细胞一定起作用。干细胞这种能力也引发了一些问题,即为什么像脑和心脏这些器官不能明显地自我修复?特别值得注意的是,最近在这些器官中发现了某些所谓的组织特意干细胞。
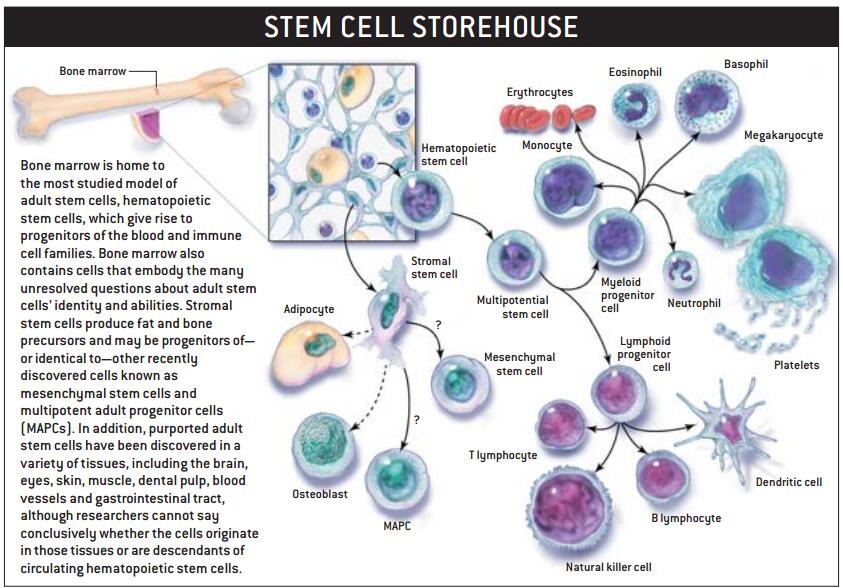
人体内最著名的是在骨髓发现的造血干细胞,它们是6种以上的血细胞的源泉,至少在某一组织系统中造血干细胞具有生成各种细胞的能力。这使得人们将其称为多能干细胞。
人们寄予愿望的是,能以在体内其他组织中发现的多能干细胞去修复损伤,而不是离不开胚胎干细胞。或者更进一步,能发现一种近似胚胎细胞多能性的全能细胞。
科学家刚刚开始研究,在很难进行自身修复的组织中,自然再生是否为某些因素所阻断?若是如此,那么清除阻碍这些组织再生能力的障碍是否可行?仅仅只有一种干细胞来源,还是存在着不同组织的成年干细胞的潜在源泉呢?这在研究人员中仍有争议。我们不能确定组织特异性成年干细胞是来自于哪些组织内,抑或是血循环造血干细胞的后代,同样也不知道这些成年干细胞在驱动下发育成其他类型且具有功能的组织方面能走多远,或者在实验室发生的跨组织的横向分化能否在体内重现。
某种干细胞具有较大分化潜能的设想,来自人骨髓移植术后的观察。当受体大部分组织中陆续发现了供体细胞时,这些现象暗示,在适合的条件下,源自骨髓的干细胞可在实质上对人体任何组织器官的形成作出贡献。与造血干细胞类似,在脐带血中发现的所谓胎儿干细胞也有类似的前景。

尽管科学家多次尝试用活体直接检测上述理论,但尚未得到支持这种可塑性的一致证据。今年3月,分别来自美国斯坦福大学的Bulsan和华盛顿大学的E. Murry领导的研究小组,都使用强效示踪方法观察造血干细胞能否进入到非造血组织——伤损心肌。结果两个小组都未能检测到这种干细胞对新生组织的贡献。
愈来愈多的证据表明,骨髓干细胞与心脏、肝和脑细胞存在广泛融合,这为推测横向分化提供了另一种解释。在将来的成年干细胞潜能研究中,关键是排除干细胞仅仅是与局部组织细胞融合而不能生产新细胞的可能性。
不过,组织特异性的细胞已得到令人鼓舞的结果。在德国进行的一项称为“前体细胞移植和提高再生能力,治疗急性心肌梗死”的研究中,研究人员将患心肌梗死后心肌严重受损病人自身的心肌前体细胞注入到梗死区的动脉,4个月后,损伤心肌组织条的面积减少了36%,同时,患者的心脏功能提高了10%。
因此,从成年组织分离少量的干细胞仍将是成年干细胞研究广泛应用到临床的最大难关。小鼠骨髓干细胞占总细胞数的万分之一,这个比率在人类可能更大。此外,干细胞也无可预测的存在部位,并且,我们能利用细胞表面抗原或基因表达的识别标志来识别干细胞的手段仍然很有限。即使一旦分离成功,成年干细胞生长极其缓慢也是众所周知的事实。体外培养也是一件费时费力的工作,而胚胎干细胞也同样如此。我们对可调控成年干细胞最终演化因素所知太少,以至于我们也不了解在培养它们时耗费大量时间是否削弱了其在患者体内修复损伤组织的能力。若不是单单去寻找患者的干细胞,而是将其移出体外培养,再回输到体内,很可能唤起体内隐藏的潜能。
越来越多的证据表明,与转移的肿瘤细胞一样,干细胞可对引导它们达到损伤部位的普通化学信息产生反应。本文作者之一(Rosenthal)最近发现,对小鼠来说,当干细胞被一种称为胰岛素样生长因子(IGF-1)激活后,可移动很长一段距离到达损伤部位[见本页图]。
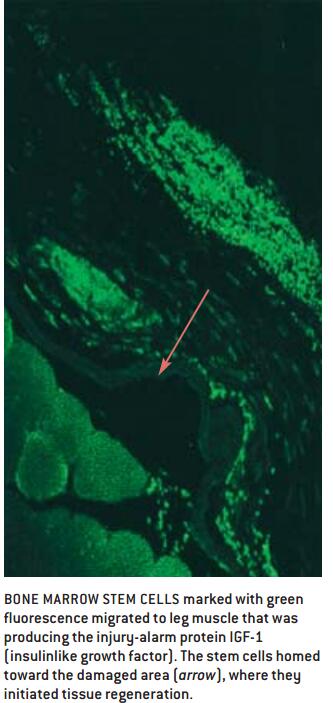
由此可见,唤醒体内自身的能力以启动干细胞的组织再生,需要更深入地理解这些化学信息所起的作用。Rosenthal及其合作者Musaro已经证明,IGF-1有助于诱导干细胞。但我们推测,这个分子也可能参与引起某些受损细胞返回到多能状态并开始分化成所需要的组织类型。这种称为断离再生的现象,构成蝾螈和斑马鱼再生成肢体和器官能力的基础。
再生医学的最终目标,是找到可调节成年组织反向分化的方法。从本质上讲,就是使终末分化的细胞返回到干细胞。许多研究人员正在寻找这种引起转化的魔力分子,最近,已有非常初步的研究成果报告。但是,反向分化的治疗性再生技术仍有很远的路要走,并在很大程度上取决于对干细胞(包括成年和胚胎肝细胞)本身的了解。
路在何方?
与科学征途上好常发生的现象一样,干细胞研究出现的问题和已解决的问题同样多,但该领域正在取得进展。人类成年干细胞在治疗心血管疾病的初步试验结果献令人鼓舞,在不久的将来肯定会引起更深入的探索。有了在动物中获得的有前途的实验证据,人类干细胞的衍生细胞进行治疗神经退行性疾病的临法实验已近在咫尺。
当我们继续争论作为实验研究和最终治疗性应用的干细狍的合适来源时,对此类研究的限制也在逐步放松。我们相信,生成替代细胞和再生器官是可行的现实目标。克服残留的障碍是困难的,但却不是不可能的
[张志文/译曾少立/校]
请 登录 发表评论