这种疾病让人丧失生活能力,其极为复杂的生物化学之谜尚未完全阐明,但目前正在涉足过去10年认为与此似乎毫不相关的东西
许多家庭要照顾一个丧失智力的父(母)或祖父(母),从而经受着极大的痛苦。这些患者仅仅几年前还是一个充满活力的家庭成员,病变的开始往往不为人们注意、重复发问。接着难于进行复杂的讨论和挑战性娱乐活动。患者家人常把这些不严重的问题归结于老年痴呆或疲乏,但患者进一步健忘,以至于去拐角的商店后找不着回家的路、甚至不识家人,最终,其日常起居的各个方面(洗浴、穿衣、吃饭及外出等等)都需要别人帮助。

这种严重的疾病称之为痴呆。其原因是部分脑组织停止工作,以及由此引起的记忆、判断力、推理及情绪稳定性的破坏。痴呆并非什么新概念,早在古希腊及中世纪的文学作品中就有清楚描述。大多数痴呆的发病率随着人们年龄的增长而增高,因此,随着社会的老龄化,痴病成为重大的全民健康问题,65岁人群中约有15%的人将患不同类型的痴呆,85岁人群的这个比例至少为35%。
所有的痴呆中,以阿尔茨海默病最为常见,400万美国人正罹患此病。专家估计到2025年世界上有2200万人受这种疾病的折磨。
迄今,研究者尚不清楚阿尔茨海默病的病因,仍然缺乏预防及有效的治疗手段。但流行病学、遗传学、分子生物学、细胞生物学和其他学科的发现已为研究者探明其某些发病机理奠定基础。
阿尔茨海默病的发生是由于某些蛋白质的正常加工出现可怕的错误,出现杂乱的脑细胞及脑细胞与毒性蛋白片段间的空间。有趣的是,许多其他神经变性疾病(例如额颞叶痴呆,帕金森氏病及Creutzfeldt-Jakob病)的特征也是蛋白加工变得杂乱无章。这些观察结果引导人们去寻觅治疗阿尔茨海默病和其他痴呆的新方法,可能包括疫苗接种,这些疫苗进入体内可清除自身的一些毒性蛋白片段。
对大脑的认识
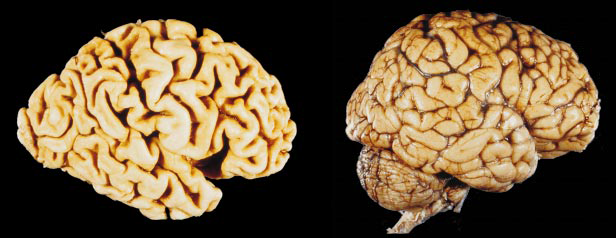
如今,研究者对病人大脑的直接检查是了解阿尔茨海默病的基础。显微观察显示在一定脑区内神经细胞丧失,如海马(记忆中心)及大脑皮质,大脑皮质主要涉及推理、记忆、语言和其他重要的思维过程,20世纪70年代以来,有关学者已探明,这些濒死的神经元中有一部分为胆碱能神经元,也就是说,它们之间神经冲动的传递是通过己酰胆碱这种神经递质进行的。乙酰胆碱最终被己酰胆碱酯酶阻断。过去10年,一些药物治疗阿尔茨海默病是有效的,如四氢氨基丫啶(他克林)和dortepezil可阻断乙酰胆碱酯酶的作用,通过保存乙酰胆碱的积累,在阿尔茨海默病的早期阶段可延缓病变的发展。不幸的是,一旦胆碱能神经元完全变性,将不能产生神经递质,药物变得无效。
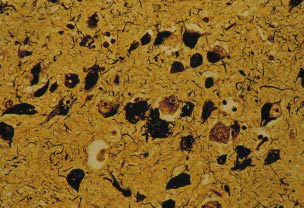
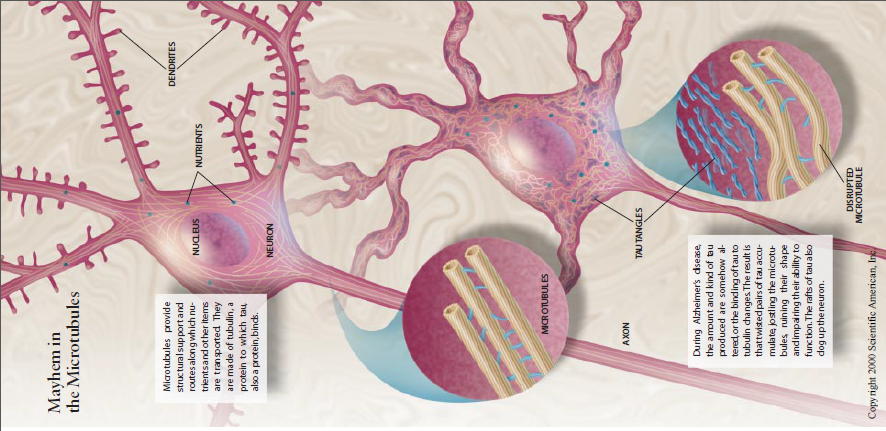
阿尔茨海默病的其他直接观察标志为大脑内的蛋白簇,这些蛋白质的积累表现为两种形式,分别发生在神经细胞内和细胞问细胞内部的蛋白簇称为神经纤维缠结,它们以成对的细丝相互缠绕成螺旋状。20世纪80年代几个实验室分析确定这些缠结由“tau蛋白组成,tau与微管蛋白相结合,后者是微管的构成部分微管至关重要,好比建筑物的粱和支柱,它们绕着细胞伸展、提供支撑作用并使之成形微管也为营养物质、其他分子和细胞成分(如囊泡、线粒体)在细胞间的运输提供途径。
Tau蛋白的缠结不仅仅存在于阿尔茨海默病。即使阿尔茨海默病人有高密度神经纤维缠结,并明与痴呆的严重程度相关许多学者仍然认为阿尔茨海默病人体内发现的第二种蛋白沉淀(淀粉样蛋白斑块)比tau的破坏更为重要。
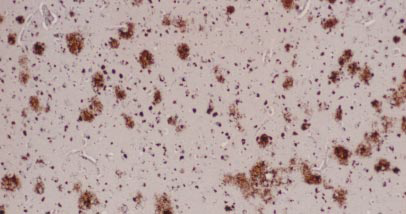
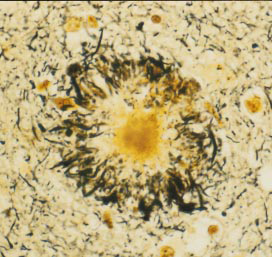
与神终纤维缠结不同,淀粉样蛋白沉积于神经细胞间,与之毗邻的神经元常常肿胀变形,这些蛋白簇(有时义称作老年斑或淀粉样斑块)常常伴有反应性炎症细胞即小胶质细胞,后者是大脑免疫系统的组成部分可以降解或消除受损的神经元或斑块本身。目前尚不太清楚这些斑块内或毗邻的神经元功能是否正常,因为斑块的密度与痴呆的严重程度仅轻微相关。此外,这些斑块多见于年龄较大的病人,然而较为特异的是,这些斑块广泛分布于阿尔茨海默病人的海马和大脑皮质,并且远早于神经纤维缠结出现。
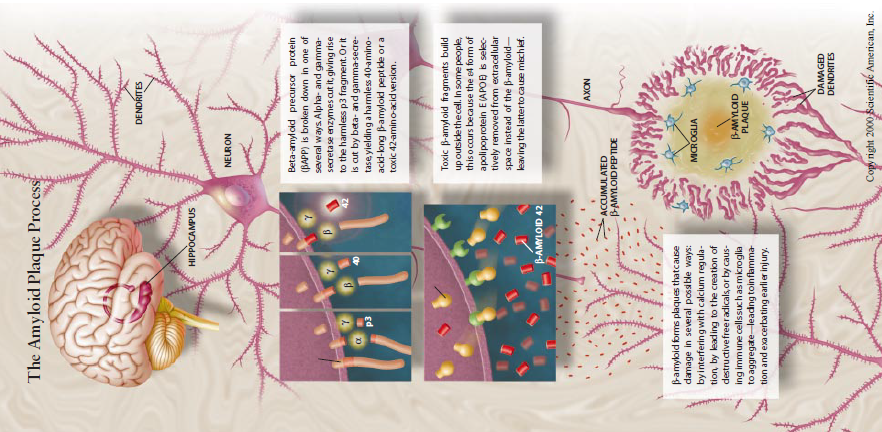
由于病变早期大量斑块的发现,使得研究者由此去探寻其生物化学机制,以期了解阿尔茨海默病的病因。大量工作致于分离这斑块的组成成份,1984年这类研究达到高潮,当时加利福尼哑太学圣迭戈分校GeorgeG.Gleral,发现,组成这斑块的重要组成成分是一种肽(很短的(白质片段),由40或42个氨基酸组成,即β-淀粉样蛋白,随之很快通过基因测序证实其来源于β-淀粉样蛋白的前体蛋βAPP。这些生物化学发现与同期遗传学的研究结果十分吻合。
自1907年德国神经病学家阿尔茨海默首次报道阿尔茨海默病以来,流行病学家试图了解它的模式。例如是存在家族性即与遗传有关,还是因环境因素而发病。20世纪80年代的研究开始显示在某家族发生这种痴呆的危险性增高调查人员发现,在患病家族中,该病要遗传给半数的子女(包括男性和女性)。这种模式表明常染色体(非性染色体)上缺失基因的遗传使某些家族易感性增高,也说明患病双亲突变基因的遗传较非患病双亲正常基因的遗传占优势。
流行病学家也追踪到阿尔茨海默病发生于无家族病史的人群,因此确定遗传并非阿尔茨海默病的唯一病因,该病显然有多种触发因素,估计在1%~40%的病人中,遗传因素起了一定作用。目前还在试图印证环境的催化作用,环境是单独起作用抑或与遗传因素共同作用,尚无定论。迄令已证实的几种危险因素引人注目,但尚未完全阐明相关的高危因素包括儿童早期教育程度低,严重的脑损伤和(最不确定的)饮水中含铝。然而它们和痴呆的发生并非存在必然的因果关系。这些因素实际上是其他因素或事件的特征,如头伤可减少神经元数量,致阿尔茨海默病症状出现更早。
然而,遗传物质的认识开辟了一个令人兴奋的研究途径,该领域的很多发现都与阿尔茨海默病的病因相关。无论足遗传的还是散发的阿尔茨海默病,其临床、神经病理学和生物化学的异常都是完全相同的结合斑块成分和神经纤维缠绵成分的发现以及遗传研究。产生了一系列创新性实验。通过分离β-淀粉样蛋白和βAPP基因,很快发现βAPP基因位下常染色体21上。与此同时,一些研究显示,某些家族性阿尔茨海默病患者的21染色体基缺失。唐氏综合征(21三体综合征)患者40岁时均表现出阿尔茨海默病的一些特征。
这些观察表明,β-淀粉样蛋白前体蛋白基突变位点可能导致某些阿尔茨海默病病例产生。这种预见很快在20世纪90年代初期得以证实,当时众多学者(如纽约医学中心Blas Frangione和Efrat Levy、华盛顿大学医学院Alison M.Goate、南佛罗里达人学Michael Mullan安特卫普大学Lydia Hendriks和Christine van Broeckiloven以及多伦多人学Harry karlinsky和作者的同事)在阿尔茨海默病家族患者身上证实了这些突变。(因为基因包含蛋白合成的指令,所以基因的突变意味着蛋白质的特异性将产生差异,这种变异可导致问题产生,就像换错发动机配件的情形那样。)一下子清楚地表明βAPP加工或活性异常导致疾病产生,这种新观念激发人们努力去探索长蛋白是如何在起始部位转化为β-淀粉样蛋白的。
虽然正常βAPP分子确切的生物学机制尚不明了,但是科学家现在已知道,多种细胞和组织都可产牛βAPP,其长度为695~770个氨基酸。该蛋白质遍布细胞膜的表面,小短片段伸入细胞内,长的片段突出在细胞外,中间片段横跨细胞膜。许多实验室工作揭示,在βAPP的生命过程中.它被两种方式之一切割。在一种过程中,蛋白质首先被α-分泌酶裂解,然后被γ-分泌酶酶切,两种酶切产生了无害的p3肽片段。(阿尔茨海默病研究者公认α-分泌酶具有切断作用。我们假定其存在,并且有很好的证据,但尚未将它分离出来。)
有害的酶切
βAPP的另一种切割方法则为另外两个步骤,并非总是无害产物。首先,β分泌酶(由Amgen公司Martin Citron及其同事们分离出来)修剪蛋白质,由此产生的片段有种叫作c99-βAPP片段(它的长度为99个氨基酸),后者再被γ-分泌酶切为β-淀粉样蛋白肽。
正常情况下,大多数β一淀粉样蛋白链长40个氨基酸,但其中少部分(不足10%)多两个氨基酸。哈佛大学Peter J.Lansbury和Bruce Yalikner及多伦多大学Paul E.Fraser和Joanne McLaurin等人研究显示,这种稍长形式的β-淀粉样蛋白形成斑块,并对神经元有直接毒性作用。
正在进行多项研究以期明确42氨基酸如何损害神经细胞。前期工作表明其作用方式有几种:第一,这种肽似乎破坏钙调节,导致细胞死亡;第二,它可能损害线粒体,引起氧自由基的释放,氧自由基可损害蛋白质、脂肪和DNA;第三,42-氨基酸肽和它引起的损伤可能导致细胞内物质释放.从而吸引免疫细胞产生炎症反应,进步加重肽造成的其他损伤,如此的恶性循环使损害升级。虽然这些可能的机制引起人们的兴趣,但至少现在它们在痴呆发展中的重要性还存有争议。
随着分子生物学家不断揭示βAPP和β-淀粉样蛋白肽片段的活性,遗传学家将继续关注βAPP基因的突变,他们已在βAPP链上识别出了几种导致氨基酸取代的突变α、β、γ-分泌酶正是在这些突变位点上发生酶切作用,不出意料的是,这些突变要么增加β一淀粉样蛋白质的量,要么增加有毒性作用的长肽的量。
基因位点突变干扰βAPP的酶切,进一步支持了阿尔茨海默病研究的中心为βAPP加工的变异这种现点。1995年作者及其同事们一道克隆了两个基因:早老因子1和早老因子2,这两个基因分别位于染色体14和L上,它们的损伤可导致非常具有攻击力的早发性阿尔茨海默病。(家族性阿尔茨海默病的10%~60%由早发性的。)这两个基因编码的蛋白质数次跨越细胞膜进行缠结,宛如一块布上的系列缝线。这些蛋白质经历了复杂的演变过程,它们首先被切割成两个片段,每个片段再结合成一个蛋白复台物,复台物又切割其他膜结合蛋白(如βAPP和切道蛋白),复台物切割与胚胎发育有关。
问题所在
比利时弗兰德斯校际生物技术研究所Bart De Strooper幕尼黑Maximillias大学Christian Haass、芝加哥大学Gopal Thinakaran及多伦多大学George-Hyslop小组的研究均显示,早老因子蛋白的某诱导突变破坏了这些复台物的活性,从而改变了它们所作用的蛋白质的形成。我们知道βAPP是该复合物的作用靶,因为人工诱导鼠的突变并不能使其产生早老因子1。由此推论,γ-分泌酶不能切割βAPP,诱导鼠不能产生β-淀粉样蛋白。在这些鼠中,其他几种膜蛋白也不能被恰当地切割(包括切迹蛋白)。
家族性阿尔茨海默病人群早老因子1和2的突变的作用恰恰相反,它们使得γ-分泌酶酶切增加,进而产生过量的β-淀粉样蛋白肽,尤其是具有危害性的长肽。要知道确切结果为时尚早,但早老因子可能就是γ-分泌酶。或许老因子通过某些间接途径与γ-分泌酶发生联系,它们可能通过使γ-分泌酶与βAPP接触而活化该酶或调节它的活性。
尽管βAPP与早老因子基因的突变具有重大影响,它们仅诱发早发的家族性阿尔茨海默病的50%,也就是说占阿尔茨海默病总发病人数的5%,从而表明还有别的基因在作怪。
1993年,现在Glaxo Wellcome公司的Allen D.Roees和他的同事Margaret Pericak—Vance(杜克大学)及Joilathan Haines(范德比尔特大学)研究发现,位于染色体19上的一个基因与更具代表性的晚发性阿尔菠海默病相关。Roses(当时在杜克大学)和Warren J.St血matter(也在杜克大学)分离出了载脂蛋白E(APOE)。APOE转运血中的胆固醇,并与细胞的修复和再生有关。APOE基因具有三种形式或等位基因,其等位基因出现的频率在不同的人群略有差异:ε3为正常,见于40%~90%的人群;ε2和ε4少见.分别见于2%及6%~37%的人群。Roses和他的同事发现阿尔茨海默病病人ε4的比率相当高,约为40%。
ε4等位基因可通过各种方式增加患阿尔茨海默病的危险性。一种解释认为ε4蛋白同β-淀粉样蛋白肽竞争,以求离开细胞问的空间。研究还发现,有种负责将物质拖离分子间空间的分子,其转运ε4蛋白的效率比转运β-淀粉样蛋白肽更高,从而β-淀粉样蛋FI蒂秘并产生生物化学紊乱。支持这种说法的证据在于:携带ε4变异的病人体内β-淀粉样蛋白含量高于携带ε2和ε3变异的病人。此外,βAPP突变及ε4等位基因携带者比相同βAPP突变及ε2(或ε3)等位基因携带者患阿尔茨海默病早得多。
过去10年积累的证据清楚表明,阿尔茨海默病的触发因素之一是βAPP和β-淀粉样蛋白肽加工异常,然而有几个重要问题尚未弄清。βAPP分裂及β-淀粉样蛋白积累等问题出现在病变期,但以后情况怎样?为什么β-淀粉样蛋白斑块的密度并不能反映痴呆的严重程度?从本质上讲,问题在于β-淀粉样蛋白肽斑块实际上是否导致痴呆发生。这个长期悬而未决的根本问题驱使人们去争论去研究。作者认为,βAPP及β-淀粉样蛋白肽的异常触发了阿尔茨海默病,其途径是激活一系列事件,最终损害及杀死神经元,直至痴呆发生。后期有害事件之一可能是神经纤维缠结的出现。
再认识“tau”蛋白
直到最近,人们都认为tau蛋白丝的异常缠结是无害的继发事件,但有关额颞叶痴呆的分析结果对该结论提出了质疑。额颞叶痴呆是一种罕见的痴呆类型,其中部分病人可见tau蛋白沉积,与阿尔茨海默病相同,这些额颞叶痴呆也呈家族性。加利福尼亚大学旧金山分校Kiek C.Wilhelmsen和其他学者的遗传学研究表明,家族性额颞叶痴呆由基因所致。
这些基因之一位于染色体17,是tau蛋白质的发源地,华盛顿大学Gerard D.Schellenberg研究了人体内存任tau蛋白累积的额颞叶痴呆病人。从而证实tau基因的一种突变Schellentberg 1988年的发现具有重受意义,因为它表明tau蛋白的积累和加工异常可直接导致痴呆产生。
因此,神经纤维缠结也可能是阿尔茨海默病的组成部分。这种可能性为10年前加州大学圣迭戈分接Robert D.Terry和Rotbert Katzman指出的事实(阿尔茨海默病神经纤维缠结的密度与痴呆的严重程度相关)提供了更好的解释。我们尚不确切知道tau基因突变是怎样引起额颞叶痴呆的,但实验已指明了思路:微管损害。Tau基因的错误,可能干扰tau蛋白与微管蛋白(微管的支柱)结合的方式,或者它们可导致tau蛋白种类失衡,两种情况的最终结果都是致使过量的tau蛋白产生,并累积于成对的螺旋丝状体。随后微管结构不能正常工作,tau蛋白束的聚集将扼制细胞的转运机制。结果,神经元既不能传导电信号,也不能运输营养物质和其他糸细胞的远端。极有可能的情形是βAPP和β-淀粉样蛋白的异常导致一系列事件发生,其一些事件使tau蛋白发生变异,这种变异进一步损害神经元,引起痴呆。
治疗进展
过去10年物化学、分子生物学、遗传学、流行病学及临床研究发现,大大增进了我们对阿尔茨海默病发病机制的认识,并且越来越有可能在未来几年内诞生一些有效的治疗方法,其中部分方法可能来自对tau蛋白加工错误的研究。事实上,βAPP及β-淀粉样蛋白肽的研究成果已推动了治疗研究。
例如,若干学者正在研制一些化合物,这些化合物将阻断β或γ-分泌酶对βAPP的酶切,进而遏止有害β-淀粉样蛋白肽的产生;其他的研究侧重于β-淀粉样蛋白肽造成的损害,临床试验则致力于抗氧化剂(例如维E)或类固醇抗炎药物(如布洛芬)能否缓解β-淀粉样蛋白的某些毒性作用。
许多学者正在研究运用某些模拟染料(如刚果红)的化台物渗入淀粉样蛋白斑块,或者glycoaminoglycans分子(似乎与β-淀粉样蛋白聚集有关),从而减少β-淀粉样蛋白的积累。这些物质能阻断β淀粉样蛋白肽在体内的聚集。
据此,加州Elan制药公司Dale Schenk和他的同事最近报道了一种β-淀粉蛋白的疫苗。他们发现,在携带淀粉样斑块(而不是tau缠结)的阿尔茨海默病患鼠体内注入β-淀粉样蛋白疫苗,可减少斑块的数量,换言之,该种疫苗能诱导抗体击攻击和清除β-淀粉样蛋白丛。此疫苗对阿尔茨海默病人是否有效将是临床研究的热点。
无论治疗前景如何,令人欣慰的是与此同时有多种视角的追踪研究。有关阿尔茨海默病不同阶段及相关生物化学因子的信息激动人心,终将为研究者提供考察阿尔茨海默病的更佳视点,也许还是近乎完美的视点。
请 登录 发表评论