首次合成的短链DNA正被开发作为药物。这些化合物叫做反意义(antisense)和三螺旋药物大概能够攻击病毒和癌细胞而不伤害健康的组织。
对致力于治疗疾病的人来说,没有任何事情比发现“魔弹”(magic bullet)——一种能够扭转病情而不产生副作用的药物——更令人高兴的了。在20世纪的大部分时间里,希望找到魔弹的研究人员对能对疾病产生影响的蛋白质活性位点相结合的药物给予了考虑。使用填补活性位点(一种蛋白质的活性位点与另一种蛋白质的活性位点是不相同的)的方法,药物也许就会抑制靶蛋白的活性,而不会干扰所需的蛋白质的活性。
对靶蛋白活性位点的研究正在进行。可是,最近有一些研究人员已把他们的注意力转向令人振奋的新靶型。这些研究人员正试图设计出将结合核酸(DNA和RNA)上指令合成与疾病有关的蛋白质选择位点的药物。
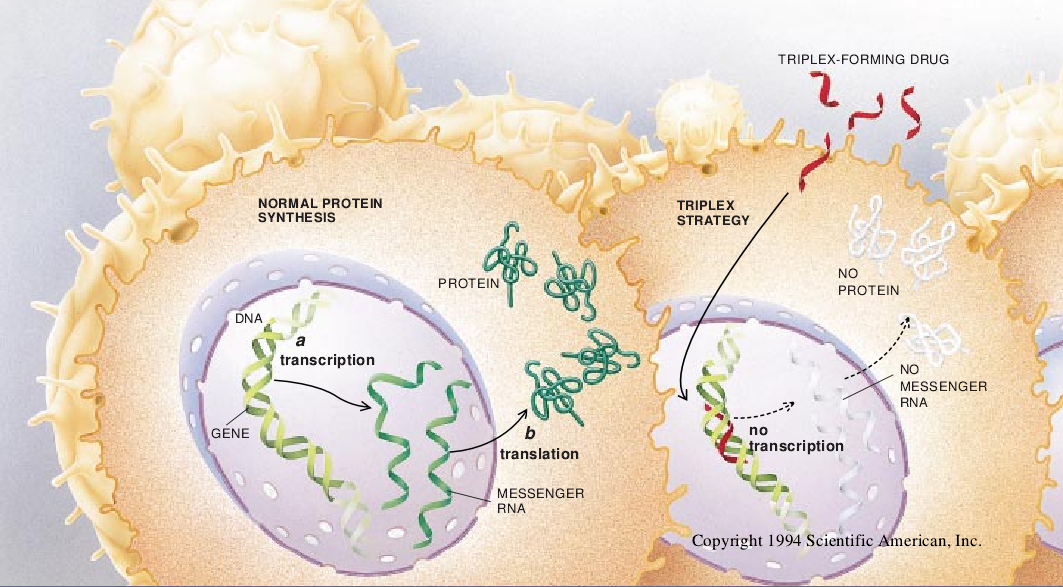
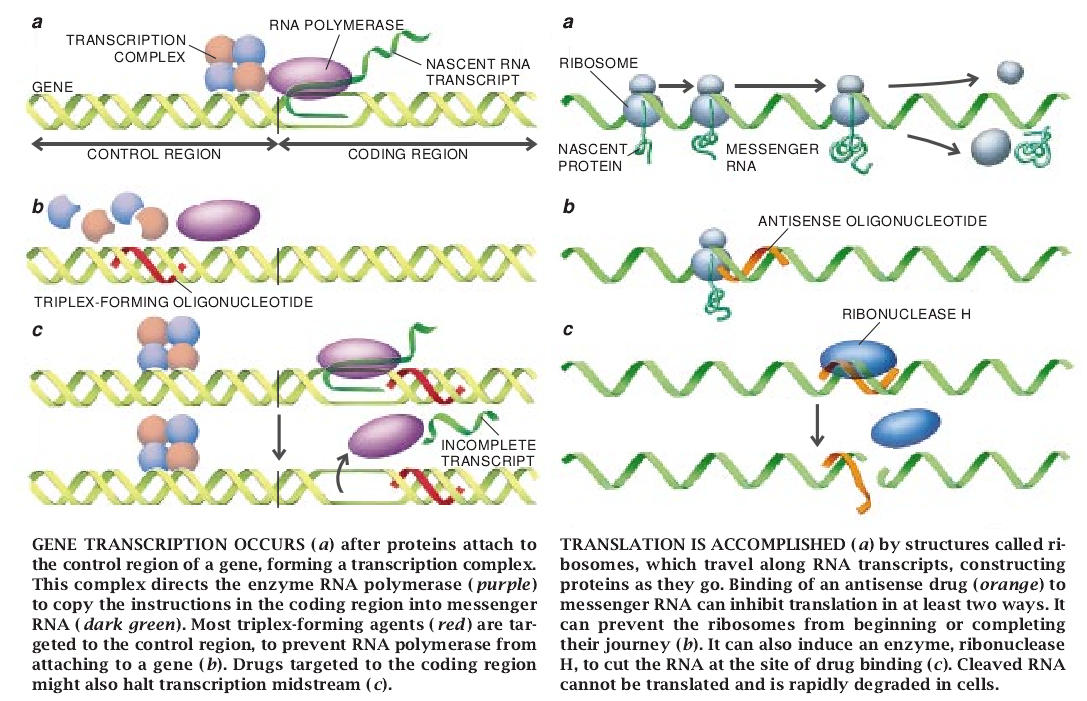
道理很简单。要制造蛋白质,规定其组成的独特基因必须得到表达。亦就是说,该基因必须把双股DNA转录(拷贝)成单股信使RNA的单个分子,然后再必须把这种RNA分子转译成规定的蛋白质。研究人员通过把新药附着于所选择的DNA片段(以三螺旋方式)或信使RNA(以反意义方式)上的方法,希望新的药物会抑制转录或转译入选的基因——它们是微生物基因或人体变种的畸变型。在这种情况下,这些药物(化合物)不仅会使有毒的蛋白质失去能力,而且还会完全阻止有毒蛋白质的制造。
得到最广泛研究的结合药物的核酸是DNA寡核苷酸或寡聚物:构建DNA各组合小区的短股核苷酸。把这些寡聚物挑选出来作药物的部分原因,是这些核酸会按照已充分了解的规律彼此进行结合。其结果,就可以把化合物设计成能识别所选择基因上或它的信使RNA转录本上的独特位点。因此,化合物有能力达到魔弹所需的特异性。
要常规使用三螺旋和反意义治疗仍然存在着一些障碍。但对于积极从事此项研究的研究人员来说还是有充足的理由的。一些寡核苷酸药物事实上业已证明足以期望应当进入临床试验。在需要提高治疗效果的患有白血病、艾滋病和其它病症的患者中正在用它们做试验。
由于寡核苷酸药物实质上是遗传物质的片断,所以往往把它们看作基因治疗。可是,我们应当记住,这些治疗方法明显地不同于标准的基因疗法。绝大多数基因疗法提供的完全健康的基因,以作为缺失或无力指令充分合成所需蛋白质的模板的替代物。寡核苷酸不能提供蛋白质的生产,它们的效能依赖于它们阻止现存基因表达的能力。
被称为三螺旋战略而使用寡核苷酸以阻止转录。理由很简单,因为寡聚物缠绕于双螺旋的DNA的周围形成三股螺旋。这后一种逻辑上叫做阻遏转译战略的“反意义”是不外显的。可是,只要人们知道RNA结构的咬合处,它就能够很容易地被抓住,而且一个RNA分子与另一个RNA(或DNA)分子的结合就是以此方式进行的。
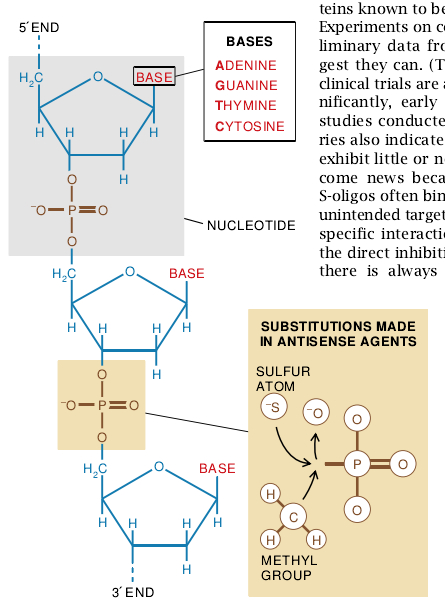
核苷酸链就是RNA分子。这些核苷酸由核糖、磷酸根(PO4)和四个含氮碱基之任何一个——腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)和尿嘧啶(U)所组成。DNA的核苷酸除了糖是脱氧核糖和胸腺嘧啶(T)取代尿嘧啶之外,均相似于RNA。当RNA或DNA的核苷酸组装成单链时,糖和磷酸根变成了所形成链的骨架,碱基则从骨架中伸出。正如James D. Watson和Francis Crick于1953年发现DNA双螺旋结构所阐述的那样,两个核酸通过它们的碱基之间所形成的氢键而结合成双链结构;一股链上的腺嘌呤与另一股链上的尿嘧啶结合,而鸟嘌呤则与胞嘧啶相结合。因此,如果DNA—股链组成的顺序为AUCCGUG,那么它就可能与含有互补顺序——在RNA的情况下为UAGGCAC,在DNA的情况下为TAGGCAC的核苷酸之第二股链配对。
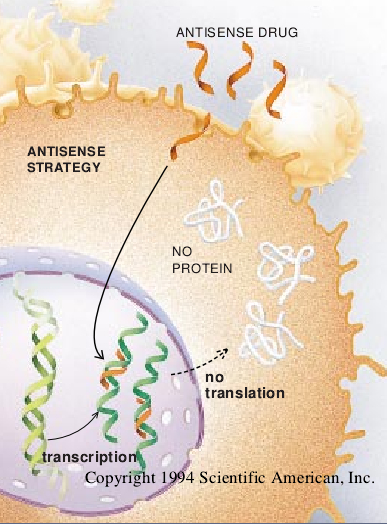
由于沿信使RNA分子的碱基顺序标明了必须串联起来才能制成蛋白质的一系列氨基酸(换句话说,载有细胞所需的信息),所以,说明顺序是有意义的(有方向性的)。要产生一个能够结合到有意义链上去的分子,我们就必须构建一股含有互补的、“反意义”顺序的核苷酸。所以,把用寡核苷酸抑制转译的操作规程叫做反意义战略。
反意义寡核苷酸是目前已接近临床试验的首批新的基因药物。它们作为具有治疗价值的最早线索之一出现于80年代初,当时科学家们发现有些微生物除制造信使RNA之外,还能天然的产生反意义RNA。对这种习性的大多数逻辑上的解释似乎是,微生物使用反意义分子作为对调节基因表达的一种先前未被认识的工具。如果反意义RNA与它的互补信使RNA分子配对,那么也许它就会干扰微生物作用于有意义链和产生所指令的蛋白质的转录机制的能力。
目前已经知道,植物细胞和动物细胞与微生物细胞一样,有时也采用反意义战略去控制基因表达。但在当时,研究人员仍试图弄清他们的假设是否正确。他们借助重组DNA技术,创建了可以使入选的信使RNA种产生反意义副本的基因。接着,他们把这些基因放入细胞内。果然,该程序往往就会导致阻挠由靶RNA链编码的蛋白质的制造。
这些结果表明,可以把反意义分子设计成会选择性地阻止转译的药物。可是,要使之得到最广泛的应用,这些药物就必须容易而有效地被传递到机体的细胞内去。也就是说,在大多数情况下,最好的方式也许就是投给短链合成的反意义核苷酸,而不是投给完整的、不方便的基因——尽管有些研究人员仍在继续检验重组反意义基因的治疗价值。
到了本世纪的80年代中期,已能使用各种方法毫不费力地合成DNA寡核苷酸,但寡聚物能否被支持用来作为药物还存在一些其他的问题。1978年前的头几年,武斯特实验生物学基金会的Paul C. Zamecnik和哈佛大学的M. Stephenson已艰辛地构建了一个13核苷酸寡聚物用以识别由罗氏肉瘤病毒制造的许多信使RNA分子中存在的碱基顺序。这个寡聚体降低了细胞内病毒的复制,表明它具有阻止精心制作的新病毒粒子所必需蛋白质的生产之能力。尽管如此,仍有两个潜在的问题烦恼着研究人员。
首先,未改性的寡核苷酸在每个磷酸根上都载有负电荷。电荷分子往往难以扩散横穿过细胞的无电荷膜。因此,大多数研究人员假定多电荷的寡聚物也许无力有效地进入细胞里去。其次,细胞富含有裂解外源DNA的酶类;似乎可以这样认为,设法进入细胞的寡聚物在大多数情况下会立即被降解。
为找出这些缺陷,Paul O. P. Tso和Paul S. Miller以及他们在约翰•霍普金斯大学的同事测试了改性标准寡核苷酸的值。作为此种努力的一部分,他们用甲基(CH3)取代了每个磷酸根中的一个氧原子。他们这样做了之后,就把带负电荷的磷酸盐转换成无电荷单位,称之为甲基化磷酸盐。这一步骤有助于增加细胞对寡核苷酸的吸收,并使它们抗拒由酸类所引起的分解作用。令人遗憾的是,消除寡聚物上的电荷就提供给了它们以疏水性(憎水),并由此而在水溶液中不大能溶解。失去溶解性能使物质的生产变得困难起来。
美国食品药物管理局的Kazuo Shinozuka和Gerald Zon与本文作者之一(Cohen)(当时在国立癌症研究所工作)一道进行研究,不久选定了另一种方法代替甲基磷酸盐寡核苷酸。他们用带负电荷的硫原子交换普通磷酸根中的氧原子。这些硫代磷酸酯寡聚物——大多称为“疏寡”(S-Oligos——是水溶性的,易于自动生成并抗酶解),也许正是由于这些理由,目前大数反义药物的研究都采用S-Oligos。
具有讽刺意味的是,现在看来,细胞吸收S-Oligos和未改性的寡核苷酸比原来想象的要容易得多。这些带电荷的药物似乎不仅用直接扩散穿过细胞膜的方法进入细胞内,而且还同时采用了细胞内吞作用以进入细胞。在此过程中,细胞膜吞没此种化合物,然后让其自我折叠,产生小的囊泡,接着被拽进细胞质。还不大清楚的是,这些核内体的内含物是否容易地被释放出来。
要在治疗上使用反意义寡核苷酸,除了减少一些原来想到的障碍之外,在过去15年间,研究人员对设计反意义药物必须考虑进去的一些重要因子也曾进行过阐述。例如,寡聚物至少必须要有1个核苷酸长以便紧密的结合到靶位点上去并避免与非靶位点结合。相关分析也都肯定,反意义寡核苷酸至少有两种方法能够阻止转译。根据预测,反意义寡核苷酸具有干涉细胞“解读”有意义RNA的能力。此外,它们通过结合到信使RNA上去的方法,能够刺激酶(核糖核酸酶H)裂解,并由此而破坏结合的信使RNA。
综合上述研究结果点燃了我们的信心,反意义战略有希望用于治疗。可是,实际上反意义DNA能够阻止已知在病症中所涉及到的蛋白质的生产。根据培养细胞的试验和从人体试验所得的初步数据表明了它们能够阻止。据我们所知,临床试验都是采用的S-Oligos。由几个实验室早期用动物进行试验所发表的报告显然都指出,反意义药物几乎没有毒性。这个信息很受欢迎,理由是培养细胞中的S-Oligos常常结合到蛋白质或其它非预定的目标上去。有时,这些非特异性的相互作用实际上扩大了抑制转译的范围。但是,这里总是存在一个令人担心的问题,它们也许可能有不需要的后果。
接近上市的第一批反意义寡聚物也许将局限于用来与病毒感染作斗争。设在加州卡尔斯巴德的ISIS药业公司正在对寡核苷酸进行大规模的临床试验,目标瞄准复制人乳头状瘤病毒的一个重要的病毒基因的转录本。这种病毒是引起生殖器瘤的病因。已有报导说患有此种肿瘤而接受皮下注射的许多病人,其肿瘤消失或者变小。
目前正在感染人免疫缺陷病毒(HIV)而得艾滋病的病人身上做初步的临床试验。法国国立艾滋病研究局、麻省沃塞斯特尔杂交瘤研究所和世界各地有关的科学家们正在对控制HIVgag基因(HIV病毒复制所必需的基因)的RNA产物之寡聚物进行评估。
与癌症作斗争的寡核苷酸的临床试验也才刚刚开始。试验之一是在患急性骨髓性白血病(一种迅速增生的血癌)的病人身上进行。在试验中,内布拉斯加大学医学中心的一个研究小组正在与加州海沃德Lynx治疗研究所的科学家们合作,以检测反意义寡核苷酸破坏机体内癌细胞的能力和在称为体外骨骼清除法中破坏癌细胞的能力。在后一种方法中,医生们从病人身上移去骨髄并用有选择性地杀死癌细胞的药物来治疗它。接着经对病人进行化疗后,医生们再把经“清除过了”的骨髓细胞返回到机体内去。这项研究中使用寡聚物瞄准的是p53基因产生的RNA。这个基因通常被认为是一个肿瘤抑制基因,但它在患急性骨髓性白血病病人中显然是超表达了。
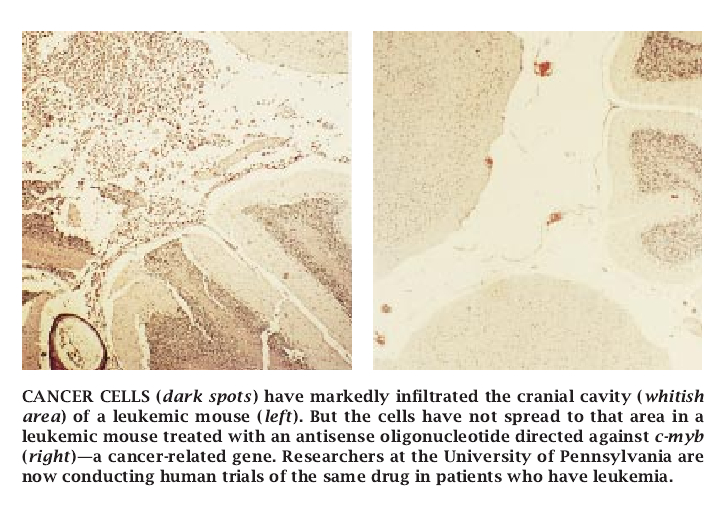
Lynx同时正在与宾夕法尼亚大学的Alan M. Gewirtz合作,分析用于治疗慢性骨髓性白血病的反意义药物。这项试验正在再度评价一种在体外骨髓清除期间用于消除癌细胞的反意义药物的能力,其目标是瞄准信使RNA。这种信使RNA是由被叫做C-myb的基因转录的。在C-myb处于健康状态时,它促进血细胞的正常增生。该基因的异常调节已被认为与引起人的白血病和其它疾病有关。Gewirtz还正在开始试验把反意义药物直接注入白血病病人的功效。
正在进行或制订对其它病毒和与癌症有关的基因的临床试验。即便研究的结果是有效的,但反意义药物最终也许将与其它的抗癌药物或抗病毒药物一起投服。由不同机制起作用的两种或两种以上的化合物似乎证明比只单一的投服任何一种药物更加有效。
作为可预期出现的任何技术,在其完全有希望将反意义战略付诸实现之前,有许多困难仍必须加以解决。寡核苷酸生产费用昂贵(尽管成本正在下降)就是一件难事。化合物的稳定性也必须得到提高。而致力于把寡核苷酸作为药物使用的研究人员必须找到更好的方法把药物大量地传递给细胞。我们下面所研讨的三联体研究亦会碰到这些相同的问题。
同时还需要提高药物的效能。要得到这一好的效果,一些研究人员正在把降解RNA的媒体吸附到分子上。在其它的方法中,巴黎国家自然历史博物馆的Claude Heleene及他的同事已使载有化学基因的寡聚物能够自我插入到DNA-RNA双螺旋上的连续碱基对之间;这种插入理应稳定这种结合或延长反意义的活性。Cohen的研究小组和其他研究小组正利用分子模型去设计具有新骨架结构的寡核苷酸,以期提高功效和特异性。
其间,一种完全不同的反意义方法正在令人信服的前进。被称为核糖酶(ribozymes)的RNA分子正在用来取代DNA寡核苷酸。这些分子识别信使RNA中特定的碱基顺序并在那些位点上切断RNA,由此而破坏转录本。在近几个月中,加利福尼亚大学圣迭戈分校的Flossie Wong-Staal期待开始瞄准HIV中一基因RNA转录本的核糖酶的临床试验。
另一种新的基因战略——三螺旋法直到最近仍很少受到注视,但它的可能性的暗示在50年代就提出来了。Watson和Crick发现双螺旋DNA的结构后的第4年,当时仍是博士后研究生的Gary Felsenfeld和Alexander Pich在国立卫生研究所开始进行他们自己对核酸形成的多链结构的探索。他们合成了含尿嘧啶核苷酸的RNA多聚物并将它们与互补链混合——合成含腺嘌呤的核苷酸的多聚物。正如所预料的那样,它们能够重新得到AU双螺旋。令他们非常吃惊的是,他们还发现了螺旋,在此三螺旋中,额外的一股含尿嘧啶的核苷酸结合到AU双螺旋上。
后来,加利福尼亚大学伯克利分校的Michael J. Chamberlin及其同事指出,全部由胸腺嘧啶或腺嘌呤核苷酸组成的相应的RNA多聚物可以装配成TAT三螺旋。而且,当时在威斯康星大学的Richard A. Morgan和Robert D. Wells还生产了另一类完全的DNA三螺旋。他们证实一股胞嘧啶核苷酸可以结合到GC双螺旋上去。在该例中,当分子处于微酸性溶液中时才会出现这种三螺旋,因为在此种微酸性溶液中质子是丰富的。之所以需要此种酸度是因为只有当额外带有胞嘧啶的链获得附加的质子后才能形成三螺旋,由此形成的结构称为CGC三螺旋。
在此大约10年的期间内,由于对设计能够调节细胞内天然基因的药物缺乏明显的意义,所以各种三螺旋似乎不大能引起人们的好奇心。最后,有机体的基因都不是由单一的携带一种无限复制的核苷酸的“同质”(“homo”)多聚物构成的。如果形成三螺旋的核酸能投入实际应用,那它们就必然能识别携带有一种碱基对以上的链的基因。
60年代末期,Morgan和Wells确认,含有TAT和CGC单位的三螺旋结构可能是一含有胸腺嘧啶和胞嘧啶的寡聚物与含有AT和GC減基对的双螺旋结合而成。由于他们建立的三螺旋结构而第一次有力地表明,三螺旋的形成完全能够发生于天然基因上,而不单单只发生于合成的双螺旋上。遗憾的是,追踪这种意图所需的手段还不太有效。例如,克隆基因和自动合成DNA寡核苷酸所需的工艺仍然还未想出来。
虽然到了80年代末,这些问题已成为历史。加之,研究人员已掌握了关于怎样调节基因转录的一整套方法。他们发现,基因基本上是由两个部分组成。其一是调节区,控制转录的速率;其二是编码区,规定相关蛋白质的氨基酸顺序,当被称为转录因子的蛋白质结合到控制区上的特定位置时,基因被转录。此种结合发生后.一种被称为RNA聚合酶的酶附着到编码区上并产生贮存于该区内的信息之信使RNA的拷贝。通常用保护性蛋白质覆盖的编码基因片段对药物不易接受,但调节区或控制区的某些部分则显然往往比较易于接受药物。
这些信息暗示,研究人员将会得到很好的忠告去集中力量设计出能够结合入选基因的控制区的寡核苷酸,由此而制止启动转录的转录因子。但是,首先科学家需要提供更多的证据证明合成的寡核苷酸可以识别天然基因上入选的碱基对顺序。
这样的证据于1987年得到了。加利福尼亚理工学院的Peter P. Dervan和Helene分别证实,Morgan和Wells早就以合成双螺旋DNA的链而予以证明过了。在一定条件下,富含AT和GC碱基对位点的天然基因实际上可以与寡核苷酸结合而制成TAT和CGC三螺旋体。在这些实验中,当靶DNA双螺旋的一股主要载有嘌呤喊基(腺嘌呤和鸟嘌呤),而另一股则留下嘧啶碱基(胸腺嘧啶和胞嘧啶)时,三螺旋就形成了。目前业已证明,现在所研究的寡核苷酸通常正好结合到双螺旋的一股上,而且只结合到该股的嘌呤碱基上。
Dervan和Helene的研究成果是令人好奇的。可是要在治疗上应用三螺旋战略的严重障碍仍然继续存在。正如Morgan和Wells的结果所预料的那样,他们的三螺旋在生理的pH水平时表现不出来;它们只有当溶液处于酸性时才可以出现。
Dervan能以其它途径来部分地解决这个问题,其办法是把碘原子或甲基加到标准的寡核苷酸上。1988年,本文作者之一(Hogan)和他在普林斯顿大学的同事用不同的方法取得了成功——其中之一还增加了寡核苷酸对它们的靶的亲和性,而且还产生了一个新的三螺旋结构的变种。他们确定,通过在形成三螺旋的寡核苷酸以前是胞嘧啶所在的位置上插入含鸟嘌呤的核苷酸的方法可以消除对酸性pH水平的需要。这些经改变过后的寡聚物产生出了GGC三螺旋体,但不是CGC类型的三螺旋体。合成链中的鸟嘌呤与双链DNA中的鸟嘌呤相连接。
Hogan的研究小组与其他小组后来都证明,构建于基因调节区上的TAT和GGC三螺旋体之寡核苷酸,有时可以像一般能识别那些位点的蛋白质那样成紧密的捆。这种相似性带来了希望,可以构建寡核苷酸药物来阻止基因与调节蛋白的结合。
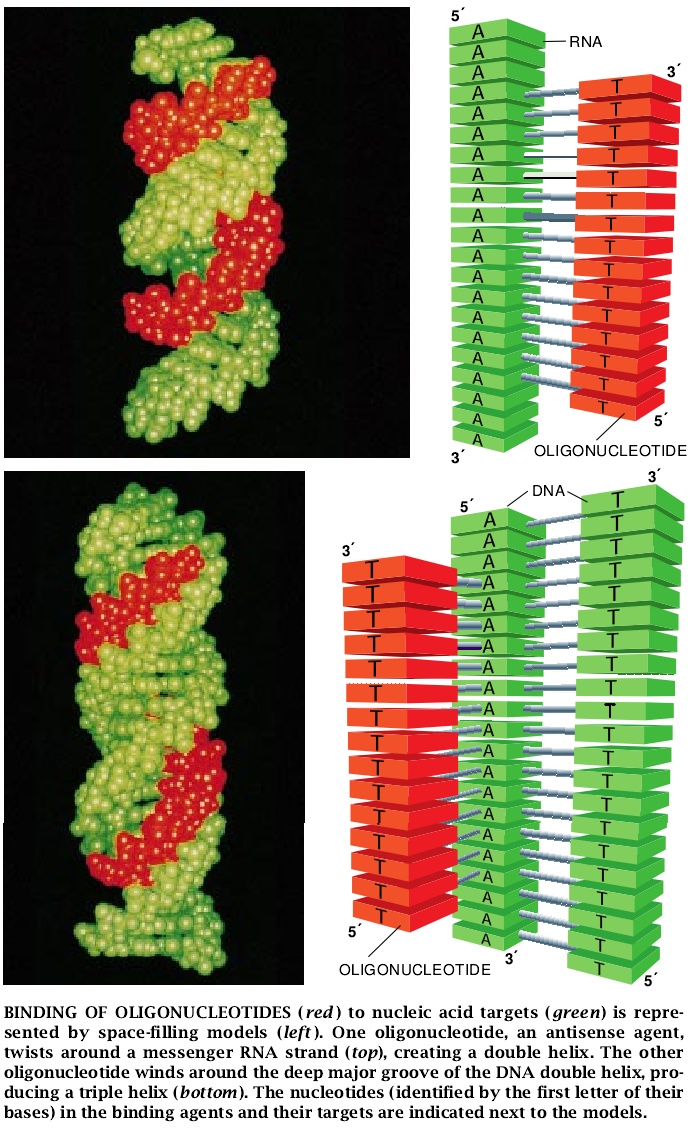
要创建三螺旋药物,设计人员必须精确地了解所给定的寡核苷酸怎样才会与它的目标物相互作用。现在,他们已知道,形成三螺旋的寡核苷酸不干扰保持原有的双螺旋结合在一起的氢键。相反,寡核苷酸中的每个碱基与双螺旋靶区中的嘌呤碱基形成两个新的氢键。原来有些寡核苷酸也是与它们的目标物正向排列的,而另一些寡核苷酸则与它们的目标物反向排列的。DNA链是非对称的。一端被命名为5'末端,而另一端被命名为3'末端。在典型的双螺旋中,链是反向排列的:一股链的5'末端靠近另一股链的3'末端。含有胞嘧啶和胸腺嘧啶的寡核苷酸趋于平行的靠近双螺旋目标物的富嘌呤链。那些含鸟嘌呤和胸腺嘧啶的寡核苷酸则趋向于反向排列。如果不把这些差异考虑进去,寡核苷酸就会识别不了它的DNA目标物。
1988年,Hogan实验室的Edith H. Postel和Michael Cooney用与癌症有关的基因c-myc研究,得到了第一个证据。设计在基因的控制区上制造三螺旋体的寡聚物可以抑制信使RNA合成的启动。他们对此寡聚物进行无细胞转录鉴定,将该基因和寡核苷酸与试管中的各种细胞成分混合在一起,而不是与完整的细胞混合。后来,Dervan再度在无细胞系统中证明,三螺旋的形成能够阻止入选病毒基因的转录。
在其它基因上也获得了同样有希望的结果。因此,现在能被普遍接受,至少是在试管中是如此,形成三螺旋的寡核苷酸,能够把它们设计出具有准确地寻找入选基因控制区的能力和有选择性地阻止其转录成信使RNA的能力。最新的证据还指出,瞄准基因编码区的三螺旋药物能够阻止RNA聚合酶构建信使RNA转录本的努力。这一发现意味着当不能阻止转录的启动时,三螺旋药物也许能够在中游切断转录。
活细胞的研究加重了这种可能性,即三螺旋化合物最终能够用于抗御与疾病有关的基因。Helene已证实瞄准编码白细胞介素2受体的基因的控制区的寡核苷酸,能够抑制此基因的表达。Hogan实验室的Postel和其他研究人员也表明,瞄准人的c-myc基因调节区的寡核苷酸能够抑制人的肿瘤细胞株的基因转录。其它实验室已同样地证明,寡核苷酸能够降低活细胞中各种与癌有关的基因和病毒基因的转录。迄今还没有有关动物试验的资料的报导,而人体试验的报导同样也没有。可是这种情况在未来几年中似乎会有变化。
不用说今后要走的道路仍是不平坦的。在一些致力于开发以寡核苷酸为基础药物的研究人员面对着重重困难的同时,三螺旋研究人员也面临着它自身的特有的挑战。例如,控制着终止细胞内转录的寡核苷酸。目前只有当其以比较高的浓度传递时才起作用。可是可能低于所要求剂量的设计仍在继续进行。
较为主要的限制是要求在同一链上实际上要携带它们的全部嘌呤。从这些现点产生的少量偏差目前尚能适应。不过,双螺旋DNA上一半以上潜在的靶在每股链上含有嘌呤和嘧啶的混合物,作为这个问题的第一个解决方案,Derrvan和他的合作者已用能让寡核苷酸从一股链“跳到”另一股链去的化学基团取代寡聚物中的磷酸根。正在研究甚至更为复杂的结构变化。肯定这些改型处理中的一些改型将扩大形成三螺旋的寡核苷酸可利用之DNA靶的范围。
反意义和三螺旋技术目前可能很不完善。可是,如果说以往几年的成功探索尚有指导作用的话,反意义和三螺旋药物将迅速得到改进。我们指望这类药物有朝一日将被普遍用于治疗像很多病毒和遗传病这样的疾病;但也要看到也许此法医治无效也是存在的。
请 登录 发表评论