曾一度被轻率地视为不可能存在的蛋白粒子,现在已被公认为一种不同寻常的致病因子,是众多的传染性、遗传性和自发性疾病的病因。
15年前,当我提出引起动物和人(比较少见)的中枢神经系统变性疾病的传染性因子可能是由蛋白质组成而不是别的什么东西时,人们对此极为怀疑。在那个时候,这一见解无异是一种左道邪说。生物学的教条认为传染性疾病的传播因子必须具有由核酸(DNA或RNA)组成的遗传物质才能在宿主体内建立感染。即使最简单的微生物中的病毒也要依靠核酸去指令为存活和繁殖所必需的蛋白质的合成。
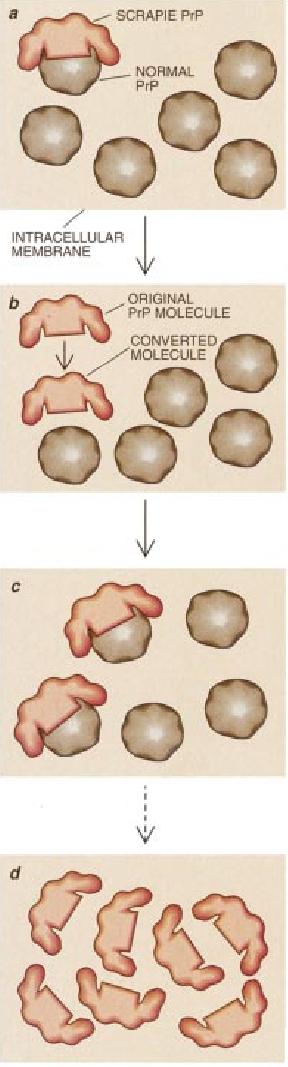
后来,我的同事和我指出,这些蛋白质类传染性粒子(我把这种致病因子简称为“prions”,即蛋白粒子)可能是遗传性以及传染性疾病的病根之后,许多科学家对此也同样是半信半疑的。当时的医学科学还不知道蛋白粒子的这种双重行为。因此当我们做出关于蛋白粒子能以令人难以置信的方式增殖的结论时,再一次遭到人们的反对。我们提出的蛋白粒子的增殖方式是:蛋白粒子诱使正常的蛋白质分子改变其形状后,即可将其转变成致病性分子。
但是在今天,大量的实验数据和临床数据已经使人确信我们在所有上述三个问题上都是正确的。蛋白粒子确实能引起蛋白质构型的传染性和遗传性病变。蛋白粒子还能引发在个体间既无传染迹象,也无遗传迹象的散发性疾病。此外,有迹象表明,迄今为止研究过的致病性蛋白粒子也许不仅仅就这么一些。由完全不同的蛋白质构成的蛋白粒子,也许就是常见于人体的另一些神经变性病的罪魁祸首。它们甚至还可能引发侵袭肌肉的疾病。
有时把一些已知的蛋白粒子病(都是致病的)称为海绵状脑病。之所以取这个名称是因为这类病经常会使脑子变成带有无数小孔的筛子。这些可能潜伏数年(在人体内甚至潜伏数十年)的病在动物中极为流行。
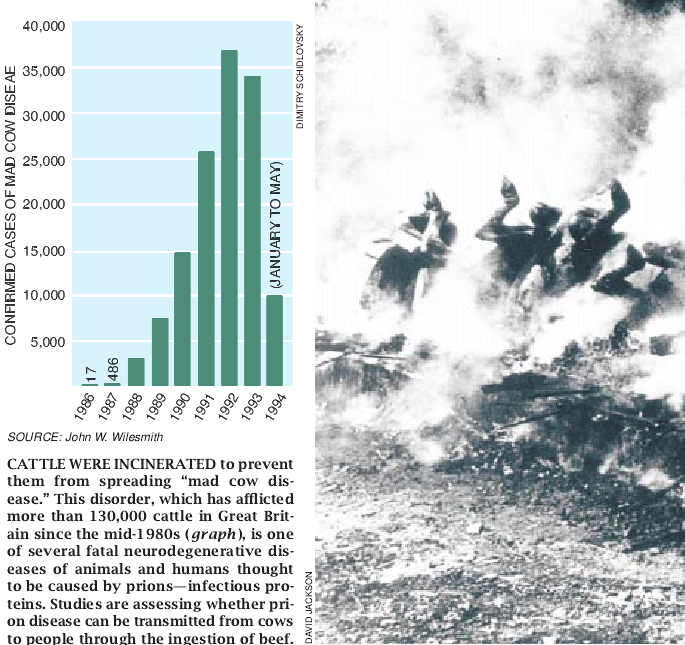
最常见的形式是见于绵羊和山羊的痒病。害病的动物丧失了协调性,甚至丧失体能到站立不住的程度。它们还变得烦躁,有时会感到奇痒难熬而把身上的毛都磨脱,因此名为”痒病”。动物的另一些蛋白粒子病的名称是:传染性水貂脑病、杂种鹿和驼鹿的慢性消瘦症、猫的海绵状脑病以及牛的海绵状脑病。牛的海绵状脑病通常被称为疯牛症,是最使人担心的一种病症。
英国Weybridge中心兽医实验室的Gerald A. H. Wells和John W. Wilesmith在1986年确诊出了这种病。当时该病已经开始侵袭英国的牛,使得病牛丧失协调性并变得惊恐不安很快就追踪到发生这种流行病的病源是牛的饲料添加剂:饲料添加剂里有死绵羊的肉和骨粉。在70年代末已经改变了绵羊屠体的处理方法。在新方法理应已经消灭了饲料添加剂中痒病因子的地方,现在看来这些致病因子并没有消灭。英国政府在1988年下令禁止使用动物性饲料添加剂,这种流行病的髙峰期可能就此结束了。尽管如此,许多人仍在担心他们因为吃过病牛的肉而逃不脱得病的厄运。
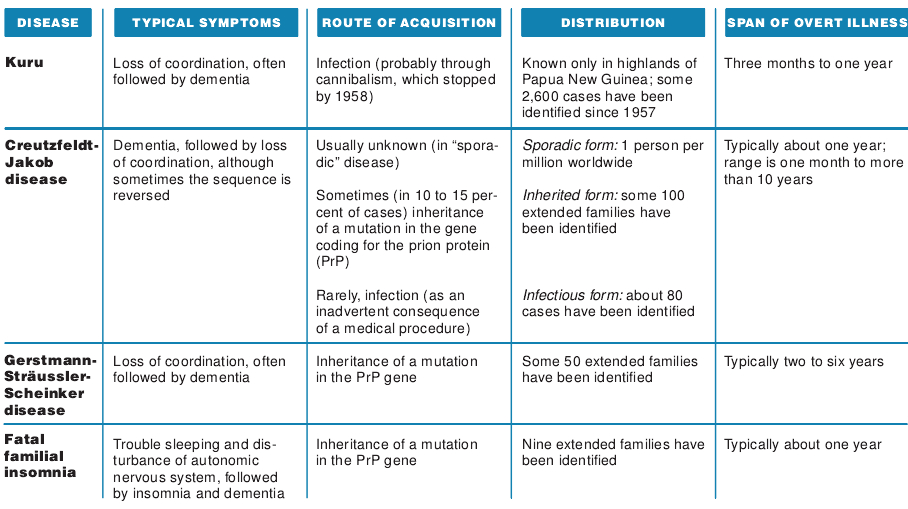
人蛋白粒子病的起因更是扑朔迷离的。库鲁病(Kuru)只见于巴比亚新几内亚福雷族的高地居民。他们把这种病叫做“笑死症”。澳大利亚公共卫生管理局的Vincent Zigas和美国国家健康研究所的D. Carleton Gajdusek在1957年曾描述过这种病。他们指出许多得了这种奇怪的致命性疾病的髙地居民的症状是共济失调,而且随后都变成痴呆。这些患者可能是通过一种食葬仪式后罹患库鲁病的:据报导,福雷族人在这种仪式上要吃掉死者的脑子以示悼念。自从这种习俗被制止后,库鲁病实际上也就消失了。
与此相反,克罗伊茨费尔特-雅各布综合症(这是一种罕见的、致命的、可传染的海绵状毒性脑病,发生在中年,锥体和锥体外系统部分变性,伴有进行性痴呆,有时肌肉消瘦、震颤,指痉病以及阵挛性口吃,也称痉挛性假麻痹——译者注),则世界各地都有,而且通常表现为痴呆。这种病多半是散发性的,罹病率是百万分之一,串者通常在60岁左右。大约有10-15%病例是遗传性的,可悲的是,还有很少一部分是医源性的:因为治疗其他病而意外感染到的。医源性克罗伊茨费尔特-雅各布综合症的传播渠道看来是角膜移植,脑内硬脑膜或脑电图电极的植入,不慎使用了污染的外科器械以及注射了取自人垂体的生长激索(在重组的生长激素没有上市之前常用此种激素)。
人类还有两种疾病是格斯特曼综合症(表现出共济失调和小脑受损的其他症状)和致命的家族性失眠症(表现为难以入睡而导致痴呆)。这两种病通常是遗传性的,而且一般都在中年发病。致死的家族性失眠症是最近才被博洛尼亚大学的Elio lugaresi和Rosella Modori以及Case Western Reserve大学的Peiriuigi Gambetti发现的。
我最早注意到蛋白粒子病是在1972年,当时我是加利福尼亚大学旧金山分校医学院的一名神经学住院医生。那时我没有治好一名克罗伊茨费尔特-雅各布综合症患者。我在查阅了有关这种病以及与此相关的一些病的文献资料之后,了解到痒病、克罗伊茨费尔特-雅各布综合症以及库鲁病都是可以传染的。只要把有病动物脑子的提取液注入健康动物体内即可传染。看来,感染是由一种作用缓慢的病毒引发的,但是至今还没有人能够分离到这种罪恶的致病因子。

在阅读文献的过程中,我看到了一篇使人惊异不止的报告。在这篇报告里,伦敦Hammersmith医院的Tikvah Alper和她的同事们指出,痒病的病原体可能没有通常可被紫外线或离子辐射降解的核酸。当患有痒病的动物脑子提取液中的核酸经紫外线或离子辐射处理而看来已遭破坏后,这种提取液仍保持传播痒病的能力。如果这种有机体确实沒有DNA和RNA,那么这一发现将意味着该病原体既非病毒,也非任何其他已知类型的传染病原体,因为所有的传染病原体都含有遗传物质。那么它是什么东西呢?研究人员有许多设想——甚至开玩笑地把油毡等物也包括进去了——但是没有肯定的答案。
我于1974年在医学院里建立了一个实验室后,就迫不及待地着手解开这个谜。第一步是技术性的:把痒病动物脑子里的传染性物质纯化到能分析其组分的程度。这项工作使人望而生畏:过去有许多研究人员都试图这样做,但都失败了。而我是初生牛犊不怕虎。迎接了这场挑战。到1982年,我的同事和我取得了很大的进展:取得了几乎只含传染性物质的仓鼠脑的提取液。此外,我们对这些提取液进行了一系列试验,以揭示其致病成分的组成情况。
我们所有的研究结果都得出了这样一个令人吃惊的结论,即痒病(可能还有与此相关的其他疾病)的传染因子确实没有核酸,而且其主要的(即使不是唯一的)组成成分是蛋白质。我们推测,之所以没有见到DNA和RNA是因为我们和Alper—样,证明了各种已知能破坏核酸的处理方法都没有减弱其感染性能。我们还知道蛋白质是其必不可少的组分,因为能使蛋白质变性(展开)或把它降解的各种处理方法都能减弱它的感染性能。因此,我引用“蛋白粒子”一词来把这类病和由病毒、细菌、真菌以及其他已知的病原体传染的疾病区分开来。在此之后不久,我们就确定了痒病的蛋白粒子含有一种蛋白质。我们把这种蛋白质称之为“蛋白粒子的蛋白质”(“prion protein”),简称PrP。
现在,主要的问题出现了。规定PrP氨基酸序列的指令在哪里?和PrP—起移动而难以测出的DNA片段把指令带到哪里?或者说,也许它们包含在隐藏于细胞染色体里的某个基因内的什么地方?解开这个难题的关键是1984年鉴定出了PrP蛋白质一端的大约15个氨基酸。我的研究小组和加州理工大学Leroy Hood的研究小组合作鉴定了这一短短的氨基酸序列。

搞清楚这一序列后使我们和另一些研究人员得以构建出一种分子探针。这种分子探针能指出哺乳动物细胞是否携带PrP基因。在苏黎士大学Charles Weissman实验室工作的Bruno Oesch用我们小组制造的探针证明仓鼠细胞确实含有PrP基因。大约在同一时候,Rocky Mountain实验室的Bruce Chesboro制成了他自己的探针并证明小鼠的细胞内也藏有这种基因。这项研究使大家有可能分离出这种基因并证明它并不存在于蛋白粒子里,而是存在于仓鼠、小鼠、人以及其他所有检验过的哺乳动物的染色体里。此外,这些动物通常都制造PrP,但不会得病。
上述研究结果的一种解释是我们犯了一个严重的错误:PrP和蛋白粒子病没有关系。另一个可能是产生的PrP可能有两种类型:一类是致病的,另一类是不致病的。我们很快就证明后一种解释是正确的。
重要的线索是这样一个事实,即在受感染的脑子里发现的PrP抵制了细胞酶(蛋白酶)的分解作用。细胞里的大多数蛋白质都很容易被降解。因此我推测如果真有正常的,非致病型的PrP的话,那么它也一定是很容易被降解的。我实验室的Ronald A. Barry验证了这种假想的对蛋白酶敏感的类型后就搞清楚了引发痒病的PrP是正常蛋白的变型。因此我们把正常的蛋白叫做“细胞PrP”,而把传染性(抗蛋白酶的)的类型叫做“痒病PrP”。现在通常用“痒病PrP”一词来表示可引发人和动物所有的痒病的蛋白粒子的蛋白质分子。
早些时候,我们曾希望利用PrP基因使之产生PrP的纯拷贝。下一步我们就可以把这种蛋白质分子注入动物体内,以确信其没有染上形迹可疑的病毒。如果这样的注射引发了动物的痒病,那么我们就可以证明这些蛋白质分子正如我们所推测的那样,是能够传染疾病的。但是在1986年之前我们知道这项研究计划是不可能实现的。原因之一是,很难诱导基因去制造研究工作所需要的大量PrP。原因之二是,生产的蛋白质是正常的细胞型。幸运的是,我们在另一项研究课题的启发下,找到了另外一种方法,可用来证明蛋白粒子不需要任何核酸的帮助就能够传染痒病。
在许多情况下,人的痒病状疾病并不是在宿主之间相互传播的情况下患病的,而且在有些家族里,这类病显然是遗传的。研究人员现在知道大约10%的人蛋白粒子病是家族性的,可波及罹病家族的半数成员。正是这后一种情况引起了我们的注意,那些蛋白粒子是否有可能比我们原先想象的更不同寻常呢?这些蛋白粒子是不是既能引发遗传性疾病,又能引发传染性疾病呢?
1988年,我实验室的Karen Hsiao和我揭示了一些最早的资料,表明人蛋白粒子病肯定是可以遗传的。我们从一名有格斯特曼综合症家族史而且自己也因患该症而濒死的人身上取得了PrP基因的克隆。我们把这些PrP基因和取自健康人群的PrP基因作比较后,发现了一种叫做点突变的微小异常性。
搞清楚这种突变的性质,有助于了解有关基因构造的一些情况。基因是由两股DNA结构模块(叫做核苷酸)组成的。这两股模块携带着不同的碱基。一股上的碱基与另一股上的碱基相结合而形成碱基对,即家族DNA“阶梯”上的“梯级”。这些碱基对除了连成DNA“阶梯”外,还把必须串连在一起才能形成特定蛋白质的氨基酸拼接成一个序列。三个碱基对在一起(这个单元叫做密码子)确定一个氨基酸。我们这位濒死的病人只有一个碱基对(750多个碱基对中的一个)被另一碱基对置换了,而正是这样的置换改变了密码子102携带的信息,而使这位病人的PrP蛋白中的脯氨酸被亮氨酸置换了。
我们在伦敦Northwick Park医院的Tim Crow和哥伦比亚大学的Jurg Ott及其同事们的帮助下,在从许多格斯特曼综合征病人身上取得的基因中发现了同样的突变,因此证明罹病家族中的高发病率在统计上是非常明显的。换句话说,我们确定了突变和这种疾病之间的基因联系——这一发现令人信服地表明突变是该病的病因。在过去的6年里,在一些患有遗传性蛋白粒子病的家族里报导了18种突变,现在已经收集到足够的病例可以确定其中5种突变的基因联系。
突变的发现使我们得以消除核酸与蛋白粒子蛋白一起运行并引导其增殖的可能性。现在我们能够制造出遗传上被改变了的携带突变的PrP基因的小鼠。如果这些“转基因”小鼠中有已改变了的基因存在,自然而然地就会导致痒病。而且这些转基因小鼠的脑组织接着又在健康小鼠身上引发了痒病的话,那么我们就可以有力地证明,由突变基因编码的蛋白质是唯一的传染因子。我和我实验室的Stephen J. De Almond以及其他人进行的研究已经证明,痒病可能就是通过这一途径发生和传染的。
上述的动物研究结果和国家健康研究所的Gajdusek、Colin L. Master以及Clarence J. Gibbs,Jr.等人在1981年取得的结果很相似,当时他们显然是把遗传的格斯特曼综合征传染给猴子。这些结果也和日本福冈九州大学的Jun Tateishi和Tetsuyuki Kitanvoto的发现很相似,他们把遗传性的克罗伊茨费尔特-雅各布综合征传染给了小鼠。把这些有关传染性的研究综合在一起有力地证明,归根结底,蛋白粒子确实代表了一类从未见过的仅由被修饰的哺乳动物蛋白质组成的感染因子。这一结论是令人信服的,因为事实表明,尽管人们竭尽全力地探索痒病特异的核酸(特别是多塞尔道夫Heinrich Heine大学的Detley Riesner进行的研究),却并没有证明蛋白粒子附有这样的遗传物质。
那些仍然倾向于病毒论的科学家们也许会说我们还没有证明我们的论点。如果PrP基因编码了(在突变后)可助长由无处不在的病毒引起的感染,那么突变必将导致病毒对脑子的感染。那么,注射取自突变动物的脑提取液理应能把这种感染传给另一个宿主。但是,由于没有见到任何病毒,所以这种假设看起来是站不住脚的。
我们除了证明蛋白质不用核酸帮助就能增殖并引发疾病外,还了解有关痒病PrP在细胞内传播的一些情況。许多细节还待详细的研究,但是有一点是相当清楚的,即正常PrP和痒病PrP之问的主要区别是构型。很明显,痒病蛋白质自我传播的方法是接触正常的PrP分子后以某种方式使后者展开,使其由原来的构型变成痒病分子的形状,这种变化会启动一连串的过程,在此过程中新转化的分子会改变其他正常PrP分子的形状,并以此方式连续进行下去。这些变化显然都发生在细胞内部的膜上。
由于另一些乍一看来似乎未必会存在的可能原因,我们开始认为细胞PrP和痒病PrP类型之同的差异必定是构型上的。例如,人们早已知道,感染型往往有着和正常型相同的氨基酸序列。当然,原先的相同的分子后来可能在化学上被修饰而改变其话性。但是,我实验室的Neil Stahl和Michael A. Baldwin进行的大量研究并没有发现这类差异。
一种蛋白,两种形状
正常型PrP和痒病型PrP究竞有什么不同呢?我们小组的Keh-Ming Pan进行的研究指出,正常蛋白质的主要组成是α螺旋,也就是蛋白质主链缠绕成特定型螺旋所在的那些区域:而痒病型则包含β链,也就是主链完全伸展开来的那些区域。这些链集合在一起形成β片。在加利福尼亚大学旧金山分校指导着另一个实验室的Fred E. Cohen试图利用分子模型化手段根据正常蛋白质的氨基酸序列来预测其结构。他的详细分析暗示蛋白质可能折叠成其核心内有四个螺旋的紧凑的结构。关于痒病型PrP采取的结构还知之甚少。
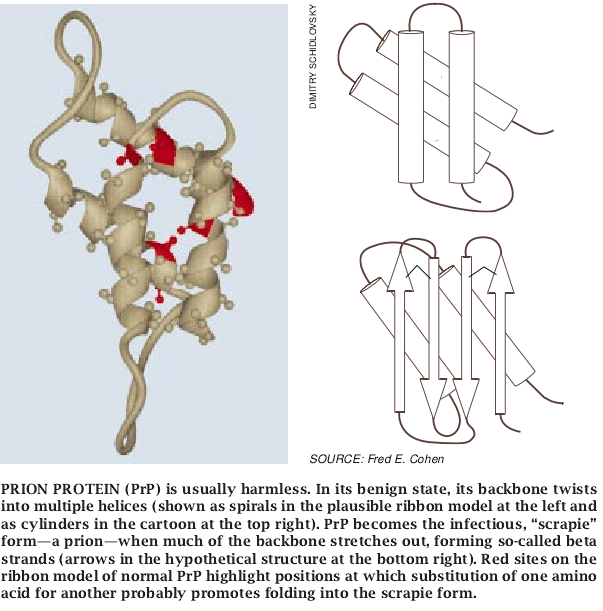
我们实验室的研究人员所作的两项重要的研究证明这样一种看法,即痒病PrP能诱导α螺旋的PrP分子转变成β片。Maria Gaset了解到,相应于公认的PrP四个α螺旋区中三个区的合成肽(小段氨基酸)能折叠成β片,而Jack Nguyen则证明这类肽在其β片构型中能利用螺旋形肽上的β-片结构。最近,据Rocky Mountain实验室的Byron Caughey和麻省理工学院的Peter T. Lausbury报导,在试管里把细胞的和痒病的蛋白混在一起可使细胞PrP转变成痒病PrP。
由突变基因产生PrP分子不会在合成后立即采取痒病分子的构型。不然的话,携带着突变基因的人在儿童期就该发病了。我们推测,PrP基因的突变使产生的蛋白质易于从α-螺旋形变成β-片形。这些分子中的某个分子也许需要一定的时间才会自发地彻底转变,而痒病PrP则需要更多的时间才能积累并损伤脑子而达到足引发症状的程度。
Tred Cohen和我认为,我们也许能够说明为什么已见之于PrP基因的各种突变能促使其折叠成β-片形。许多人基因的突变都导致在四个公认的螺旋里或在其周边有一个氨基酸被另一氨基酸所取代。在这些位置上插入一个错误的氨基酸,可能使某个螺旋动摇,从而使受到影响的螺旋和其近邻更易于再折叠成β-片构型。与此相反,我们实验室的Hermann Schatzel则发现把人的PrP基因和猿和猴的PrP基因区别开来的无害的差异,会影响位于假想的螺旋区之外的氨基酸——在这些区域里,岐异的氨基酸也许不会严重影响螺旋区的稳定性。
没有人确切地知道痒病PrP的传播是怎样损害细胞的:在细胞培养物里,正常的PrP是在神经元里转化成痒病型的。在此之后痒病PrP即积累在叫做溶酶体的细胞小囊里。在脑子里,胀满的溶酶体理所当然地可能爆裂而损伤细胞。有病的细胞死亡后会在脑子里形成空洞,而它们的蛋白粒子就会被释放出来袭击其他细胞。
我们确实知道正是痒病PrP的裂解产生了PrP断片,这些断片在有些病人的脑子里积累成斑块。这些类似斑块的聚集物也出现在阿尔茨海默氏病患者的脑子里,但是该病患者脑子里的团块是由另—种蛋白质组成的,PrP斑块是一种有利于诊断蛋白粒子感染的征兆,但是看来并不是疾病的主要起因。脑子早在斑块出现之前就开始机能失常了,而且在大部分时间里根本不出现斑。
尽管迄今为止我们还很不了解PrP痒病是怎样危害脑组织的,但是我们能够预见到,只要搞清楚PrP蛋白的三维结构,就能找到治疗方法。举例来说,如果PrP的四螺旋束模型是正确的,那么开发药物的研究人员也许就能够设计出一种应能结合中心凹的药物,而这种中心凹可能就是由四螺旋形成的。药物的这种结合作用将能稳定这些螺旋而防止其转化成β-片。
Weissmann和他的同事们利用基因打靶技术建立了一种没有PrP基因、因而不能制造PrP的小鼠。这项研究激发了另一种治疗设想。使某个基因失去作用并记录下由此引起的后果后,往往可以推断出该基因的蛋白质产物惯常的功能。但是在这项研究中,缺少PrP的小鼠并没有显示可检测到的异常现象。如果这一结果可以证明PrP真是可有可无的,那么医生们总有一天将可考虑对蛋白粒子病患者的脑子施行所谓的反义(即抗基因)的治疗方法。这种治疗方法的目的是阻止基因去生产不需要的蛋白质,从而有可能制止细胞PrP的产生。
值得指出的是,这种没有PrP基因的小鼠提供了可向蛋白粒子假设提出挑战的好机会。如果这些小鼠在接种蛋白粒子后都得病了,那么它们的病将表明蛋白粒子即使在预先没有大量PrP分子的情况下也能增殖。正如我所预料的那样,接种蛋白粒子后并没有引发痒病,而且也未能检测到蛋白粒子的复制。
关于痒病PrP怎样复制并引发疾病的这个谜,并不是正在着手搞清楚的唯一的一个难题。另一个长期以来悬而未决的问题是由单独一种蛋白质组成的蛋白粒子的作用怎么如此变化多端。人们也已经在开始解答这个问题了。英国康普顿农业研究委员会的Ian H. Pattison最先提醒人们注意这个现象。几年前,他从分开的两组山羊身上取得了蛋白粒子。第一组的分离物使接种后的山羊昏昏欲睡,而第二组的分离物则使接种后的山羊机能亢进。同样,现在也已经清楚,有些蛋白粒子能迅速致病,而另一些蛋白粒子的致病作用却是缓慢的。
爱丁堡动物健康研究所的Alan G. Dickinson,Hugh Fraser和Moira E. Bruce检验了不同的分离物对小鼠所起的不同作用。他们注意的只是多株系中含有核酸病原体的那一类。因此,他们断言,蛋白粒子“株系”的存在表明蛋白粒子假设必定是错误的:痒病及其相关病的病根必定是病毒。但是,正因为寻找病毒核酸的一切努力都毫无结果,所以在我看来,关于蛋白粒子变异的解释一定要到其他方面去找。
一种可能是,蛋白粒子能够采取多种构型。蛋白粒子用一种方式折叠也许能高效地使正常的PrP转化成痒病型,因此潜伏期短:而若以另一种方式折叠,其作用则很难有效。同样,一个“构象异构体”可能粘附脑的某一部分里的神经元群上,而另一个则可能粘附在别处的神经元上,从而产生不同的症状。考虑到PrP至少能以两种方式折叠,所以如果发现它还能折叠成另外一些结构,也就不会令人感到惊奇了。
我们从80年代中期起就探明了一种叫做痒病屏障的现象。这一概念所指的事实是因为存在着某种因子,所以由一种动物产生的蛋白粒子很难使另一种动物得病。今天,由于疯牛病在英国的流行,人们极为关注这种妨碍种间传染的因子。我们和另一些研究人员一直在努力探究这样的种间屏障是否稳固得足以防止牛把蛋白粒子病传染给人。
打破屏障
这类屏障是由Patten发现的:他在60年代发现痒病很难在绵羊和啮齿动物之间传染。为究其原因,我的同事Michael R. Scott和我在晚些时候得到了一种转基因小鼠。这种小鼠可表达叙利亚仓鼠的PrP基因,也就是说能够制造仓鼠的PrP蛋白。这种小鼠的基因和仓鼠基因的区别在于254个密码子中的16个密码子。接种了仓鼠蛋白粒子的正常小鼠很少会得病,但是转基因小鼠却在大约2个月里得了病。
因此我们的结论是,我们把仓鼠基因插入小鼠体内后就打破了种间屏障。此外,我们在该实验和另一些实验的基础上意识到屏障存在于PrP的基酸序列中:痒病PrP分子的氨基酸序列越相似于其宿主PrP的氨基酸序列,宿主越容易感染蛋白粒子病。例如,我们在这类实验中,有一次试验了除自身的小鼠PrP基因外,还携带叙利亚仓鼠PrP基因的转基因小鼠。这些小鼠既制造仓鼠的正常型PrP,也制造小鼠的正常型PrP。当我们把小鼠的蛋白粒子接种给这些小鼠时,它们就制造更多的小鼠蛋白粒子,而当我们把仓鼠的蛋白粒子接种给它们时,它们就制造仓鼠的蛋白粒子。我们根据这种行为了解到蛋白粒子优先和组分相同或相似的细胞PrP相互作用。
痒病PrP对氨基酸序列相同的细胞PrP具有吸引力这一点,也许可以说明在英国为什么痒病会通过含有绵羊组织的饲料传染给牛的:因为羊的PrP和牛PrP只有7个位置上有差异。与此相反,人PrP和牛PrP之间氨基酸序列的差异极大:这两类分子在30多个位置上有差异,正因为差异极大,所以看来痒病是不大可能由牛传染给人的。和这一判断相一致的是牛津大学的W. Brian Mathews教授在流行病学研究中没有发现绵羊的痒病和养羊地区出现克罗伊茨费尔特雅各布综合征之间有什么联系。
但是,最近却有两位在其拥有的牛群中,有“病牛”的农场主死于克罗伊茨费尔特-雅各布综合征。他们的死也许和这种牛的流行病毫无关系,但是这一情况引起了人们的警觉。对于打破种间屏障来说,PrP分子的某些部分有可能比另一些部分更具重要作用。如果真是这样,而且如果牛的PrP在其氨基酸序列的关键区域和人的PrP极为相似的话,那么也许会发现,传染的可能性比原来只比较整个氨基酸序列时所表明的要大。
在有关种间屏障的研究出现转机后,我们就开始考虑PrP分子的某些部分可能对痒病传播的种间屏障起着特别重要的作用。我的同事Glenn C. Telling建立了携带杂交PrP的转基因小鼠。这种杂交PrP基因是由与小鼠密码子两侧相接的人密码子组成的:它能产生杂交蛋白质。然后他把从死于克罗伊茨费尔特-雅各布综合征或格斯特曼综合征的病人那里取得的脑组织注入该转基因小鼠体内。说来也怪,这些小鼠得病的频率和速度都高于携带完整的人PrP基因的小鼠。这种基因在氨基酸序列的28个位置(都在中心区之外)处都不同于小鼠基因。这一研究结果意味着PrP分子中心区里的同一性也许比其他片段里的同一性更为关键。
上述结果还证实了早些时候由DeArmond实验室的Shu-Lian Yang和我们小组的Albert Taraboulous揭示的一些情况,即由宿主制造的分子能影响痒病PrP的行为。我们推测,在杂交基因研究中,某种小鼠蛋白(可能是通常参与折叠新生蛋白链的一种“随体蛋白”)识别出了杂交蛋白中来自小鼠的两个区段之一。这一随体蛋白和那个区段相结合,井协助把杂交分子再折叠成痒病构型。这种随体蛋白在能制造完整的人PrP蛋白的小鼠体内不起类似的协助作用,也许是因为人蛋白没有可供小鼠因子结合的位点。
最近,人们在对能够制造大量正常PrP蛋白的转基因小鼠进行研究后,发现了一个未曾预见到的情况。我们研究小组的DeArmond、David Westway和蒙大拿州Great Falls的McLaughlin实验室的George,Carlson因为发现有些老的转基因小鼠得了一种症状表现为强直和舐毛减少的病而感到迷惑不解。我们在査找其病因时,发现制造过量的PrP最终会导致神经变性并令人惊异地破坏肌肉和末稍神经。这些发现扩大了蛋白粒子病的范围,因而推动了对影响末梢神经系统和肌肉的人蛋自粒子病的研究。
对过量生产PrP的动物进行的研究还带来了另一好处。这些研究提供了关于散发性克罗伊茨费尔特-雅各布综合征怎样会发生的线索。有段时间我曾推测人开始得散发性疾病可能是因为衰老和情绪大起大落而导致机体的至少一个细胞里的PrP基因发生了突变。这种突变了的蛋白质最终有可能启动痒病型PrP并逐渐在机体内传播开来,直至痒病蛋白集结量超过极限而发病。用小鼠进行的研究启示我们,百万人中有一个会得散发性克罗伊茨费尔特-雅各布综合征,在他生命的某个时刻,其细胞PrP有可能自发地转化成痒病型。实验还指出这样一种可能性,即得了克罗伊茨费尔特-雅各布综合征的人会过量生产PrP,但是,事实上我们至今还不知道是否确实是这样。
迄今为止,所有已知的人蛋白粒子病一直是用小鼠作为模型来研究的。我们通过最近的研究工作意外地开展了散发性蛋白粒子病的一种动物模型。用取自痒病动物和克罗伊茨费尔特-雅各布综合征患者的脑提取液接种的小鼠,长期以来一直被作为传染型蛋白粒子病模型的,而遗传性蛋白粒子病则是以携带突变PrP基因的转基因小鼠作模型的。人蛋白粒子病的这种小鼠模型不仅应能使我们深入了解蛋白粒子怎样引发脑变性,而且还应该为评价这些破坏性疾病的治疗方法提供方便。
当前正进行的研究还有助于确定由另一些蛋白质组成的蛋白粒子是否在更为常见的一些神经变性疾病中起作用。这些疾病包括阿尔茨海默氏病、帕金森氏病和肌萎缩性侧索硬化症。在所有这些疾病中有某些明显的相似性。和已知的蛋白粒子病一样,较为普遍的疾病绝大部分是散发性的,但有时候却反复出现在家族中。所有的病通常都发生在中老年时期而且表现出相似的病理学;神经元变性、蛋白质沉积物可能积累成斑块、支持和滋养神经细胞的胶质细胞由于神经元受到损伤而增大。令人惊奇的是,在这些疾病中没有一种病表现出有白细胞(免疫系统的常备军)渗入脑部。如果是病毒在这类病中起作用,理当出现白细胞的。
在酵母中的最新发现佐证了这样一种推测,即可能存在着就氨基酸序列来说和PrP蛋白无关的蛋白粒子。据国家健康研究所的Reed B. Wickner报导,有一种叫做Ure2p的蛋白质有时可能会改变其构型,从而影响其在细胞中的活性。这种蛋白成某种形状时是活跃的,而成另一种形状时则是静止的。
综上所述,可以令人信服地表明蛋白粒子是一类前所未见的传染性病原体,而且蛋白粒子病是由蛋白质构型畸变而引发的。现在还不知道蛋白质形状的变化是否也引发像阿尔茨海默氏病这样常见的神经变性病,但是切不可忽视这种可能性。
【颂平/译 赵裕卿/校】
请 登录 发表评论