一些称为DNA微阵列的研究手段正在弄清健康和疾病的分子根源,加快药物开发的步伐。在追求使用个性化治疗方案取代千篇一律的治疗方法的过程中,这些研究的进展也可以促使这样的日子早日到来。
饱受弥散性大B细胞淋巴(组织)瘤这种癌症煎熬的大多数患者最初通过常规疗法均取得良好疗效。然而过不多久,对半数以上的患者而言,这种癌症又复发了,并导致了致命的后果。针对一些患者很快死亡而另一些患者却活得很好这一现象,医生们早就推测出其中的原因是因为该疾病是由不同的分子异常引起的,表现形式多种多样。但是就在2年以前,研究人员还无法识别出哪些人患了最致命的弥散性大B细胞淋巴瘤,而这些人病情最危险且最需要特别的治疗措施。
后来一种称为DNA微阵列或DNA芯片的神奇疗法打破了这一怪圈。来自美国国立卫生研究院、斯坦福大学等单位的研究人员组成的一个科研小组在诊断时利用了DNA微阵列,并从基于恶性细胞的数百种基因所展现出来的总体活动图谱的差异,分辨出了已知的长期幸存者和短期幸存者。这一成果应该可诞生出一种新的诊断方法,识别出哪些患者的危险性最大。
DNA微阵列1996年首次进入商业领域,现在是药物开发研究的主流方向,美国有20多家公司销售DNA微阵列,或销售破译DNA微阵列提供的信息所需的仪器或软件。这些工具还开始为科学家探索人体正常细胞如何活动以及疾病根源的分子异常的方式带来革命性变化;也有望为更快更准确诊断众多疾病铺平道路,从而帮助医生实施个体化医疗方案,也就是根据每个患者的确切疾病类型进行针对性治疗,选择疗效可能最好而副作用最小的药物。
微小的主角
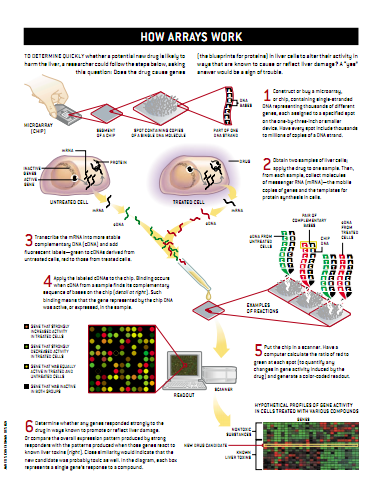
微阵列多种多样,但都能判断组织样本的遗传物质组成,并且都由一些单链DNA分子(探针)组成,这些DNA分子探针通常镶嵌在不到大拇指印大小的晶片上。这些芯片还利用了一个非常方便的DNA特性——互补碱基配对。
DNA是组成人类细胞3万多个基因的物质,这些基因的编码序列构成蛋白质的蓝本。DNA由4个组件构成,而其组件通常由各自独特的化学碱基的第一个字母来表示,即A、C、G和T。一条DNA链上的碱基A只能与另一条DNA链上碱基T(A的互补碱基)配对而一条DNA链上的碱基C只能与另一条DNA链上的碱基G配对。
因此,如果组织样本中的一个DNA分子附着到具有ATCGGC序列的探针上,那么研究人员就能推断,样本分子具有互补序列TAGCCG。RNA(核糖核酸)与DNA(脱氧核糖酸)在化学分子上犹如堂兄弟,它在附着DNA时也遵从严格的碱基配对法则。因此也能推断出与微阵列上的DNA配对的任何RNA链的序列。
多年来,互补碱基配对反应已成为许多生物学检验的有机组成部分。然而令人惊讶的是,DNA微阵列在一个芯片上能同时跟踪数万个这类反应。能够进行这样的跟踪可能是因为:(1)每一种探针(一个基因或更短的密码序列)都会在芯片上的棋盘状栅格内的指定地方;(2)放到阵列上的DNA分子或RNA分子携带着能被扫描设备检测到的荧光标记物或其他标记物。一旦芯片被扫描,计算机就将原始数据转换成带色码的输出信息。

科学家利用DNA微阵列来实现两个截然不同的目的。一是所谓基因型应用,就是通过比较芯片上的DNA和组织样本上的DNA来确定样本中有什么基因或者破解尚未排序的DNA链的编码排序。然而更为常见的是,如今研究人员不仅用这些工具来确定样本的基因状况或基因排序,而且还用它们来表述这些基因的活动能力。当基因被转录成信使RNA(mRNA)并被转译成蛋白质时,就说该基因被表达了。mRNA是基因的移动转录本和蛋白质合成的模板。
基因猎人
研究人员已经采用基因方法来比较各种生物的基因(例如寻找生命进化历史的线索),比较肿瘤中的基因和正常组织中的基因的细微差异(以揭示基因构成或基因数量的极其细微的差异)。总有一天可以证明,在DNA芯片上进行基因比较对医疗也有实际价值。
例如,如果不能确诊流感样症状(诸如疼痛、高烧和呼吸困难等)患者的真正病因,精心设计的DNA微阵列就能揭示出其感染的准确原因。可以在表面布置DNA,而DNA表示只在选定的致病因子中出现的基因;医学实验室可以从感染组织样本中提取DNA并对它进行标注(该组织也许取自人们的鼻孔)。如果来自患者的组织样本中的DNA附着到精心设计的DNA芯片上的某些基因序列中,就能表明哪个致病因子在作怪。科研人员也可以利用这一技术开发出能感应某些敏感病菌的芯片,比如,如果恐怖分子在某个社区释救了特定炭疽菌或其他奇异病菌,这些芯片就能发出警报信号。
基因检测微阵列还能识别易患某些疾病的个体基因倾向性,姑且不论这种技术将来是否带来副作用。人们的大多数基因差异可能以单核苷酸多态性(SNPs)的形式表现出来,也就是一个DNA字母取代了另一个字母。通过制作携带疾病基因变体的芯片来揭示个体的SNP,就可以预见人们患阿尔茨海默病、糖尿病和特定癌症等疾病的可能性。这样,患病可能性最大的人就可以接受密切监控、精心预防照料和早期干预。当然,公众对这类检验是否感兴趣还是个未知数。而负面影响则是,这类信息有可能被雇主和承保人钻空子,实行歧视政策。
SNP芯片提供的其他有价值的信息对人们的精神状态、就业和保险利益不会造成任何威胁。人们携带的基因变体影响人体吸收它们所服的药物;反过来,这会影响药物的疗效和副作用的程度。突出显示人们独特基因敏感性的芯片将有助于医生针对每个患者选择疗效最佳而副作用最小的药物。显示肿瘤破坏性增加的基因突变的SNP芯片也有助于病理师对看起来呈良性实际上是否比显微分析结果更可怕的肿瘤进行确诊。这两种基因阵列疗法已处于医疗福祉方面的调查研究之中。
基因表达受到青睐
和上述应用同样激动人心的是,阵列还有另一项重要用途一一表达成像。过去几年间越来越多的研究人员为这项工作所吸引。检验室的工作人员通过测定组织样本中各种mRNA的多少来获得这类图像。一般而言,细胞产生的基因复本越多,它产生的蛋白质复本也越多;因此样本中各种mRNA的数量可以间接表明蛋白质的类型和数量。蛋白质常常会引起研究人员的兴趣,因为它们控制并参与人体细胞和组织内的大多数活动。能直接测定蛋白质水平的芯片目前正在开发之中(参见本文的附文“蛋白质阵列——一种新选择”),但要制作这种芯片还面临着很多挑战。如果将基因组当作传感器组件来测定细胞内各种基因的活动变化,科学家就能获得药物或疾病改变细胞功能的极为完美和详细的“快照”。实际上,有时候了解样本中基因活动的总体开闭方式可能比了解特定的基因对某些影响的开闭反应更有用。在这些情形下,开闭方式就是反映在某些特定条件下样本分子状态的“速记签名”。
业已证明,表达成像将在许多领域具有无法估量的价值。细胞生物学家喜欢表达成像,这是因为在人体组织受到疾病侵袭之后,认识了居于支配地位的蛋白质,就能深入了解机体组织是如何正常消除损害的,以及疾病发生时会出现什么乱子。
最近研究人员对人类细胞核中几乎所有的DNA进行了测序,结果发现了一些基因,细胞生物学家还利用表达阵列来了解这些基因的功能。虽然与微阵列无关的几种技术能够揭示出新发现基因(或更恰当地说是其所编码的蛋白质)所扮演的角色,但其测试效率及速度均不太理想。而表达阵列(关联方法)有助于填补这方面的空白,就算事先没有基因在人体中起作用的线索。
该方法源自任何基因都不是孤立存在这样一种认识。若组织中的众多基因一起对某种影响(比如药物、感染或其诱导的基因突变)做出开闭反应,研究人员就能推测那些喜动基因以相同的调节路径发挥作用。也就是说,基因共同或连续地诱导细胞反应。然后,研究人员就可以合理推断,原先神秘的成组基因的作用类似于其功能已知的基因。

开发药物的工具
药物开发研究人员也可以利用关联方法来发现在与疾病有关的生物路径中发挥作用的未知蛋白质。只要发现了这些蛋白质,就可以把它们列为开发新药或换代药物的靶标。举例来说,与本文作者同在Rosetta Inpharmatics公司共事的Peter S.LinsIey想识别对付炎症之新药物靶标,因为病人一旦得炎症,人的免疫系统就会出错,对身体的某些器官产生损害。他的目的是探究免疫系统白血细胞中是哪些基因同蛋白质白细胞介素2(IL-2.同炎症密切相关)的基因一起增加和减少蛋白质的数量。
Linsley是这样做的:制作白血细胞暴露于各种化学物质的表达成像,然后让计算机运行复杂的成像匹配程序来确定在IL-2基因激活的时候哪一组基因一直连通或关闭。该组基因中有一种基因,它在体内的功能用其他手段是确定不了的。大约在同一时期,巴黎巴斯德研究所的研究人员用其他方法独立证实,该基因在IL-2路径发挥作用。综合其他发现表明,该基因所编码的蛋白质可能是抗炎症药物的理想靶标。
制药科学家利用表达成像的另一种方式是挑选并排除可能产生无法接受的副作用的候选药物。例如研究人员若想确定给定的化合物是否会损害心脏,以及候选药物对心脏细胞的影响,可将心脏细胞在现有药物和其他化学物质作用下的表达成像汇编成册,通过计算机等检测设备将所得到的点阵图像同该表达成像集进行比较。如果其结果同已知对心脏细胞有害的物质所产生的成像吻合,这将是一个警告信号。
表达成像集还有助于解释药物为什么产生特定的副作用。例如目前的一个紧迫问题就是为什么蛋白酶抑制剂能导致血液胆固醇含量和甘油三酯含量增高、体脂再分布异常以及胰岛素抗性。蛋白酶抑制剂是艾滋病病毒(HIV)携带者的救命之物。由于认识到肝脏影响类脂(包括胆固醇和甘油三酯的一组物质)和相关蛋白质的产生和分解,Rosetta公司的有关人员(包括本文作者)与Abbott研发公司的Roger G.Ulrich领导的研究小组合作,决定看看ritonavir这种蛋白酶抑制剂是否会对肝脏产生某些副作用。
由十一个阵列就能表示大约25000个老鼠基因,我们制作了老鼠肝组织暴露于一类可能对肝脏产生毒性的化合物的表达成像。此后,我们对这些物质反应强烈的基因(大约2400个)的表达成像按照相似程度对化合物进行分组。接着将ritonavir用于老鼠肝脏,并将所得到的表达成像和先前得到的表达成像进行比较。
我们已经了解到,ritotmvir会活化通常对熟知的降脂剂没什么反应的基因;ritonavir还能降低蛋白质的产生,这些蛋白质通常合成了蛋白体。这些发现表明,ritonavir提高了肝脏的脂类含量,进而提高了血液的脂类含量;其部分原因是增强了肝脏合成脂类的能力,而抑制了肝脏分解含脂蛋白质的能力。进一步研究ritonavir同脂类产生路径和蛋白体产生路径相互作用的确切机理,将有助于找到降低ritonavir副作用的方法。
因人施治
DNA微阵列研究使分子成像成为可能,而分子成像技术的进步又使研发更多且副作用更小的药物成为可能。但是许多医生希望出现更好的结果——快速诊断工具,它们能将症状相似的患者分成不同的组别,从而通过采取不同的治疗方案使患者受益。正如本文开头提到的淋巴瘤研究所表明的那样,特别是治疗癌症的医生,他们十分渴望能找出从一开始就需要实施最大限度攻击性治疗的患者。
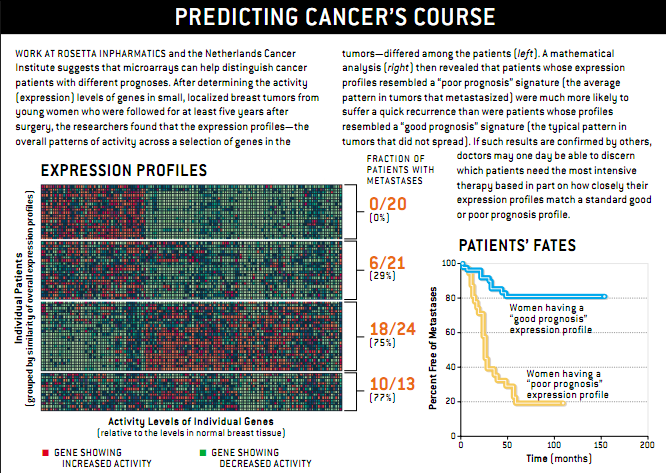
我们Rosetta公司的研发小组同荷兰癌症研究所进行合作,以乳腺癌治疗为研究对象,演示了表达阵列所起的帮助作用(参见本文附文“癌症隐患早知道”)。在这个项目中,我们想发明一种检验方法,它能确定手术后哪些年轻的早期乳腺癌患者需要进行系统的药物治疗以预防肿瘤扩散,哪些患者不需要进行系统的药物治疗。所谓早期乳腺癌是指淋巴结没有任何癌症的迹象。虽然现行的治疗方法推荐大约90%的这类乳腺癌患者进行系统的治疗,但是她们中的许多人甚至不进行这类治疗也可以避免将来扩散。不幸的是,一般检测手段无法识别出癌细胞扩散危险性最大的妇女。
我们从制作肿瘤的表达成像着手,肿瘤来自大约100名55岁以下的妇女,手术后至少对她们进行了5年的跟踪治疗。我们起初用的微阵列有25000个人类基因,最后我们发现,由大约70个基因产生的一个特定成像明显揭示出癌细胞转移很快就会发生。此外,相反的类型则强烈暗示预后良好。显然,有些肿瘤的编码指令序列决定它们在发育到半个硬币大小之前就要扩散,而另一些肿瘤的编码指令序列决定它们再大一点也不会扩散。
表达成像要成为乳腺癌检查的常规组成部分,我们的结果必须得到其他研究的证实。未来两年内,许多医疗中心开始将表达成像作为治疗多种疾病的一个引子,而不仅仅是针对进行乳腺癌的一个试验性治疗;其他疾病也需要这些改进的疗法。表达成像有助于将需要进行特殊治疗的那些哮喘、糖尿病和肥胖症等患者分成更细的类型。这方面的应用正在研究之中。
要完全发挥微阵列在研究和治疗方面的应用潜力还必须清除几个障碍。芯片、扫描设备和其他装备目前仍然很昂贵,许多资金不雄厚的研究单位对阵列只有羡慕的份。然而,可以预料成本会随着时间的推移而不断降低。
当然,就算价格降下来了,这些技术于初期在医生办公室或常规的医学实验室也很难行得通。拥有专用设备和掌握特定技能,并能用微阵列提供恰当的组织样本的医务人员或技术人员寥寥无几。此外,要根据肝细胞的基因表达变化来诊断肝脏疾病,理想的情况是医生需获得肝脏组织,而这种器官就很难轻易接近。
目前,这类问题就很棘手,但还是可以克服的。例如,用可以得到的其它组织替代某些无法获得的组织,这种情况也是可以接受的。此外,在某些情况下也不一定非要使用微阵列本身;微阵列可以为新的诊断检验提供一些研究信息,而检验方法则可以采用其他形式。
随着对细胞和整个身体活动的了解越来越深入,医务人员将能够进行更准确的诊断,为患者提供更精妙的治疗方案(可能也包括基因治疗)。根据个体的遗传背景和当时的心理活动状况进行针对性干预。可以想象,到2020年卫生保健等机构可能将其客户的个人分子状态模式(虚拟模拟)保存起来,这些模式可以根据微阵列、医生诊断数据和细胞生物学新信息随时更新。也许有些客户不喜欢这种做法并愿意放弃医疗费用方面的优惠,也极可能就放弃了最好的健康福祉,却保留了对隐私的那份珍爱。当然,赞成者更有可能成功地延缓衰老,过上更加健康的生活。
蛋白质阵列——一种新选择
N.Leigh Anderson和Gunars Valkirs
同DNA微阵列一样,蛋白质芯片(将蛋白质而不是DNA分子放置在微小表面上)也能测定组织的蛋白质水平。实际上它们的作用方式更直接,而且一些证据表明其结果更准确。蛋白质阵列还能单独解释组织中数以千计的蛋白质哪个和哪个相互作用。
蛋白质阵列的这些特性对生物学研究人员很有吸引力。但是,最有可能引起大家惊奇的是另一个原因——这类芯片将极大地扩大医生在办公室快速诊断的疾病范围。
蛋白质芯片是非常有用的诊断工具,部分原因在于:和DNA微阵列不同,它们能够从血浆中找到信息,而血浆很容易得到。传染病、引起心脏损伤或肾脏损伤的大多数疾病都以分泌蛋白质或渗透蛋白质的形式在血液中留下能够识别出来的蛛丝马迹。此外,一次检验就可以测定表明存在疾病的许多或全部已知蛋白质。相反,常规诊断检验一次只能测定一种或几种与疾病相关的蛋白质。
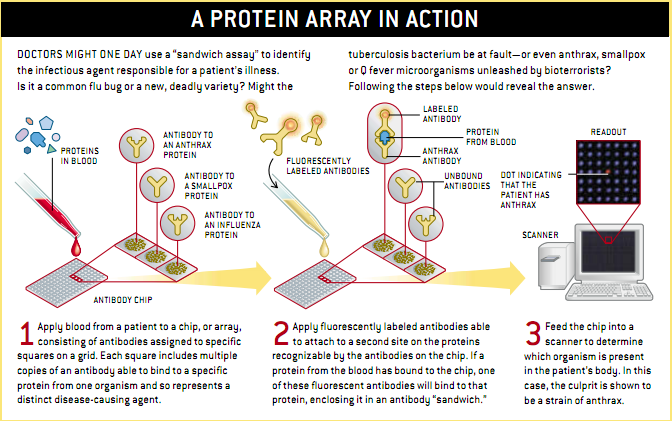
蛋白质设计与DNA芯片设计相类似。数百到数千个不同的蛋白质(数百万个复本)放到晶片上栅格内的特定位置。根据血液样本的蛋白质情况就能确定样本蛋白质的性质和数量。
芯片上蛋白质的种类因要解决的问题而定。但是最接近商业化(最初是研究人员使用)的芯片决定于非凡的免疫系统分子(也就是抗体)。每个抗体识别或附着一个特定的蛋白质,或更确切地说是蛋白质的特定片段。有些抗体芯片的作用方式被称为三明治法:由芯片识别的蛋白质被夹在两种不同抗体中间的,一种抗体紧紧抓往了蛋白质,另一种抗体把荧光标记和截获的菌株分子吸附在一起(参见下图)。
要完全发挥抗体芯片在研究和诊断应用方面的潜力,科学家至少必须消除两大障碍。一是要开发出同时大规模产生众多抗体(而不仅仅是紧密附着到一个靶标的抗体)的技术,一边揭示样本中哪怕是微小的数量。这个问题已在攻克之中。第二个障碍更关键。迄今为止,医学科学仅仅揭示了几十个能够表明疾病存在或演变的蛋白质,而总量也许有数千个。芯片制作者在知道找那些蛋白质之前,他们只能找组织样本中数目有限的疾病标记。可喜的是,目前许多研究人员正在猎寻新的疾病特征蛋白质。随着抗体制造和蛋白质发现的不断融合,必将诞生第二代蛋白质阵列,并将全面提升医学研究和临床实践的水平。
【冉隆华/译 李爱珺/校】
请 登录 发表评论