研究的蓬勃发展正在揭示癌症长期隐藏的分子基础——以及提出新的治疗方法。
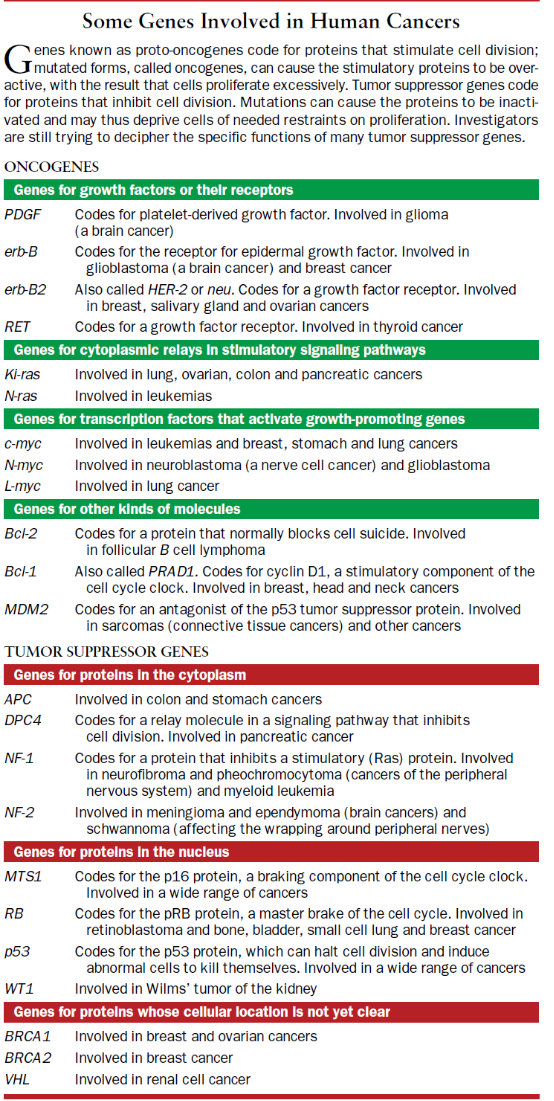
癌症怎样发生不再是秘密。在过去二十年里,研究人员在鉴定这一过程最深的基础——在分子水平上的基础——方面已取得了惊人的进展。这些发现是站得住脚的,它们将支持未来一代研究人员作详尽的研究,而且它们将形成彻底变革性治疗方法的基础。没有谁能准确地预测,目标对准癌细胞中分子变化的治疗在什么时候将获得广泛的应用,已知把新的认识转变成临床实践是复杂的、缓慢的而且是代价昂贵的。但是这种努力现在正在进行。
说实在的,“癌症”这一术语涉及到100多种形式的疾病。几乎身体中的每种组织都能引起恶性肿瘤,有的甚至产生几种类型的恶性肿瘤。而且,每种癌症有其独特的特征。不过产生这些不同肿瘤的基础过程似乎仍是十分相似的。由于这个原因,我将在本文中在一般意义上使用“癌症”这个术语,而借助一种类型或另一种类型的癌症去说明似乎是普遍适用的规律。
正常的健康人体内的300亿个细胞生活在一个复杂的、相互依赖的共管区域内,调节相互的增殖。事实上,正常细胞仅在其邻近的其它细胞指令其繁殖时才这么做。这种不断的协作确保每种组织保持适合身体所需的大小和结构。
与之成为鲜明的对比,癌细胞违背这一模式;它们变为对增殖的通常的控制装聋作哑,而是遵从它们自己内部的生殖日程。它们还具有一个更加狡诈的特性——能够从它们开始的位置转移,侵入邻近组织并在体内较远的位置形成团块。由这种恶性肿瘤细胞组成的肿瘤随着时间的推移变得越来越具攻击性,而当它们破坏这种生物作为整体的生存所需的组织和器官时它们就变成致死的。
这许多并不是新的知识,但是在过去20年里,科学家们已发现了一组控制着癌症发展的基本原理。我们现在知道,肿瘤细胞从一个共同的祖先细胞遗传下来,此细胞一般在肿瘤变为可触知的之前数十年的某个时候启动了一个不适当生殖的程序。此外,一种细胞的恶性转化是通过在其内部特异类型的基因之突变积累而发生的,这些基因提供认识人类癌症根源过程的关键。
基因由细胞核内染色体的DNA分子所携带,一个基因确定一种氨基酸的序列。这些氨基酸必须被连接在一起形成一种特殊的蛋白质,然后这种蛋白质执行该基因的任务。当一个基因被接入,细胞通过合成编码的蛋白质而响应,一个基因的突变能够以改变蛋白质产物的数量或活性而扰乱细胞。
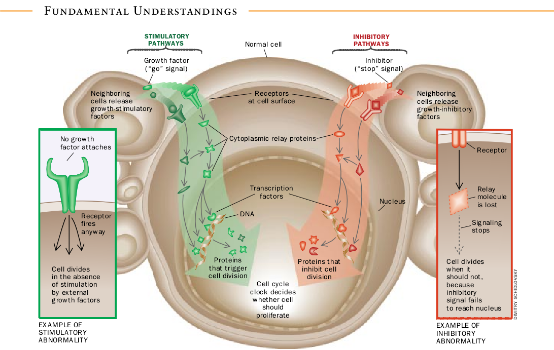
一起仅构成整个遗传组的小部分的两类基因在激发癌症中起主要作用。在它们的正常构型中它们设计细胞的生活周期——错综复杂的事件序列,在这些事件中细胞增大和分裂。原始致癌基因促进这种增长,而肿瘤抑制基因却抑制这种增长。这两类基因共同说明在人类癌症中所看到的许多失控的细胞增殖。
当突变时,原始致癌基因能够变为促进过度增殖的致癌的致癌基因。这种突变可以引起原始致癌基因产生太多的它的编码生长刺激性蛋白质或其过分活性的形式。相反,肿瘤抑制基因当它们因突变而失活时才产生癌症。所引起的功能抑制蛋白质的损失使细胞失去了阻止不适当生长的决定性制动器。
为了使癌性肿瘤发育,突变必须在6个或6个以上的打基础的细胞生长控制基因中发生。其它类型基因的变异形式也可能参与肿瘤的形成,其作用方式是特定地使增殖的细胞变成侵袭性的或使之能够扩展(转移)到全身。
发信号的系统出差错
突变的原始致癌基因和肿瘤抑制基因如何引起癌症的重要的线索来自对这些基因的正常对应者在细胞内所起作用的研究。在几乎研究二十年后,我们现在以从未有过的清晰度和详尽程度来观察这种正常的遗传功能。
许多原始致癌基因为分子“戽斗”(bucket brigades)中的蛋白质编码,这些分子“戽斗”将分子外的生长刺激信号探测传送到内部。当其原始致癌基因之一的突变向一个关键的生长刺激通道供给能量。使它在本应静止时却继续保持活性。细胞的生长就变得失去控制。
细胞内的这些通道接受并处理由组织内其它细胞发送来的生长刺激信号。当一个细胞分泌生长因子时一般这种细胞到细胞的信号发送即开始。这些蛋白质被释放后,通过细胞之间的空间而移动,并在附近其它细胞的表面上与特异受体——象天线一样的分子——结合。受体跨越靶细胞的外膜,所以其一端伸入胞外空问,而另一端伸入细胞的内部(它的细胞质)。当一个生长刺激因子附着到一个受体时,该受体就传递一个增殖信号到细胞质中的蛋白质内,然后这些下游蛋白质发射刺激信号到一个链中的其它蛋白质系列中,而该链结束于细胞的心脏(核)内。在这个核内,称作转录因子的蛋白质通过活化一组基因(有助于引导细胞通过它的生活周期)而起反应。
有些致癌基因迫使细胞过多地生产生长因子、肉瘤和神经胶质瘤(分别为结缔组织和非神经大脑细胞的癌)释放过量的由血小板得来的生长因子。许多其它类型的癌分泌太多的转化生长因子。这些因子照例作用于邻近细胞,但更为重要的是,它们也可放慢和推动刚才产生它们的同一细胞的增殖。
研究人员也已鉴定了受体基因的致癌基因变体,用这些致癌基因进行鉴定的这种畸变的受体释放大量的增殖信号到细胞质中,即使在无生长因子存在以促进细胞复制时也如此。例如,乳腺癌细胞往往表现按这种方式运作的Erb—B2受体分子。
在人体肿瘤中还有其它致癌基因扰乱细胞质中的部分信号串。了解得最清楚的例子来自致癌基因的ras家系。由正常ras基因编码的这种蛋白质把刺激信号从生长因子受体传递到更加下行系的其它蛋白质。但是,由突变体ras基因编码的蛋白质连续激发,即使在生长因子受体未促使它们激发也如此。过活化的Ras蛋白质在约四分之一的各种人类肿瘤中发现,包括结肠、胰腺和肺的癌(Carcinomas. Carcinomas)是癌(cancer)的最为普通的形式,它们起源于上皮细胞,这些上皮细胞形成体腔的内衬并形成皮肤的外层。
还有其它的致癌基因(例如Myc家系的致癌基因)改变核内转录因子的活性。一般只有当细胞已受到侵入到细胞表面的生长因子的刺激后它们才制造Myc转录因子。一旦制造出来,Myc蛋白质激活基因,这些基因迫使细胞生长继续进行。但在许多类型的癌中,特别是在形成血液的组织的恶性肿瘤中,Myc水平始终保持得很高,即使在无生长因子时也如此。
把增殖信息从细胞表面带到细胞核的主要线路的发现并不仅仅是令人心满意足的智力成就。因为这些通道为恶性细胞的繁殖提供能量,它们为科学家们试图开发新型的抗癌治疗方法提供了诱人的目标。一个振奋人心的转折点是,有多达5、6家医药公司正在研究被设计用来阻止异常激发的生长因子受体的药物。至少另有3家公司正试图开发阻止畸形Ras蛋白质合成的化合物。这两类药物都阻挡培养的癌细胞过多的发出信号,但它们在阻止动物和人类肿瘤生长的能力方面仍有待被证实。
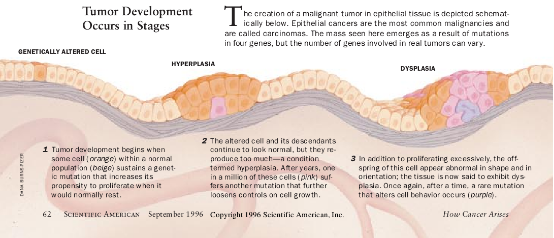
肿瘤抑制者停止工作
细胞为了变成恶性的,不能只是过度刺激它们的生长促进机器就行了。它们还必须想出逃避或忽视由组织中正常的相邻细胞发生的制动信号的方法。正常细胞所接收到的抑制信息流入核内的方式与刺激信号流人核内的方式差不多都是通过分子戽斗。在癌细胞中,这些抑制戽斗可以被破坏,因而使细胞忽视在表面的正常有效的抑制信号。在许多类型的癌细胞中,这些戽斗的关键部件(由肿瘤抑制基因确定)缺乏或失活。
叫作转化生长因子—β(TGF—β)的一种分泌物能终止各种正常细胞的生长。一些结肠癌细胞由于使编码这种物质的表面受体的基因失活而变为对TGF—β不在意。一些胰腺癌使DPC4基因失活,它的蛋白质产物可以控制生长因子受体的下游。此外各种各样的癌抛弃为一种蛋白质编码p15基因,这种蛋白质对来自TGF—β的信号产生反应而正常地关闭引导细胞通过其生长周期的机器。
肿瘤抑制蛋白质也能以其它方式限制细胞增殖。例如,有的阻滞信号流过生长刺激回路。一种这类抑制者是NF—1基因的产物。这种细胞质分子在Ras蛋白质能够发射其生长促进指令之前伏击它。因此,缺乏NF—1基因的细胞便失去了一个平衡Ras并对抗未受抑制的增殖的一个重要手段。
各种研究已表明,一个肿瘤抑制基因引入缺乏它的癌细胞后能够使细胞在一定程度上恢复正常。这种反应指出了一种使人感兴趣的治疗癌症的方法——向癌细胞提供在肿瘤发育过程中它们失去了的肿瘤抑制基因的完整形式。虽然这个概念是诱人的,但这种策略由于仍然妨碍许多疾病进行基因治疗的技术上的困难而受到遏制。目前的方法不能把基因传送到肿瘤中大部分细胞中。直到这种后勤障碍被克服以前,应用基因疗法治疗癌症将仍然是高度吸引人的但却是未完成的设想。
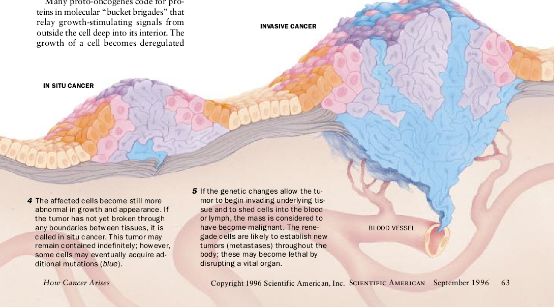
钟被敲响
在过去5年里,令人佩服的证据已揭示了细胞中刺激通道和抑制通道的目标,它们集中在细胞核的一种分子器上,这种分子器往往被称作细胞周期钟。该钟是细胞的执行决策者,而且它实际上在人类各种类型的癌症中都明显地出了差错。在正常细胞中,这只钟整合细胞所接受到的生长调节信号的混合体并决定细胞是否应该通过它的生活周期。如果回答是肯定的,这钟就引导这一过程。
细胞周期由4个阶段组成,在G0(裂隙1)阶段,细胞体积增大并准备复制其DNA。这种复制发生在下一个时期,称为S(合成)阶段,并使细胞精确地复制其染色体的补体。在染色体被复制后,第1个裂隙期(称为GT)接着发生,在此期间细胞本身准备M(有丝分裂)一这时己增大的母细胞最后分裂为二,产生两个子细胞。每个子细胞都具有一组完整的染色体。新的子细胞立即进入GT并可再次通过完整的周期。要不然它们可以暂时性或永久性地停止循环。
细胞周期钟借助各种分子为这种复杂的事件系列编制程序。它的两个重要的成分cyclins和依赖Cyclin的激酶(CDKS)相互结合,并开始进入细胞周期的各个阶段。例如,在G2阶段,D—型cyclins与CDKs4或CDKs6结合所形成的复合物对一种强有力的生长抑制分子——称为pRB的蛋白质——起作用。这种作用松开了pRB的制动效果并使细胞发展到GT阶段的末期。此后进入S(DNA)合成阶段〔参见下面框内b的说明〕。
各种抑制蛋白质能够限制向前推进通过这周期,其中包括p15(先前已提到)和p16。它们阻滞cyclinD的CDK配偶体的活性,从而防止细胞从GT阶段向S阶段推进;CDKs的另一个抑制者称为p21,能够在整个细胞周期中起作用。p21是在肿瘤抑制蛋白质p53的控制之下,后者监督细胞的健康,它的染色体DNA的完整性和周期中不同步骤的圆满完成。
乳腺癌细胞往往产生过量的cyclin D和cyclin E。在许多黑素瘤病例中,皮肤细胞已失去编码制动蛋白质p16的基因。各种类型的人类肿瘤中有一半缺乏功能性p53蛋白质。而在由人乳头瘤病毒感染细胞引起的宫颈癌中,pRB和p53两种蛋白质都经常丧失功能,消除了钟的两个最重要抑制者。所有这些病例的最终结果是钟开始摆脱控制,无视任何外来的停止警告。如果研究人员能够设计对细胞周期中Cyclin和CDKs活性强制施加影响的方法,它们或许能使癌细胞在它们的发展轨道上停下来。
迄今我已讨论了我们的组织一般抑制细胞增殖和避免癌症的两种方式。它们通过夺去细胞的生长刺激性因子,或相反地通过向它倾注大量的抗增殖因子而阻止过量增殖。但是,正如我们所知道的那样,正在发生癌变的细胞往往会避开这些控制。它们刺激它们自己并对抑制信号充耳不闻。为了对这种不测事件作准备,人体的细胞有一些阻止分裂失控的备用系统。但是细胞的遗传组成的另外一些突变甚至能够克服这些防御并导致癌症。
自动防止事故系统失效
如果细胞的某些重要成分受到损伤或如果它的控制系统失去控制,存在于每个人体细胞中的一种这类备用系统会诱使细胞进行自杀(“apoptosis”)。例如,对染色体DNA的损伤能够引起自杀。此外,许多实验室近来的研究表明,在一个细胞中致癌基因的产生或肿瘤抑
制基因的能力丧失也能引起这种反应。受损伤细胞的毁灭对细胞本身是坏事,但对于人体作为一个整体来说是好事:致癌的突变对生物造成的可能的危险比失去单个细胞所付出小的代价要大得多。因此在我们的组织中显露出的肿瘤似乎是从罕见的、遗传方面被扰乱的细胞中出现的。(这些细胞由于某种原因在逃避硬布线到其控制电路的自杀程序方面获得成功)。
发育的癌细胞具有几种避免自杀的手段。p53蛋白质的许多功能之一有助于引起细胞自杀,许多肿瘤细胞引起的p53失活降低了遗传上出了问题的细胞将被消除的可能性。癌细胞也可制造过量的蛋白质Bcl-2,它有效地防止自杀。
近来科学家们已意识到,逃避自杀的能力不仅因引起肿瘤的扩散而可能危及病人,而且还使所形成的肿瘤对治疗产生抗性而危及病人。多年来就已认为,放射治疗和许多化学治疗药物通过在恶性细胞的DNA中造成广泛的严重破坏而直接杀死这些细胞。我们现在知道,这种治疗往往在相对较小的程度上损害DNA。然而,受影响的细胞觉察到,所遭受的损伤不能很容易地修复。因此它们主动地杀死自己,这一发现表明能够避免自杀的癌细胞将对治疗有少得多的反应。由于同样原因,它也表明能够恢复细胞自杀能力的治疗因改进了现有放射性治疗和化学治疗策略的有效性而战胜癌症。
防止失控增殖的第二种防御方法与自杀程序完全不同。它也被装人我们的细胞中。这种机制计数和限制细胞能够自我繁殖的总的次数。
细胞变成不灭的
已从研究培养皿中培养的细胞获得了许多关于这种保护的知识,当从小鼠胚胎或人胚胎中取出细胞并培养这些细胞使其生长时,这些细胞群体大约每天翻番。但是到了可预计的倍增次数之后(人细胞为50至60次),生长就停止了,此时就说细胞是衰老了。至少当细胞有完整的RB和p53基因时会发生这种现象。这些基因中的任何一个遭受到失活突变的细胞在它们的正常的对应者进入衰老期时仍然继续分裂。不过,这些幸存细胞最终将达到第二阶段,称为危机,此时它们大量地死亡。但是,在这死亡的群体中一个偶然的细胞将逃脱危机,并变成不死的:它以及它的后代将无限地繁殖。
这些事件表明,存在着一种机制,它计数细胞群体已发生过的倍增次数。在过去几年里,科学家已发现进行这种计数的分子装置,在染色体末端的DNA片断(称为端粒)计数复制的代数,细胞群体经过这些复制代在适当的时候引起衰老和危机,这样它们就限制了细胞无限扩展的能力(参见《科学》 1996年第6期Carol W. Greider和Elizabeth H. Blackburn著“端粒、端粒酶及癌症”一文)。
就象鞋带上的塑料末端一样,端粒帽保护染色体末端免受损伤。在大多数人类细胞中,在细胞周期的S阶段每次染色体被复制时端粒缩短一点。一旦端粒缩短到某一闭限长度以下时,它们发出一个警报,指令细胞进入衰老。如果细胞忽视了衰老,端粒进一步的收缩将最终引起危机。端粒极度的收缩将引起细胞中的染色体彼此融合或分裂开,产生遗传混乱,这对细胞来说是致命的。
如果以端粒为基础的计数系统在癌细胞中正常运转,在肿瘤变为非常大之前它们的过度增殖将长时间受到抑制。危险的扩展将被衰老程序或(如果细胞避开了那种阻碍)危机时染色体阵列的破裂所挡住。但是在大多数癌细胞发育时期这最后一种防御被攻破了,被为端粒酶编码的基因的激活所征服。
这种酶(实际上在大多数健康细胞类型中不存在却存在于几乎所有的肿瘤细胞中)系统地代替在每个细胞周期中通常被修整掉了的端粒片断。在如此作时,它保持了端粒的完整性,因此使细胞无限制地复制。所产生的细胞不灭性可能引起好几方面的问题,最明显的是,它允许肿瘤长大;其次它也为癌变前的细胞或已经是癌性的细胞提供了时间以积累附加的突变,那将增加它们复制、侵入和最终转移的能力。
从癌细胞的观点来看,生产一种单一的酶是颠复致死障碍物的一种巧妙的方法。然而对一种酶的依赖性也可能是一种唯一致命的弱点。如果能够把端粒酶封锁在癌细胞中,它们的端粒只要它们分裂时就会再次收缩,把这些细胞推向危机和死亡。由于这种原因,许多医药公司正试图开发以端粒酶为靶的药物。
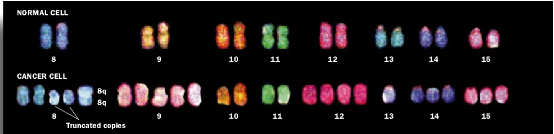
为什么一些癌症较早出现
一个初期的肿瘤为了聚集其恶性生长所需的全部突变一般要花数十年的时间。但是,在某些个体中,肿瘤发育的时间明显地缩短;在某些癌症发作的典型年龄之前数十年,这些人就患了此类型的癌。肿瘤形成如何能够被加速?
在许多情况下,这种早期发作能够以一个或另一个亲本遗传了引起癌症的突变基因加以解释。当一个已受精的卵开始分裂和复制时,精子和卵子提供的基因组被拷贝并分布到身体的全部细胞中。此时,一个通常很稀有的事件——一个关键性生长控制基因的突变——会变成普遍存在的,因为这种突变被移植到身体的全部细胞中,而不仅仅是在一种随机击中的细胞中。换句话说,肿瘤形成的过程跳过了它的早期、缓慢发生步骤之一,总体上加速了这一过程。因此,一般需要30或40年才能达到完善的肿瘤的发育可以在10或20年达到顶点,因为这种突变基因能够一代一代的传递下去,所以一个家庭的许多成员都可能有癌症早期发育的危险。
结肠癌的一种遗传形式提供了一个惹人注目的例子。大多数结肠癌的病例散发性地发生,这是一个人一生中随机地发生的遗传事件的结果。但是在一些家庭中,许多个体受到早期发作结肠肿瘤的折磨,这是被遗传基因所预先注定了的。在这些散发性病例中,一种稀有的突变抑制了肠表皮细胞中称为APC的一个肿瘤抑制基因,所引起的突变细胞的增殖产生一种良性的息肉,它可以最终发展成一种恶性癌。但是APC的有缺陷的形式可以从一些家庭中的双亲传递给孩子。这些家庭的成员在一生的前几十年里发育出数百乃至数千个结肠息肉,其中有些很可能转变成癌。
现在可直接追踪到突变肿瘤抑制基因的遗传的家族癌综合征的名单正逐渐增多。例如,pRB基因的遗传缺陷变体往往导致儿童眼癌——成视网膜细胞瘤——的发育,在生命的较后阶段中,此类突变可解释大骨肉瘤(骨癌)的大大增加的危险。p53肿瘤抑制基因突变遗传变体在多个部位产生肿瘤,这是一种称作Li—Fraumeni综合征(部分是以本期 “什么引起癌症?”一文的作者之一Frederick Li来命名)的疾病,此外近来分离的BBCA1和BRCA2基因似乎可解释大多数家族乳腺癌,在美国包括全部绝经前乳腺癌的20%之多以及家族卵巢癌的很大部分。
肿瘤的早期发作有时也可用其它类基因的突变遗传来加以解释。正如我先前指出,大部分人直到生命的后期或无限期地避免了癌症,因为他们带有原始基因来到了人世间。但是,在生命的过程中,我们的基因受到从环境中引人我们体内的致癌基因的攻击,也受我们自己细胞中产生的化学物质的攻击。此外,当在细胞周期复制DNA的酶使拷贝发生错误时也可能引入遗传错误。绝大部分这种错误被每个细胞内运行的修复系统迅速地校正,如果这种修复系统出了差错和未能消除错误,这种损伤将在细胞的基因之一以及在所有后代细胞的同一基因中变成永久性的突变。
该系统的高修复效率是恶性肿瘤的发育所需要的全部突变可能要经过数十年才会碰巧会聚在一个细胞内的一个原因。然而某些遗传缺陷能够通过一个特别隐匿的手段加速肿瘤的发育,它们损害可修复损伤DNA的蛋白质的作用。结果,一般应该很慢积累的突变将以令人惊恐的频率在细胞的全部DNA中出现。这些受影响的基因不可避免地包括控制细胞增殖的那些基因。
另一种遗传的结肠癌即遗传非息肉结肠癌的病例就是这样。受折磨的人制造可导致修复由DNA复制器造成的拷贝错误的蛋白质之有缺陷的变体。由于这种损伤,结肠细胞不能有效地修理DNA损伤;因而它们迅速地积累突变,在20年或更长的时间内加速癌的发育。患另一种家族癌症综合征(即着色性干皮病)的人已遗传了能指导修复受紫外线损伤的DNA之一种基因的有缺陷的拷贝。这些患者易于患几种类型的日光引起的皮肤癌。
类似地,生来就带有缺陷ATM基因的人的细胞难于识别DNA中某些损伤的存在并激活适当的修复反应。这些人对神经退化、血管畸形和许多肿瘤是易感的。一些研究人员已提出,带这种基因的缺陷拷贝的患者有多达13%的人会产生遗传的乳腺癌。
在下一个十年期间,癌症易感性基因的名单将大大增加,这是人类基因组工程(试图鉴定人类细胞的每一个基因)的成果之一。随着DNA分析的有效工具的日益增多,对这些基因的认识将使我们能够预测易患癌症家族的哪些成员是处于高度危险的,以及哪些成员由于运气好已遗传了这些基因的完整拷贝。
增殖以外的问题
虽然我们已经知道许多关于失控细胞增殖的遗传基础,但我们对能引起肿瘤发育到晚期的突变基因仍然知道得相当少,特别是关于允许肿瘤细胞诱使血管供给营养,侵入邻近组织和转移的情况知道得更少。但是在这些领域的研究正迅速地开展。(Judah Folkman在本期 “以攻击其血液的供应治疗癌症”一文中描述了肿瘤细胞产生自己的血液供应的本领。Erkki Ruoslahti在本期“癌症怎样扩散”一文中研究了转移。)
我们现在距离能够写出许多人类肿瘤的详尽生活史(从开始到威胁生命的最后阶段)已经不远了。这些生物传记将以基因和分子语言写出。在十年之内,我们将以异常的精密度知道构成正常细胞发展为高度恶性的、侵袭性衍生物的复杂演化过程的一系列事件。
到那时,我们可以开始懂得为什么某些局部的团块从未发展到超出它们的良性,非侵袭形式之外从而使我们面临攻击性的恶性肿瘤。这种良性生长可以在几乎身体的每个器官发现。或许我们也将判明为什么某些突变基因引起某些类型癌症的形成而另一些突变基因不会引起。例如,RB肿瘤抑制基因的突变体往往出现在成视网膜细胞瘤、膀胱癌和小细胞肺癌中,但只是偶尔在乳腺癌和结肠癌中看到。极有可能的是,对这些难题的许多解答将来自发育生物学(胚胎学)的研究。毕竟,控制胚胎发育的基因在晚得多的时候将成为我们的恶性肿瘤的来源。
按任何尺度来衡量,过去20年中所收集的关于癌症起源的信息在生物医学研究史上都是无与伦比的。部分这方面的知识已经投入很好的应用,用于建立检查和确定某些类型癌的侵袭性的分子工具,正如David Sidransky在本期“癌症检查的进展”一文中所讨论到的。但是,尽管对原因方面的了解已有如此之多,但新的有效治疗迄今仍难以捉摸。一个原因是肿瘤细胞只极小地不同于健康细胞;细胞中成千上万个基因中只有很小部分在恶性转变中遭受到损伤。因此,正常的朋友和恶性的敌人披着非常相似的衣服,这样指向敌人的任何炮火对正常组织所带来的损伤都与预定的目标一样多。
然而战斗的过程是变化的。正常细胞与癌细胞的差异可能是微妙的,但它们是客观的。此外肿瘤的独特特征为新开发的药物的干预提供了极好的目标〔参见本期“未来的治疗”这一部分〕。定向抗癌抬疗药物的开发仍然处于初期阶段。这一事业将很快从单凭偶然的幸运发现转向合理的设计及准确的对准目标。我认为二十一世纪的前十年将用先前几代不可能梦想的癌症治疗法来报偿我们。那时美国在癌症基础研究方面的长期投资将开始取得可观的收效。
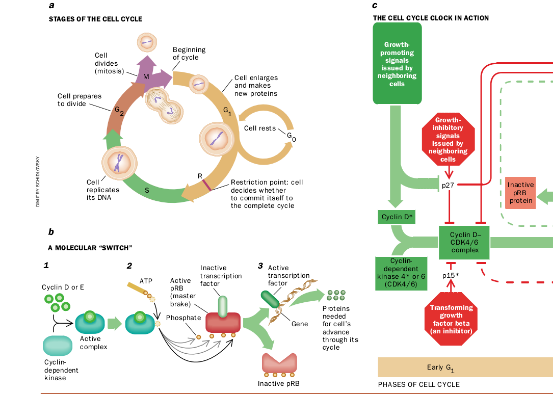
细胞周期钟和癌
大多数(也许是全部)人类癌症不适当地生长,不仅是因为细胞内的信号通道被打扰,而且还因为所谓的细胞周期钟变得紊乱。这只钟——由核内一组相互作用的蛋白质组成——一般整合来自刺激性通道和抑制性通道的信息,而且如果刺激性信息占了上风。它就使一个细胞通过其生长和分裂周期,通过细胞周期的4个阶段而发展(a)在很大程度上是受称为cyclin的蛋白质水平升高的驱动,主要是D类cyclin,其次是E, A类cyclin,再其次为B类cyclin。这个周期的关键的一步发生在GT末期的限制点(R),此时细胞决定是否要完成这个周期。对于通过R并进入S的细胞,一个分子“开关”必须被从“关”转到“开”。这个开关工作如下(b):当cyclin D的水平以及后来的cyclin E水平升高时,这些蛋白质结合并活化称为依赖cyclin的激酶的酶(I)。这种激酶(作为cyclin—激酶复合物的部分起作用)从ATP(腺苷三磷酸)的分子中夺去磷酸根(2),并把它转移到叫作pRB的一种蛋白质,这是细胞周期钟的主要制动器。当pRB缺乏磷酸根时,它通过分离称为转录因子的其它蛋白质而积极阻止周期循环讲使开关保持在“关”的位置)。但在cyclin—激酶复合物加入足够的磷酸根到pRB中后,这个制动器就停止工作(3:底部);它释放出这些因子,使它们可以对基因产生作用(3:顶部)。这种析出的因子后刺激生产继续通过细胞周期所需的各种蛋白质。
在下面的图C中,这种开关被置于调节细饱周期的许多分子互相作用的更大范围内。开关移到“开”能在R点上方被看到,刺激蛋白质cyclin D, cyclin E 和CDFK4的过度活性与某些人类癌症蛋白质关连。各种抑制性蛋白质的失活也已得到证明,受到影响的蛋白包括p53(在一半以上各种类型肿瘤中已失去或失效), pRB, p16和p15,任何这些变化的净效应是钟的失控,从而导致这种细胞的过度增殖。
请 登录 发表评论