在出现任何症状之前,探测肿瘤存在与否的检查,能比任何新型药物疗法挽救更多的生命。
一位妇女已经感觉到乳房有肿块,才去医生办公室。医生摸到了肿块,于是又一所有情节都那么相似的故事便展开了。活组织检查确诊,该妇女患了乳腺癌。手术,也许还得施行放射治疗或化学治疗。这种方案往往不会有理想结局,原因很简单,仅仅在症状出现后才发现了肿瘤。
通过美国癌症协会的自我检诊指南,很多人已认识了癌症的早期症状。但是,当症状出现的时候—常常表现为疼痛、器官出血、突出的团或肿块—许多肿瘤已经长得很大了。尽管做了主动性的肿瘤切除手术,但许多晚期的癌会复发或者已经转移,随即可能结束患者的生命。相反,当肿瘤还小时,它们就不易扩散,极有可能得到根除。
分子生物学的最新突破性进展及我们对癌症遗传学的认识,有助于开发出一系列前景良好的检验方法,这些方法既可用于评估人们患癌的可能性,又可用于发现肿瘤,而此时肿瘤还足够小,可以进行有效的手术。当然,其他检验方法可以确定对特定患者进行化学治疗的最佳方式及术后癌症复发的可能性,不必使用侵入性方法,只要利用一点尿样或一小管血就可进行这种检验。尽管长期强调癌症治疗新方法(如基因疗法),但我们许多人还是坚信早期检查和改进监控可以在末来的岁月里挽救大多数患者的生命,而这一目标是通过使现行疗法在最有效的时刻使用成为可能来实现的。
遗传问题
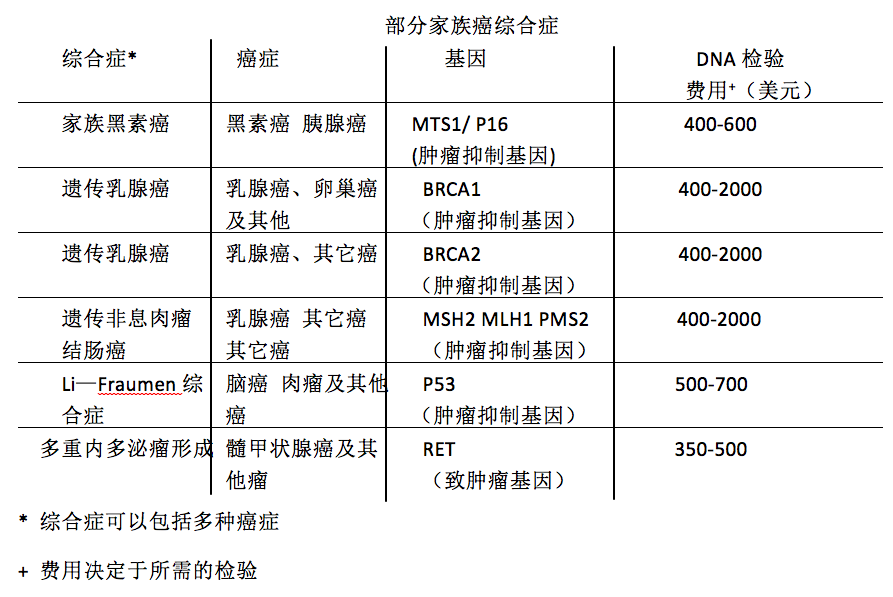
与其他许多疾病一样,患某种癌症的趋势也是可以遗传的。父母将特定基因的突变传给子女,这决定了后代患各种乳腺癌、结肠癌、黑素瘤或其他非常见肿瘤的可能性。现正开发简单的血液检验方法,用来捕捉乳腺癌的两种已知感病基因(BRCA1)和(BRCA2)的DNA突变。这种方法有助于评价早期患乳腺癌的风险。如果某位妇女携带了这种突变,她就面临极有可能转化为乳腺癌的危险(通常在40岁之前),尽管不是百分之百肯定。(男性患乳腺癌或许还有前列腺癌的可能性将增大。)
相反,如果某位妇女不是突变携带者,她患乳腺癌的可能性就低于普通人群患乳腺癌的可能性,后者大约为每八位妇女中就有一位在其一生中会患乳腺癌。新检验方法让医生能够密切监测遗传易感家庭成员的情况。乳腺X线照相术和其他监测方法仍可以在肿瘤还很小的时候对它们进行检测。但是,由于仅仅只有小部分癌症被认为是可遗传的——约占总病例的百分之十;因此,这些检验方法可能仅对高风险家庭才有意义。除乳腺癌之外,其他癌症(如结肠癌)的易感性的遗传检验方法也将问世。
在可能患癌几十年之前就能确定某人患癌的风险,这本身就会引发一系列社会问题,甚至心理问题。立法者已着手立法以防止保险公司歧视基因突变携带者。知道某人具有遗传缺陷也会成为整个家族必须承受的可怕心理负担。就连家庭内的非突变携带者也会有负罪感〔见第一个框图内的说明〕。
除社会问题之外,在普遍实施检验之前,还要解决大量的技术难题。尽管遗传技术取得了突破性进展。但是,设计检测与癌症相关的突变的可靠检验方法的能力还面临挑战,如果检测方法不能发现可能致癌的所有突变,就会漏掉患者。除准确性外,任何检验方法必须有助于提高患者的生存率,这一目标仍需明确强调。某些易感性检验批评者认为,阳性检验之后的严密监测(如一系列常规乳腺X线照片),可能不能足够早地发现肿瘤,从而也不能增加患者康复的机会。同时,来自患结肠癌高风险家族研究的证据表明,为防止癌症发生而进行的严密监测、化学药物疗法及某些情况下的结肠切除能大大除低死亡率。
优先选择切除器官(如结肠或乳房)并不能完全防止癌症。例如,乳房切除术后,尽管肿瘤复发的风险降低了。但是,某些癌性乳房组织可能留下了易感性检验的内在缺陷表明,迫切需要开发更佳的早期检测策略,此策略要求能在肿瘤非常小或刚向恶性转化时就发现它们。改良的检测不仅应有助于遗传易感家族,而且应有助于普通人群。
无论遗传变化是遗传的(如家族癌症综合征)还是在一生历程中获得的,癌症的终极原因都是遗传密码DNA的改变。为了变成破坏性恶性肿瘤——即无限制增殖,侵入其他组织以及四处转移——细胞的许多与癌相关的基因必须受到损害。(见本期的“癌症怎样发生”一文),根据我们对疾病的广泛理解,现在我们知道小群癌前期细胞〔仍被认为是良性的但己处于向癌转变的过程中)和早期癌症常常隐藏着可检测到的遗传变化——这一发现开创了寻找检验方法的新途径。

分子检测
现行细胞学分析(例如,利用显微镜检验巴氏涂片上的细胞)常常不能仅仅依据细胞的大小和形状识别出少量的异常细胞。然而,DNA分析就可以检测微量突变细胞。这些细胞正从新变成癌性的器官进入体液——从尿到痰,甚至还有乳头分泌液。聚合酶链反应(PCR)技术允许对癌前期细胞或癌细胞中的DNA单链进行百万次以上的复制。这种分子复制生物技术使得检验在小到单滴体液这样的医学样本上就可进行。
然后通过PCR技术复制的DNA就可以被杂交:把相似的DNA“梯”的两条链分开,然后暴露给遗传探针,探针包含一条DNA单链,它具有在癌细胞中通常存在的某一特定突变。体液样本中含相同突变的任何DNA都与探针结合在一起,而探针则可用荧光着色剂或放射性物质进行示踪标记〔见后面第二个框图〕。
检测DNA分析的许多研究工作是在约翰霍普金斯大学医学院我的实验室中进行的。我和同事们一道分别在痰、尿和大便中发现了肺癌、膀胱癌和结肠癌各自的指示性癌症基因突变。几年前,我们小组就宣布,通过观察息肉患者的大便就能在称作ras的癌症基因中检测出突变,所谓息肉是指预示结肠癌的结肠中的瘤。当然,在结肠癌患者中也发现了这种突变。 这些结果引发了更大规模的试验,以确定识别大便中的ras基因突变是否能成为一种普查方法。这种试验可以在通过结肠镜检查出息肉之前就发现它们。简单地切除息肉可大大降低患者得癌症的可能性。
几年之内,ras突变检验可能成为医学实验室的常规方法。但是,在寻找若干基因中可发现的多种突变时,这类遗传分析方法可能被证明是过于耗时费钱的。必须用不同的DNA探针来查出每一个不同的突变。另一种探查癌症的方法利用了称作微卫星的重复DNA小片段。因为这些重复单位没有包含什么对细胞有用的信息,有时它们被称为垃圾DNA( Junk DNA)。但是,微卫星对癌症诊断医生和法医来说蕴含着丰富的信息,法医把它们作为DNA指纹鉴定方法之一,此法在O.J.Simpson案中得到了极大关注。
微卫星在每种染色体的DNA中广泛分布,已经开始显示自己在癌症诊断中的价值。这些重复单位丛的消失,表明染色体区位的缺失。同时,微卫星大小的变化也表明了遗传变化的发生。
在一次小型试验中,我们在约翰霍普金斯大学检查了一些具有膀胱癌症状的患者,以此揭示在他们的尿中是否出现了异常微卫星。通过比较尿中和血中的DNA,我们发现了微卫星变化。血作为对照样本,这样就可检测尿样本了。
对20位这样的患者,我们发现其中19位具有微卫星DNA变化,表明染色体缺失某一完整的区位。随后的患者肿瘤活组织检查也证实了同样的变化。对非癌症患者,我们没有发现异常微卫星。尽管漏检了一位患者,但是,与简单的诊断技术——如检测宫颈癌的巴氏涂片法——的记录相比,95%的检测率还是有优势的。
微卫星检验方法简单而费用低廉,这使它在检测特定遗传突变(如ras)方面具有优势。事实上,整个技术过程都可以实现自动化,技术人员仅仅需要取一滴尿和一滴血,按一下按钮,实现PCR的机器就会从尿样中复制DNA,从而识别标明膀胱癌发生的微卫星类型。正开始进行更大规模的试验以验证我们的初步结果。这种方法是否适用于所有癌症,还有待确定。
其他早期检测策略重点是监测蛋白质水平;蛋白质水平或者是突变基因的产物,或者是某一特定癌症的独特的生化结果。一个例子就是前列腺癌患者血中的循环PSA(前列腺特异性抗原,见本期的“前列腺癌普查有意义吗?”一文)。PSA检验在监测前列癌患者的进程方面具有确定性作用,蛋白质水平高就表明恶性肿瘤复发。当然,最终可以证明。这种检测方法是可靠的早期检测工具,许多医生已开始经常利用此法检测前列腺肿瘤。
酶标记
一种可望用于检验与监测癌症的简单的蛋白质检验法的目标是寻找所谓端粒酶。癌症发生时,端粒酶就有活性,端粒醉影响端粒。而端粒是染色体两端的片段,细胞每分裂一次,端粒就渐渐变短。当端粒短至一定长度时,它们就引导细胞自我毁灭,这提供了消除老化细胞的机制。在大多数正常细胞中。端粒酶是不存在的,而在癌中,端粒酶却是活跃的,并阻止端粒变短,这样,癌细胞就不会死亡。
因为在正常细胞中,端粒酶很少出现,因此,它可以作为表明癌症早期发生的标记。从理论上讲,端粒酶普查可提供一种检查体液和组织癌的一般检查方法。设在加利福尼亚州门罗帕克的Geron公司,巳开始着手根据得克萨斯大学西南医学中心Jerry W. Shay及冷泉港实验室Carol GreicIer完成的研究,开发检验端粒酶活性的方法。
蛋白质检验研究实际上早于遗传标记检验诞生的出现。然而,由于发生了过多的错误结果,许多检验并未实现预期目标。为此,如今的研究工作出现了转向研究遗传方法的趋势。
除早期检测外,临床医师必须弄清特定的肿瘤如何迅速生长或扩散。这种评价——一种称为筹划(Staging)的过程——在确定患者术后应得到何种辅助治疗(放疗化疗)方面,是关键的环节。筹划过程中,医生要检验组织切片以确认所有肿瘤都已切除干净。但肿瘤细胞仍可能侵入周围的淋巴结。肿瘤切除后牵涉到的淋巴结的多少是确定预后的重要因素。
医生很早就意识到筹划的标准方法——在光学显微镜下识别异常细胞,常常不能发现很小的癌细胞群。最近,我们小组在约翰霍普金斯大学应用分子技术来检测喉癌、其他头癌和颈癌患者隐藏的恶性肿瘤细胞。尽管实施了强制性手术,这些肿瘤常在同一区域复发。在一项试验研究中,我们检查了已知其肿瘤隐藏着P53基因突变的患者。P53基因是肿瘤抑制基因,它通常抑制细胞的失控生长,在它失去活性后,细胞经常转化成癌性细胞。
我们开发了P53的分子检测法,过去,在表面上完全切除肿瘤之后,我们常用此法检验淋巴结和遗留的周围组织,对半数以上的病例而言,即使在光学显微镜的检查下得出了否定的结论,肿瘤周围仍至少有一个区域包含这样的细胞,它们具有与肿瘤一样的P53突变。这些癌细胞扩散到了淋巴结周围的组织,并在手术后遗留下来了。
对得到肯定检验结论的患者而言,癌症经常复发,而且复发的区域经常是我们最初检测出了癌细胞的同一区域。相比之下,得到否定检验结论的患者术后尚未复发。别的研究人员在结肠癌患者的淋巴结中也鉴别出了同样的突变。
P53基因这类分子标记也有助于评价患者对各种化学治疗方式的反应。P53的正常功能是揭示遗传损害,并引起细胞自身死亡——这种细胞活动演进过程称为细胞自杀(apoptosis)。许多类型的化学治疗的作用是给细胞造成遗传损害,而这些遗传损害通常会刺激P53基因产生细胞自杀。但是,某些常规化学治疗对P53基因已经消失或P53基因失去活性的肿瘤没有什么作用。对乳腺癌而言,某些可能不靠P53而产生细胞自杀的治疗方法如taxoI,现正被考虑应用于具有P53突变肿瘤的患者。
要实现遗传检测和监测的潜在优势,仅仅揭示突变基因的存在是不够的,还必须准确指出癌细胞微簇的位置,以便切除之。成像技术的进展——如磁共振成像技术或计算机X光断层照相术会有助于检测这些损害。这类研究会因“生物学的”成像技术而加强——摄入低水平的放射性化合物或使用荧光技术,它们的辐射可以标明肿瘤的位置。
尽管分子检测具有这些优点,但文中提到的大多数研究仍是十分初步的,并有待大规模临床试验的证实。不过我仍十分乐观地认为,5年之内分子检测及其后续的筹划和特别治疗策略将会成为大多数美国人的常规体检的一部分。
不可能存在一种检测方法能够检测各种肿瘤。每种癌症都具有自身的分子特征当然也需要自己独特的检验方法,虽然如此导致癌症的遗传变化还是可能成为治愈此症的根本突破点。我们可以期望,总有一天一小点血,组织或各种体液样本就能揭示新的或转移肿瘤的存在,并可确定是肺肿瘤、乳腺肿瘤,结肠肿瘤或其他器官肿瘤,以便及时根除它们。这些检验方法的灵敏性可能改变我们对癌症的根本观念,早期肿瘤将被发现并治愈而不会变成导致无法挽回的悲剧的可怕诊断。

遗传检验为时尚早吗?
Gary Stix
准确查出使人易患癌症的遗传性基因突变的能力问题,在医学界掀起了一场极为火爆的争论。本世纪80年代,研究人员确定了第一个癌症易感性标记因子——引发成视网膜细胞瘤(一种眼睛恶性肿瘤)的遗传突变。但是,本世纪90年代中期,乳腺癌基因的发现,及随后对评估此病易感性检验方法的开发,才将这个问题引入大众争论的领域。发现乳腺癌基因的重要性超出了此病本身,因为它提示存在别的基因使男人或女人易患其他各种癌症——可能从卵集癌到前列腺癌。
伦理学家和医生面临的二难困境笼罩着检验结果依然模糊不清的意义,如果检验证实了存在退传突变,具有乳腺癌家族史的妇女就面临85 %的患病风险——尽管不是100%。然而,如果一位妇女携带有此种基因突变,但她的任何亲成都未患过乳腺癌,则其患病的风险则是不清楚的。
就是检验结果在手,该妇女也面临对此的决策难题。对遗传性基因缺损的否定检验结论,也不能给她舒心的感觉,因为85%的癌症不是遗传而得,这样,她依然面临患非遗传癌症的危险。她还可能遗传到尚需研究人员识别的突变。
肯定的检验结论也不能提供完全明确的选择。加强监测可能证明是不够的:乳腺X线照相术可能忽略掉一个肿瘤。并且双乳预防性切除也不能保证术后余下的组织不受癌症侵袭。
检验的批评者担忧,这些信息被保险公司和雇主滥用,许多州已通过法律禁止健康保险业者利用遗传检测歧视患者。否定这种歧视的联邦立法正在国会酝酿,在这些问题解决之前,全国乳腺癌联合会,美国人类遗传学学会和人类基因组研究全国咨询理事会建议此类检验应限于正在进行中的研究工作。
然而,研究界外部对检验的热衷追逐已显露苗头,弗吉尼亚州费尔法克斯的一个医疗机构——遗传学和IWF研究所提出了一种检验在Ashkenazi犹太妇女中发现的突变的方法, Myrid遗传公司和Oncormed公司已开发了更全面的检验方法,以寻找两种已知乳腺癌基因BRCA1和BRCA2中更为广泛的突变。这些检验有望在几年内用于常规医疗工作中。
医疗界同声反对在研究领域外进行临床检验这种情况已经弱化。美国临床肿瘤学学会因在《临床肿瘤学杂志》5月号中建议应允许对任何具有乳腺癌家庭史的人进行检验而与其他组织分道扬镳,检验倡导者相信忽视可以得到的遗传信息会将患者置于危险之中。他们指出,检验的模糊性和焦虑性问题可以通过恰当的咨询予以解决。本文的正文作者David Sidransky持这种观点。Oncormed就职于霍普金斯大学医学院,同时还是Oncormed公司顾问。他指出,就是不进行遗传易感性检脸,对结肠癌高风险者进行积极监测也可以使死亡率大幅度降低。
Sidransky建议,携带乳腺癌基因突变的妇女应接受严密的监测,并有资格参加新型化学预防化合物的临床试验, Sidiansk承认,知道某人隐藏着突变会给患者及其家庭带来压抑感。“不过这些问题不能与患转移性乳癌及死于此病等情形相提并论”他补充说。
其他倡导者的观点没有Sidransk那么鲜明,国立人类基因组研究中心主任I'rancis S,Collins同其他人一起对《临床肿瘤学杂志》上发表的政策性报告作出了反应。该报告宣称:“我们关注的是:对遗传易感性检验的能力将为下列活动提供先决条件,告知人们选择最佳医疗方法的能力,提供有助于个人和家庭作出改进生活质量的决策的咨询和教育的能力以及保护家庭免受种种歧视的能力。Collins代表公私合作机构——乳癌国家行动计划作出了这一反应。
Collins暗示国家癌症研究所最近组建的全国癌症遗传学网络将是患者参与研究活动、知晓自身遗传状况从而获得咨询的桥梁。该网络将向患者及其医生提供一种机制,从而克服知晓某人是突变基因携带者所引起的棘手间题。

27年后的诊断
Hubert H, Humphrey 的遗孀Muriel Humphrey Brown 在一封信中同意约翰霍普金斯大学医学院使用其亡夫的医学样本。她说,自己的决定符合Hubert的意愿。下面就是该信的摘录。
“这就是Hubert 想做的,我坚信,这会使他永存,这也是我们欲使他的病例保存下来以为将来利用的原因。
我和Hubert相信这样的信念,它使我们多次度过难关。这就是“一切为最好而发生”,常常要花很长的时间才能明白其中的道理。经过多年的悲伤和愤怒,我都无法将这一信念与Hubert所受的苦难与他的去世联系起来,或许现在我已找到了答案。”
1994年,我们一帮研究人员在霍普金斯大学医学院利用27年前的尿样诊断出Hubert H.Humphrey患过膀胱癌,这充分显示了新型分子诊断工具的威力。Humphrey是个经典例子,它更加强调了早期诊断的必要性。
1967年,Hubert在担任副总统一职时,发现自己的尿中带血,他的医生作了检验以寻找异常细胞,然而医生们并役有作出已经患癌的结论。这样积极的治疗就延误了。几年后,作出了正确的诊断,并在1978年对Humphrey进行了放疗和大手术。他最终因此病的复发而亡。
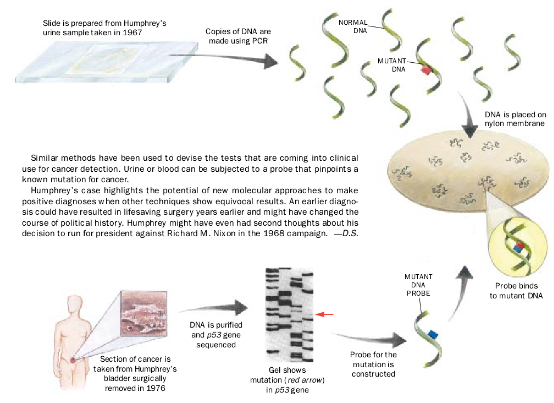
在一个实验中(图示),我和Ralph H. Hruban, Peter Vander Riet, Yener S.Erozan等研究人员得到Humphrey遗孀Muriel Humphrey Brown的同意,利用1967年所取的Hubert的尿样和几年后切除的肿瘤样本进行了研究。
今天,我们懂得P53基因的突变含有膀脆癌的信号,但我们想了解的是,1967年能否在Humphrey的尿样中检测出这种突变。为此,我们先确定肿瘤中携有P53突变(示意图下)。我们提取并复制DNA,然后在P63基因一个部分中进行顺序分析。规定每个核苷酸即DNA组成成对,顺序分析揭示了点突变,一种核苷酸(腺嘌呤)被另一种核苷酸(胸腺嘧啶)取代。然后,我们合成了一种探针,它含有一条DNA单链。能识别并与携有相同突变的DNA配对。放射性标签附于DNA链上以追踪探针。
我们利用聚合酶链反应(PCR)技术分别复制尿样中的P53基因的DNA(示意图上)。然后,我们将DNA插入细胞中,这些细菌生长于放在尼龙膜上的菌落中。在菌落中DNA链被分开,(这样,它们就易于与适当的探针配对)。当探针置于膜上时(最右),它们就与含有突变的细胞中的DNA配对——这表明突变确实早在1967年就存在于Humphrey的尿中了。
有时可通过检测遗传突变来跟踪癌症易感性。约翰霍普金斯大学医学院的科学家们正在研究内布拉斯加奥马哈的Lueder家族与结肠癌综合征及尿道癌有关的一种基因突变,上述基因存在于三条染色体的不同部位(图中灰色处)。
(冉隆华 译 郭凯声 校)
请 登录 发表评论