花细胞从传递位置信息的基因那里获悉要形成哪些器官。根据恰好由6个这类基因建立的模型能够预测怎样的突变就会影响花的结构。

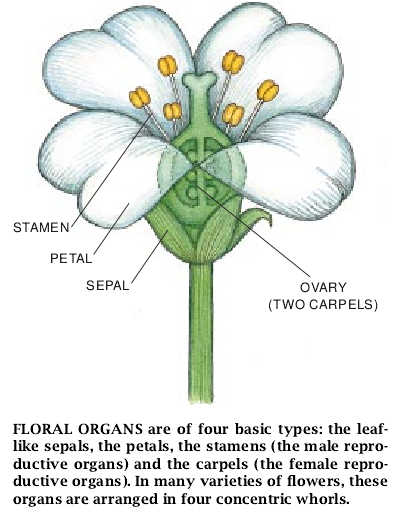
所有的花都是由一些不同类型的器官组合而成的。它们多半具有萼片(变态的叶状结构)、花瓣、雄蕊(产生花粉)和心皮(植物子房的亚单位)。在几乎所有具有全部上述这些器官的野花里,它们由周边向花中心的排列顺序都是:萼片-花瓣-雄蕊-心皮。可是,各别种和品种特有的外形和这些各组成部分的排列都不相同。

由于植物花器官的顺序是其遗传性状之一,所以叙述此类模式的信息必然载于它的遗传材料中。不过,就此点而论,储存遗传信息的染色体DNA之一维碱基对顺序怎么能编码花的(乃至任何其他生物体的)三维结构呢?
至今只是部分地了解了发育模式形成的机制。可是,很显然,生物体内细胞的有关位置会指令该细胞和它的后代应该形成哪些种类的结构。这种有关位置的信息是通过调节蛋白的综合或增减而传递的,这些调节蛋白存在于生物体的特定区域。

我的合作者和我选定研究花的发生模式是由于花的单纯性。花通常只是由四个易于区别的器官类型组成的,其中每个器官都是由少量细胞类型构成的,而这些植物又能在实验室内容易保存和操纵。我们对上面的问题已采用一种遗传方法,即我们改变植物的RNA并观察其对花的最终结构的影响,然后对研究中的机制做出论断。这些论断可用遗传实验和生物化学实验检测,其中有些实验还涉及设计和产生新的类型的花。
能否按照我们的愿望来重新安排和改造花,对于这个绝大多数人类以花的各部分(包括果实)或花的产物(如谷物)为食的世界来说不能被认为是无价值的。总有一天,当人们对花的发育模式有了更深入的了解时,必将能给我们创造出可产生最珍贵的花和果实的植物。我们实验室早已朝这个方向前进了。
即便是在我的合作者和我开始我们的关于花的模式形成的实验时,我们已知道遗传方法必定成功,育种工作者已在遗传上改变了许多园艺植物的品种,在他们所改造的花卉中显示出各种花器官的异常排列或数量。实际上大多数有价值的观赏花卉品种发育得千奇百怪,其中发生的遗传变异已干扰了花的模式发育的正常过程。例如,野生的玫瑰只有5个花瓣,而在我后院的杂交茶玫瑰已有35或40个花瓣。野生的山茶有雄蕊和心皮(由于必须有心皮,才能产生种子),可是,在我的前院是一株栽培的山茶(红美人)既无雄蕊亦无心皮——在应该出现雄蕊和心皮的位置上长着许多额外的花瓣。
从这些遗传变异体中,人们可以推断,改变植物的RNA顺序就能够在组成方式上变换花的正常的器官排列。因此,我们已经知道,我们通过考察突变体品种就会了解关于花的模式形成的遗传学的大量知识。不过,玫瑰和山茶的遗传分析是困难的,原因在于严密的研究需要大量的试验样品。而这些植物冗长的世代和大的体积对使用它们的基层研究实验室来说代价未免太昂贵。
因此,我们挑选一种能够迅速繁殖的叫做拟南芥的小草作为实验对象来开始我们的研究。在普通的室内光照下它也能良好生长,且其植株小到在桌子大小的台面上就足够几千株拟南芥菜生长到成熟。在欧洲和美国的许多地方,拟南芥是人们在湿地或草坪上最常遇到的植物,它的小枝上着满小而白色的花朵,成熟时则伸出装满小种子的无数果实。不管它的植株大小如何,拟南芥属(Arabidopsis)具有典型的显花植物所具有一切基本的特征。

正常的拟南芥属的花由4个同心的区域或轮生的区域所组成,每个区域由不同类型的花器官所占据。周边围着的是4片绿萼。第二轮围着的是4片白色花辦,花瓣内着生的是含有6个雄蕊的第三轮,最里面的一轮是两个融合的心皮所组成的子房。每朵花在开始发育时是一个原基,即花茎末端附近突出的一群未分化的细胞。经过细胞分裂、细胞分化和细胞伸长的组合——全都发生在精确的位置上——这种小的原基发育成为一朵花。因此,问题是原其的细胞怎样去认准其位置的。
我们最初的遗传实验考察的是花器官排列异常的突变体品系。我们期望鉴定出这样一些单个的基因,这些基因的蛋白质产物是花的模式(图形)形成所必需的:如果没有这些基因,正在发育的花的未分化细胞将错误判断它们的位置,而使正常的器官出现在不适当的位置上。我们用化学诱变剂甲磺酸乙酯处理种子和从我的合作者(如荷兰瓦格宁根农业大学的Maarten Koomneef)那里收集具有异常花的拟南芥属品系这两种办法,获得了许多突变品系。

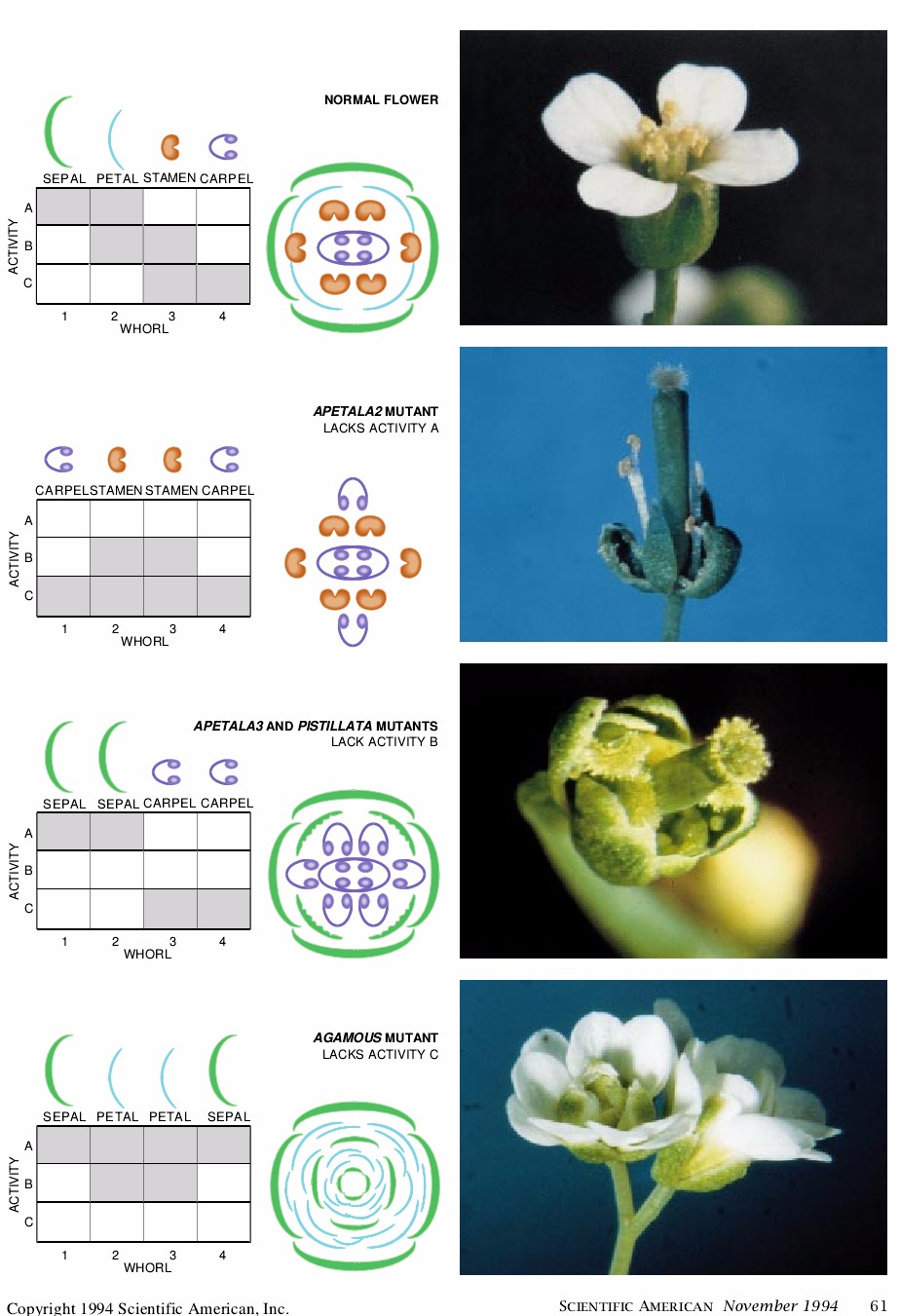
最初,我们把所有的拟南芥属的突变体的花划分成三类。一类,用突变方法诱导基因APETALA2失活,此类花在第一轮中着生的是心皮而不是萼片,在第二轮中着生的是雄蕊而不是花瓣。按照科学的惯例,Arabidopsis基因的名称全部要用大写字母书写,在这些基因中具有突变的植株用相同的名称,但以小写字体书写。
第二类是用突变方法诱发了APETALA3或PISTILLATA发生突变的。这些花的萼片着生于第一轮和第二轮,而心皮着生于第三轮和第四轮。
第三类突变体是基因AGAMOUS失活,各个花器官呈异常的辐射状排列:萼片-花瓣-花瓣-萼片。这些AGAMOUS突变体还具有附加的各器官的内轮,即在内轮中各器官重复在外轮中的模式。这些附加组成的存在表明AGAMOUS基因的产物,除了确定第三和第四轮中器官的同一性外,在确定第四轮后停止了花的发育。
这三种类型突变体中的每一种都缺失正常的花的模式发育所需要的不同的遗传活性。为简便起见,攻将之称为APETALA2突变体2的活性缺失,APETALA3和PISTILLATA突变体B的活性缺失和AGAMOUS突变体C的活性缺失。
即使只有这些少量的信息,我们也已经能够建立一个简单的暂时性的假设或工作模型,即这四个基因怎样可以正常地对规定发育中的花的器官的同一性的做出贡献。这个模型有三个部分。第一部分,由这些基因中的每个基因所编码的蛋白质在其基因受突变作用影响的区域中最初是活跃的。因此,A活性基因APETALA3作用于轮一和轮二,B活性基因APETALA3和PISTILLATA作用于轮二和轮三,而C活性基因AGAMOUS作用于轮三和轮四。

第二部分,这些基因产物的组合决定着由原基发育的花器官的同一性。只有A活性存在的区域中所形成的任何器官都将发育成萼片。在A和B活性均存在的区域所形成的任何器官都会变成花瓣。B和C活性的组合存在将产生雄蕊。如果只有C活性存在,那么出现的器官则是心皮。

模型的第三部分是A和C的活性是相互排斥的:有A的任何器官都将缺乏C的活性,反之亦然。如果A的活性消失(如APETALA2变体中所见),那么C将异常地出现于第一轮和第二轮内。相反,如果C缺失(如AGAMOUS变体中所看到的),那么A将异常地出现于第三轮和第四轮中。
这三条规则足以阐明由突变体形成的花。当然,事实上模型与例证的一致性并不能证明它就是正确的——此模型还必须受检验。
简单的遗传实验提供的只是一种类型的试验。这个模型对我们想要消除的成对的活性时会发生什么情况作了特定的预测。如果消除A活性和B活性——例如通过育成具有APETALA2和APETALA3的植株——花原基应该只有C活性(C将扩展到第一轮和第二轮,因为A活性缺失)。因此,这个模型预测所有的花器官应该是心皮。当我们进行这项实验时,证实了这一预测。根据相同的原因,如果B和C两者均消失,如在APETALA3-AGAMOUS组合的双突变体中所见到的那样,所有的花器官应该发育成心皮。结果确实如此。
从我们观察到的花的这些类型中,我们没有办法预先知道只有B活性的突变植株会出现什么类型的器官。尽管如此,该模型仍然告诉了我们,在第一轮和第二轮中发现的器官应该是同一类型,而在第二轮和第三轮中发现的器官应该是不相同的类型。当我们培育APETALA2-AGAMOUS双突变体(这些突变体中缺失A和C的活性)时,我们发现在第一轮的第二轮中着生有叶,而在第二轮和第三轮内长着介于花瓣和雄蕊之间的器官。
此外,在缺乏所有三种功能型基因活性的三元突变体的花中,全部花器官都分化成了叶。这些结果进一步证实了该模型,并表明A、B和C的活性看来不仅足以确定花器官之间的差异,而且还可以确定花器官和叶这种营养器官之间的差异。

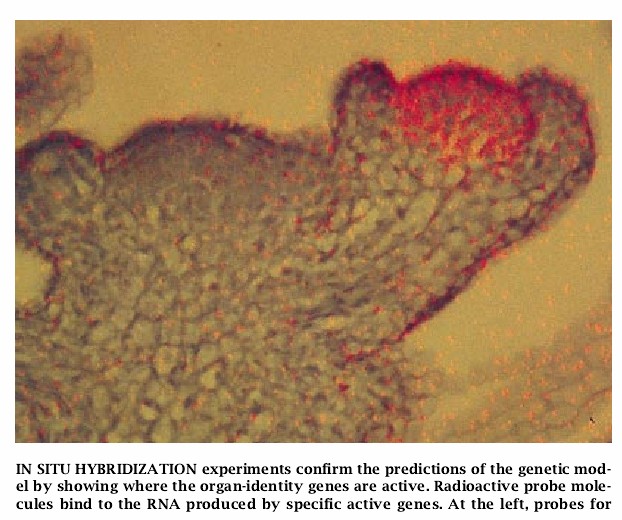
我们和其他研究人员克隆了确定花器官同一性的基因后,就进一步证实了我们的基本模式的模型。利用这些克隆系使人们得以使用已知的原位杂交技术去进行实验。我们利用这些克隆系作为模板创造了和这些基因的RNA互补的“反义”RNA分子。这些反义分子含有少量的放射性元素。
当对花组织进行切片时,反义探针结合到细胞中来自激活基因的任何互补RNA上。把一层薄乳液涂布在花组织上并暴露于探针的放射线下,我们就可以找到探针结合的地方,并因此而激活该处被研究的基因。
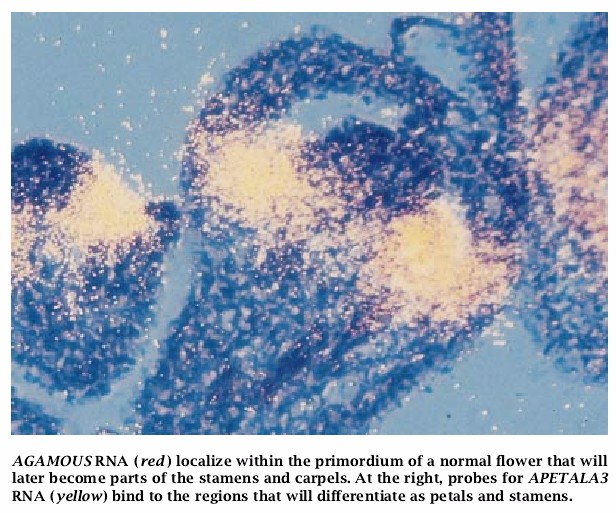
我们能够克隆的第一个基因是具有C活性的AGAMOUS探针与发育中的花的切片原位杂交证实了该模型的预测:来自AGAMOUS的RNA在花的发育中最早出现,而且只出现于后来成为第三和第四轮的原基的这些区域。

我们的遗传模型还表明,当A的活性缺失时,C活性应该异常地扩展到第一轮和第二轮。原位杂交再一次证明该模型是正确的。当我们检测APETALA2突变体的花时,我们在正在发育的花的全部第四轮中发现了AGAMOUS的RNA。后来,我们克隆APETALA3和PISTILLATA基因后,对B活性作了相似的探针实验。正如所料,这些基因在第二轮和第二轮内是活跃的。
克隆这些器官同一性的基因使原位杂交实验成为可能,而且还带来了另一个更为长远的要达到的好处。我们通过分析基因的RNA就可以开始了解它们生产的蛋白质,并观察它们在亚细胞水平上怎样发挥作用。
例如,AGAMOUS基因编码的相当大的一部分蛋白质从其蛋白质组成的氨基酸順序来看,和在酵母、人和其他生物中发现的蛋白质非常相似。已知道这种类型的蛋白质会去结合DNA并调节基因向RNA的转录。换句话说,这些蛋白质起着分子开关的作用,通过与其附近特定的DNA顺序相结合而启开或关闭其它的基因。

在德国汉诺威医学院执教的A. Nordheim和他的同事已证明AGAMOUS白质的确结合到DNA上去了。因此,很显然,AGAMOUS蛋白质象其他类型的蛋白质一样可以起到调节的功能。
我们至今仍然不知道,在拟南芥属花中AGAMOUS蛋白质结合和调节的是哪些基因,但我们能够假设它控制着一系列下游基因的活性。那些基因本身就可能是其它基因的调节者,或者它们可以制造一种花细胞类型与另一种花细胞类型相区别的最终蛋白质产物。顺便说一句,和AGAMOUS相关的人体蛋白质制造一种叫做血清应答因子的蛋白质,这种蛋白质能调节它可能含于人的癌细胞内的致癌基因cfos。人和植物基因控制之间这种明显的相似性是生命进化统一的基础。
正当我们克隆拟南芥属的AGAMOUS,设在科隆的马克斯▪普朗克植物育种研究所的Hans Sommer、Zsumanna Schwarz Sommer和Heinz Saedler以及他们的同事也正忙于克隆金鱼草属中取名为DEFICIENS的基因。DEFICIENS在那些植物中(与拟南芥属有远缘关系的植物)提供与B活性相等的活性。认识DEFICIENS的突变体已有数十载之久。值得注意的是,DEFICIENS与AGAMOUS结合相同类型的DNA之蛋白质的一员,这暗示其它的花的模式也可能相似。
后来,德国的科研小组克隆了金鱼草属的一系列调节基因。迄今为止,在由这些基因编码的有关蛋白质顺序中和在因失去它们而出现的模式异常的类型中,金鱼草属的基因与拟南芥属的基因彼此是相符的。我们和我们的德国同事还在每种植物中发现这个基因族的许多成员与任何已知的花的突变体并不相关,但在发育中花的各部分中仍有活性。
因此我们得以描述这样一小组调节基因,这些调节基因以高度特异性的模式激活通过一系列调节了过程而控制其它基因,从而决定着器官的同一性。不过,已知的这些调节基因在花发育的早期阶段是怎样找到正确位置的呢?
回答是这些基因本身只是在调节级联过程的中途而不是在开始时来到(出现)在正确位置的。表达器官同一性基因的细胞,甚至在那些基因启动之前就必须与它的邻居有所区别。未来将显示器官最终结局的区域之同轴区必然早已确定。因此,器官同一性基因在胞内interpretation的位置代表着最基本的步骤,尽管它们本身并不包括在最初的establishment的差异上。
另一组甚至更早在发育中起作用的调节基因,看来是在花内确定位置的区域。这些基因中有一个叫做SUPERMAN(超人)。萨斯坎彻温大学的George W. Haughn和他的同事还曾以F-LO10的名字对SUPERMAN进行过研究。在植物缺失这个超人基因的花中,第四轮内不含心皮,而含有额外的雄蕊(这就是为什么把该突变体风趣地取名为superman的原因)。根据遗传学模型,这一模式意味着在这些突变体花的第四轮中有B活性存在,这本身就表明SUPERMAN基因通常阻碍着第四轮中的B活性。
如果是这样的话,那么我们就能假设具有两种基因突变的花看起来会像APETALA3突变体:如果APETALA3没有作用,那它是否调节得不适当均无关系。育种试验已证实了此种预测。相类似的,SUPERMAN和APETALA3证明有另外两个特点:缺少SUPERMAN和AGAMOUS两活性的突变体围绕三轮花瓣的将是萼片,而SUPERMAN-AGAMOUS- APETALA2的三元突变体围绕介于雄蕊和花瓣之间的三轮器官的将是叶子。
原位杂交的试验中也支持SUPERMAN调节B活性基因的观点。来自APETALA3和PISTILLATA的RNA除出现在第二和第三轮的常见的位置之外,还出现在SUPERMAN突变体的第四轮中。
SUPERMAN基因的功能解释了在第四轮中为什么B活性基因不打开的原因。然而,它并未解释在花发育中这些基因在第二轮和第三轮中为什么可以打开。答案看来是含有一个甚至能更早起作用的基因LEAFY。缺少有活性的LEAFY基因的植物的花既没有花辦也没有雄蕊,在其位置上是许多类似于萼片的器官。但是这些器官不是长在同心环内,按照正常的情况这器官应该长在第二轮和第三轮内。而这些器官以螺旋形排列出现——在拟南芥属植物的茎上叶的位置就体现了这种相同的排列方式。
LEAFY基因看来通常在花内控制着第二和第三轮的细胞,第二轮和第三轮的细胞如果缺乏这种信息,在模式中细胞分裂一般发现在花之外的茎上。由于这些器官看来像萼片,人们可以把它们视为A活性的存在,对于A基因的最初活化来说是不需要LEAFY。由于LEAFY突变体花的中心可能出现心皮,对C活性的激发来说看来亦未必需要。
可是,LEAFY对B活性的开始表达仍然显得是重要的。因为没有它,花瓣和雄蕊就不能形成。即使在规定器官的相关位置和基本顺序这些更为重要的功能上,它必定亦是关键。
遗传和分子实验的结果与上述结论是相符的。缺少LEAFY和APETALA3两种基因的功能的突变体与只缺少LEAFY突变体的表现是相同的:没有一个突变体有B活性。同样地,在LEAFY变体中,来自APETALA3的RNA的总量要比来自正常花的少得多。因此,LEAFY的蛋白质产物或许是APETALA3的活化剂。
为搞清楚LEAFY基因何时活跃而进行的试验,其结果亦与将其加到我们原有的遗传模型的结果相一致。英国诺威奇的John Innes研究所的Enrico S. Coen和他的合作者已克隆了一种基因,其功能与来自金鱼草属LEAFY基因的功能相当。我们应用该基因作为探针,就能克隆来自金鱼草的LEAFY。根据对RNA的基础研究,LEAFY和有关的金鱼草属的基因看来在花的发育中是已知有话性的最早的基因。当原始的细胞团最初形成花原基时,它们的RNA产物在器官同一性基因变得活跃之前就早已出现了。
其它基因的突变表明,在花的发育中它们也在早期起作用,而且不用怀疑同时还将发现更多的器官同一性的基因。至少我们看来似乎对控制拟南芥属花的发育之遗传分层的轮廓仍然有了些认识。正如John Innes研究所和马克斯•普朗克研究所的科研小组已经阐明的那样,拟南芥属基因与金鱼草属中已知的那些基因是不相上下的。根据新近的研究,在其它花的发育中有关基因仍指令着模式的形成。因此这里所叙述的花发育的遗传模型可以适用于有一个基本模式的或甚至是全部模式的很多花。
有了预测性遗传模型并了解了规定花器官的一些基因后,目前一些研究人员在控制花的发育方面已达到了相当可观的程度。采用克隆的基因去改变基因编码的蛋白质或其作用的方式,以及再次把它们导入植物中去按人们的意愿改变花的发育,都是可能的。
我以前的博士后研究生Martin F. Yanossky(现在加州大学圣迭戈分校执教)和我们实验室之间合作实验的课题也许会成为未来常规实验的先驱。用AGAMOUS基因的克隆株作研究,我们改变了将AGAMOUS基因在何时以及何处激活的调控顺序,我们用来自所有细胞中表达的不同基因的顺序来替换了这些顺序,然后我们将重组体基因插人菸草植株。正如我们的预料,所产生的植株在通常是由萼片占据的位置上着生的是心皮(并发育有种子),而平常必定是花瓣着生的地方长成了雄蕊。
这一类型的菸草植株并无直接用途。尽管如此,它们生动的证明,我们日益增长的对花发育分子基础的理解已赋予我们控制某些植物的结构和功能的能力。
【赵裕卿/译 颂平/校】
请 登录 发表评论