一种在人的胎盘中意外发现的激素证明能够影响分娩的定时。这一以及相关的发现有可能提供防止早产的急需方法。

在过去的30年时间里,医生拯救早产儿——在孕期的第38周之前而不是更具有代表性的第40周出生的婴儿——的技能越来越高。遗憾的是,幸存的早产儿时常患有呼吸困难、大脑性麻痹、智力障碍及其它病症。
在所有新生儿中,早产儿占6%-8%,或许多达半数的早产儿属于自发性早产儿。因此,从理论上讲,以医疗措施防止这类早产发生有可能使大量婴儿免于死亡或终身性残疾。
然而,这类预防措施已完全失败。其原因是什么呢?直到不久以前,对于调控分娩定时的生物学机制,科学家们几乎还是一无所知,因而也就无从知道如何使这种机制避免错误运作。
在过去几年时间里,几家中心(包括澳大利亚纽卡斯尔大学笔者的实验室在内)的研究人员已对分娩定时的调控机制有了清楚得多的认识。在有了这样一种认识的前提下,我们开始探查几种关于避免早产和将分娩推迟到胎儿已成熟得能在母体外茁壮成长之时的激动人心的新观点。
新近得到解释的这种机制所决定的实际上并不只是分娩的确切时间,它调节着分娩的全过程——使分娩成为可能的子宫的、宫颈的和其它方面的变化。于是,通常发生于人类孕期的最后两周的分娩便以胎儿娩出而终结。
进展的起点
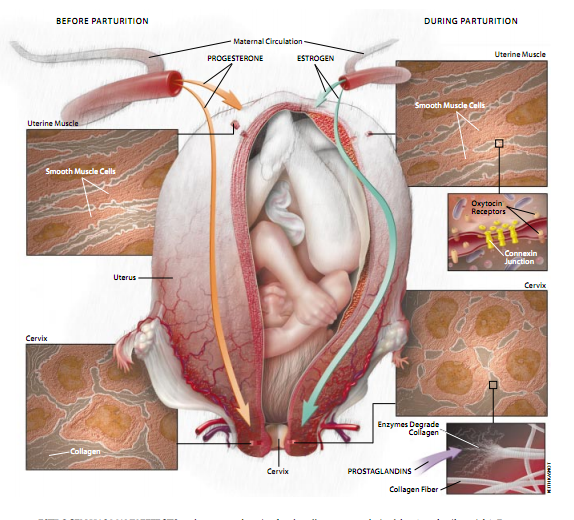
解释分娩的调控机制的最新进展是在对分娩本身的许多认识的基础之上形成的。具体说来,一些时候以来,科学家们已经知道,在整个孕期的大部分时间里,子宫基本上是一个由分离的平滑肌细胞构成的松驰的袋子。这个袋子的底部由一个紧密闭锁的环——子宫颈——封闭,坚韧的胶原纤维使子宫颈保持牢靠和固定。上述结构性特征是由黄体酮(孕酮)维持的,这种甾类激素是从孕期初期起,由胎盘分泌到母体的循环系统中的。然而,除了黄体酮以外,胎盘还要分泌雌激素,这种甾类化合物起着对抗黄体酮和促进收缩的作用。
起初,母体的雌激素含量相当低,然而随着时间的推移会升高。分娩一般始于力量平衡改变之时,也就是雌激素和其它促进收缩的力量胜过阻止收缩的力量之时。
值得注意的是,随着母体雌激素含量骤然增高,子宫肌层细胞会合成一种称为“连接蛋白”的蛋白质。然后,连接蛋白质分子转移到细胞膜,从而形成以电荷使肌细胞相互连接起来的胞间连接。一旦形成了一个电连接网络,子宫肌细胞就能进行协调的收缩。与此同时,雌激素促使子宫肌细胞呈现大量的催产素受体,这种由脑部产生的激素能增强子宫的收缩力,从而促使容有胎儿的子宫分娩。
随着子宫肌为分娩作好准备,雌激素还会促使子宫颈上方的胎盘屏障产生称为“前列腺素”的化合物。前列腺素诱使宫颈产生能消化其胶原纤维的酶,于是这些酶将宫颈转化成一个有韧性的结构,随着分娩过程中的胎儿头部对宫颈的压迫,这一结构将逐渐扩大,最终完全张开。
在上述所有变化一一发生的同时,由胎儿的肾上腺产生的另一种激素皮质醇确保胎儿的肺部经受呼吸空气所必需的最后一些变化。尤值一提的是,高含量的皮质醇导致一些物质的产生,这些物质能去除肺中的羊水,并使肺能够充气膨胀。
正当研究人员进一步认识雌激素对分娩所起作用的时候,启动胎盘雌激素分泌的“开关”的性质(是在胎儿身上还是在母体身上)却仍然使之感到困惑。出于操作上的和伦理上的一些原因,发育中的人类胎儿、胎盘以及孕妇身上发生的生物化学变化极其难以得到密切研究。因此,生物学家们从以其它大体型哺乳动物(尤其是绵羊)进行的实验研究中,探寻并找到有关分娩调控机制的许多线索。
绵羊的系统呈现出来
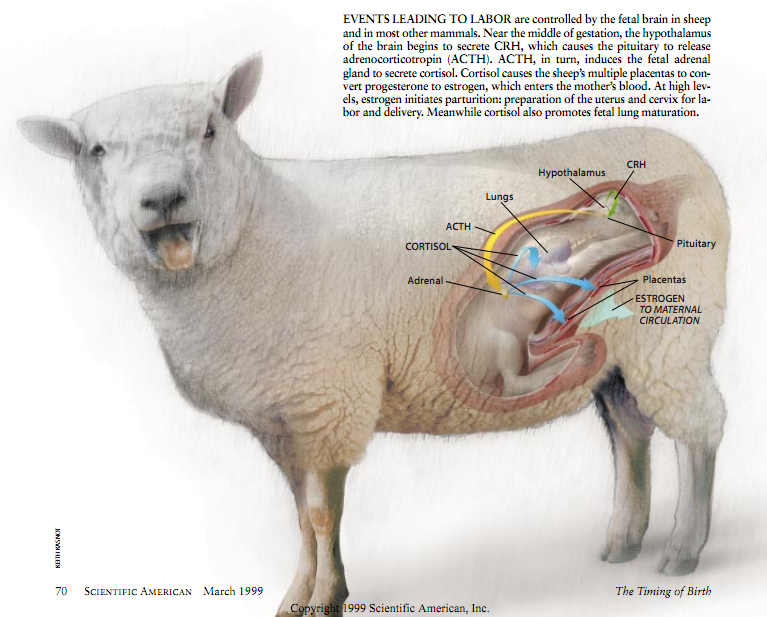
上述研究最初是在本世纪60年代由新西兰奥克兰国立妇女医院(the National Women’s Hospital)的格雷厄姆·C.(“芒特”)·利金斯((“Mont”)Liggins)率先进行的。到80年代中期以前,上述研究已查明了绵羊的基本分娩调控机制。同样的机制在大多数哺乳动物身上起作用。
从接近绵羊孕期中点的某个时刻起,发育中的胎儿大脑的丘脑下部开始分泌称为“促肾上腺皮质素释放素”的激素,这种激素促使大脑底部的脑下垂体将促肾上腺皮质激素(ACTH)分泌到胎儿的循环系统中。ACTH令胎儿的肾上腺产生皮质醇。这种激素又激活胎盘中的一些酶,这些酶将黄体酮转化成雌激素,结果分泌到母体循环系统中的黄体酮数量减少,而雌激素的数量则增多了。当胎儿体内的皮质醇含量达到很高时,皮质醇也能促进肺的成熟。
正如未怀孕的人一样,就未怀孕的母羊而言,皮质醇是所谓的负反馈系统的一部分。皮质醇反馈到下丘脑和垂体,以减少ACTH的释放量并减少皮质醇的产生,这样皮质醇的含量就能保持稳定,而不是不断上升。然而,(出于一些尚未得到解释的原因),孕期接近结束时胎儿体内的皮质醇缺乏这种刹车作用。结果;在绵羊孕期的最后一个阶段,胎儿体内的ACTH和皮质醇含量以及母体内的雌激素含量不断上升。最后,母体的雌激素含量变得足够高,而黄体酮的含量则变得足够低,分娩过程由此开始。
令人失望的是,随着这一有条不紊的过程的各个部分被一一揭示,对人的研究表明,一个主要的特点没有在人身上起作用。和绵羊的情况一样,胎儿的皮质醇显然未能有助于人类肺的成熟;给予发生早产的妇女的类皮质醇药物确实减少了婴儿患呼吸困难的可能性。然而,皮质醇对分娩毫无作用,并且不能促使孕妇分娩。
如今,所收集到的证据表明,CRH不仅能促进胎儿的皮质醇分泌,还能促进胎盘产生雌激素,从而促进人类和绵羊的分娩。不过,令人吃惊的是,人类的CRH大部分并非来自胎儿大脑,而是来自胎盘。此外,CRH促使人类胎盘分泌雌激素的途径显然不同于绵羊以及其它大多数灵长类哺乳动物。
人类的胎盘“钟”
胎盘分泌的CRH在人类的分娩上起着重要作用的线索最初是在本世纪80年代出现的。80年代初期,东京女子医学院的Tamotsu Shihasaki及其同事得出了惊人的发现——人类的胎盘含有CRH。这一发现之所以令人吃惊,是固为当时人们一度认为只有大脑才能产生CRH。
也是在80年代,各个研究小组证实,接近孕期结束时,来自胎盘的CRH变得可以测出并且在母体血液中显著增多然后便消失了——种种迹象表明,CRH可能在分娩上起着某种作用。同样有启示意义的是,80年代后半叶,英国和美国的临床医师发现,发生早产的妇女分娩时的CRH血液含量高于在怀孕同一星期作了CRH检查但没有发生早产的妇女。
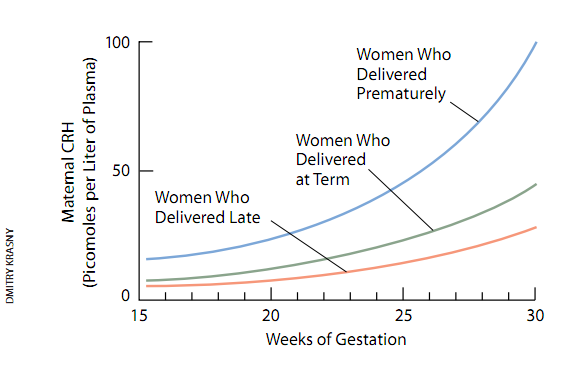
大约与此同时,名叫马克·麦克莱恩的年轻医学院毕业生作为博士生加入了笔者的研究小组。在其学位论文中,他对CRH与分娩的发作的可能联系作了更为严格的检验。他对近,500名妇女孕期的各个阶段都作了血液取样探查了CRH,并试图查出CRH含量与分娩定时的关系。这项工作不仅艰巨而且花了多年时间,但最后在90年代中期时,对结果的分析总算完成了。
初看上去,上述研究结果似乎并无惊人之处。它们证明,母体的CRH血液浓度随着孕期的推移而升高。此外还发现,CRH的血液含量在整个孕期中按指数律升高。然而,随着我们对研究结果的仔细审查,某种更令人感兴趣的东西变得明显起来——孕期l6周至20周(我们现有的工具所能探查到的最早的阶段)的CRH值大致预示着孕妇的产期。此外,CRH含量最高的孕妇最有可能发生早产,而CRH含量最低的孕妇则最有可能在预产期之后分娩。
换句话说,麦克莱恩揭示了从怀孕初期起设定并调控着怀孕的进展速度的“钟”的存在。通过观察母体血液的CRH含量,可以解读这种钟(尽管相当粗略)。现在看来似乎很有可能是,CRH的产生速率本身调控着怀孕的持续时间,尽管当时我们只能认为,胎盘的CRH产生只是另外某个使分娩过程真正和谐地一体化的过程的副产物或标志。
上述研究结果比我们所预计的还要激动人心。除了增进对人类分娩机制的基本认识以外,它们还通过孕期相当早的时候测定CRH的含量而增加了医生发观早产妇女的可能性,这种发现想必会警告这些期望孩子出生的妇女她们必须得到严密监测,并且必须在有新生儿特护部的医院分娩此外若能发现有早产危险的妇女,科学家们就能对新的预防疗法进行系统的试验,并将治疗结果同已知有早产危险但未进行治疗的对应妇女人群进行对比。
目前,CRH分析尚末成为常规检查,部分原因在于用于检查的最佳方法以及作检查的最佳时机尚在评估之中。不过,将来很有可能作这种检查。笔者应当指出的是,CRH含量人与人之间相差很大,并且CRH含量正常或低并不能保证不发生早产。在某些情况下,即使CRH含量最初并未升高,但胎儿的感染或其它一些事件也会导致早产。
为何如今许多研究人员都认为,胎盘的CRH控人类的分娩定时上起着某种关键作用,而不仅仅是某个更强有力的调控过程的标志呢?是因为过去10年里的研究结果影响了他们,这些研究结果表明,通过一种分子级联,CRH有可能导致分娩所必需的雌激素含量升高。
CRH如何调控分娩过程
当然,人类的分娩是由一个略微不同于绵羊的过程调控这一点变得很清楚的时候,许多研究小组使开始研究人类的近亲,即非人类的灵长类动物。与绵羊相比,对猴和猿的研究更难进行,然而只有猴和猿的胎盘才和人类相似,在整个孕期中不断产生CRH。
80年代末期,笔者以及哥伦比亚大学的罗宾·S·戈兰德(Goland)的研究小组(独立地)开始研究狒狒。我们都发现与人类孕妇CRH含量持续升高不同的是,狒狒的CRH含量在怀孕初期急剧升高,然后落到中等高的水平,并在孕期的剩余阶段保持这一水平。这一发现使我们确实感到困惑不解,直到1996年的某一天,当时,我正坐在国际内分泌学会议的一个演讲厅里观看两位主要的狒狒妊娠研究专家——马里兰大学的尤金·D·阿尔布雷希特和东弗吉尼亚医学院的杰拉尔德·J·佩普(Pepe)——演示胎儿肾上腺的发育过程。
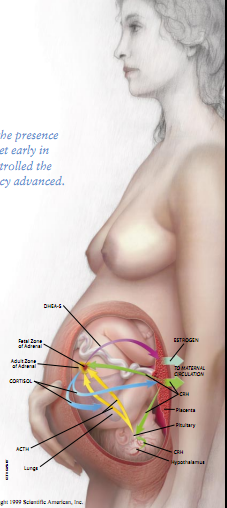
当时,研究繁殖的科学家们已经知道灵长类动物胎儿的肾上腺既不同于绵羊胎儿,也不同于成年绵羊和成年灵长类动物。灵长类动物胎儿的肾上腺没有分化成一个中央髓和一个能分泌皮质醇的外皮层,没有髓。皮层由两部分构成,其中大多数仅含有一称为“胎儿肾上腺区”的内区。胎儿肾上腺皮层较小的靠外面的部分仍在产生皮质醇,而胎儿肾上腺区则在产生称为“脱氢表雄酮硫酸酯”的一种甾类激素。
同样与绵羊研究结果不同的是,灵长类动物的胎盘缺乏对皮质醇敏感的由黄体酮产生雌激素所必需的酶。相反,灵长目动物胎盘是由DHEA-S产生分娩所必需的雌激素。(这一活动可以解释为何与绵羊不同。人的孕期结束时,黄体酮含量并未降低。人的胎盘不能利用黄体酮来产生雌激素,因而黄体酮能够继续存在,并能进入母体的循环系统。)
阿尔布雷希特和佩普的数据表明,狒狒胎儿肾上腺的相对尺寸——相对于胎儿体积的尺寸——是以一种非常有趣的方式形成的。人类和猕猴的相对尺寸在接近孕期结束时达到最大,而狒拂的相对尺寸则是在孕期中间为最大。此后,狒狒胎儿的肾上腺区生长得较为缓慢并在分娩之后消失。
在观看他们的幻灯片时,我注意到,狒狒胎儿肾上腺的变化模式是与怀孕的狒狒胎盘的CRH含量的升降对应的。很有可能是来自胎盘的CRH直接或间接地调控着来自拂狒胎儿肾上腺区的DHEA-S的分泌。CRH在人体内所起的作用是否与狒狒相同,从而导致胎盘的雌激素分泌量在孕期结束时显著增加?
我迫不及待地开始检验这一观点。回到纽卡斯尔后,笔者及其同事迅速证明了人类胎儿的肾上腺组织含有CRH受体,这表明人类胎儿肾上腺的组织对CRH的信号是敏感的。然后,我们和加利福尼亚大学(旧金山)的罗伯特·B雅费以及萨姆梅西恩诺(Mesiano)一起证实人类胎儿肾上腺区细胞通过产生DHEA-S而不是皮质醇,确实对CRH敏感。(人类胎儿肾上腺区细胞还能随着来自垂体的产生DHEA-S。)
CRH的其它作用
要使分娩只是在胎儿已作好宫外生活准备的情况下才发生,分娩的调控机制不仅必须确保分娩之前雌激素达到高含量,还必须确保已为胎儿肺的成熟产生足够的皮质醇。胎盘的CRH显然也必须达到这一要求。正如哈佛医学院的约瑟夫·A马瑟伯(Majzoub)所提出的那样,胎儿循环系统中的胎盘CRH很有可能促使胎儿的垂体释放出ACTH,从而促使胎儿的肾上腺产生肺成熟所必需的皮质醇。换句话说,胎盘的CRH很有可能起着协调胎儿发育和分娩,从而确保分娩开始时胎儿已作好出世准备的作用。
其它研究表明,CRH除了促使胎盘产生雌激素和促使胎儿肾上腺产生皮质醇以外,还直接对子宫和宫颈起作用。在这样做的过程中CRH可能促进雌激素所引起的变化,或者有时可能也起着补偿雌激素分泌不足的作用。
例如,英国的一个研究小组有某种证据证明,母体循环系统中的CRH和雌激素一样,可以提高宫颈的前列腺素浓度,从而促使宫颈软化。此外,英国和意大利的研究人员已以人类的子宫肌条证明,用CRH培育子宫肌,能够提高由包括催产素在内的其它物质引起的收缩的效力。
此外,据英国沃里克大学的爱德华·W·希尔豪斯和迪米特里·格拉马托波罗斯(Dimitri Grammatopoulos)报道,几种不同形式的CRH受体都可以出现在子宫肌细胞上,并且在分娩过程中,CRH受体的混合也会发生变化。在怀孕初期,CRH结合的受体通过引起通常促进子宫肌细胞舒张的胞内反应而产生作用。此后,处于分娩过程中的子宫上面的CRH受体促进子宫肌的收缩。
然而,是什么促使胎盘产生CRH并调控着CRH的产量呢?如今,这两个令人着迷的问题尚未得到解答。然而,马瑟伯和澳大利亚悉尼大学医学院的布鲁斯·鲁宾逊已证明,一旦胎盘开始分泌CRH,皮质醇就能维持以后的分泌。可能促使某个人从孕期一开始就产生出比他人更多的CRH的因素包括怀孕初期母体的营养差异以及胎盘中产生CRH的细胞遗传构成上的微小差异。
就人类而言胎盘产生CRH(大约从怀孕第l2周起开始产生)似乎是慢慢开始的。最初,CRH促使发育中的胎儿肾上腺区分泌少量的DHEA-S,胎盘将DHEA-S转化成雌激素。与此同时,来自胎盘以及或许还有来自胎儿大脑的CRH指令肾上腺的另一部分将一些皮质醇分泌到胎儿的循环系统中。正如马瑟伯和鲁宾逊所提出的那样,这种皮质醇进一步促使胎盘分泌出CRH,从而形成一个“前馈”体制,在这一体制下,CRH的分泌永远不会停止。在CRH,雌激素,前列腺素以及或许还有其它因素的临界阈限都已被突破的情况下,子宫和宫颈就会发生许多变化,而分娩也由此开始了。
进一步的复杂性
然而,上述情节并不完整。与其它一些自生自存的因素不同的是,前馈体制可以影响分娩胎儿的体积,也可以起到某种作用。成熟的胎儿可以扩展子宫肌,这种扩展可以增强子宫肌对收缩刺激的应答。
据澳大利亚阿德莱德大学的I·卡罗琳·麦克米伦(McMillen)说,胎儿的营养状况也可以起到某种作用,她提出,就绵羊而言,营养丧失有可能导致早产。当胎儿长大并且胎盘开始老化时,就有可能出现营养丧失。在人类中也已观察到支持这一观点的证据。怀孕的犹太妇女在赎罪日实行斋戒,因而减少了对其胎儿的营养供应,其分娩率在此期间也达到高峰,而在赎罪日期间,在居住在同一地区但未实行斋戒的贝都因妇女中则未观察到这一高峰。或许是营养不足的压力激活了胎儿的应激反应系统(stress system),该系统牵涉到胎儿下丘脑的CRH产量下丘脑的CRH产量预计会提高ACTH和皮质醇的含量,从而增强整个导致分娩的系统的活性。
雌激素和CRH两者都能增强子宫肌的收缩力,这一发现使问题进一步复杂化了。我们已经提出了一种似乎调控着分娩的事件顺序,然而上述调控机制的各个方面似乎很重复。例如,CRH对子宫肌的直接作用在大部分时间里或许都是次要的,而雌激素的产生一旦受到破坏,则CRH就会起更为关键的作用这种重复性所起的可能不只是安全网的作用正如圣菲学院(the Santa Fe Institute)的斯图尔特·A·考夫曼(Kauffman)所指出的那样,复杂系统的重复性可以使这种系统演进。若是一个重复的路径的改变能够改善该系统的运作则这一改变就将得到保留,若这一改变是有害的则显然额外的路径就有可能防止这一改变恶化到致命的地步。
为了弄清调控着人类分娩的这种机制是如何演进的,笔者及其在纽卡斯尔大学的同事正在与加蓬的弗朗斯维尔国际医学研究中心(the International Center for Medical Research of Franceville)的E·吉恩·维金斯(Wickings)和其他人一起进行合作研究。在上述研究中我们试图大致弄清灵长类动物是何时获得比其它哺乳动物更复杂的分娩调控机制的。此外我们还想知道为何会发生这种变化。
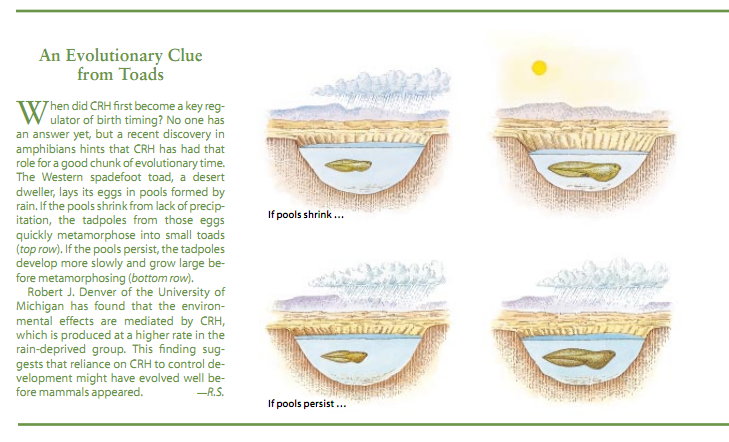
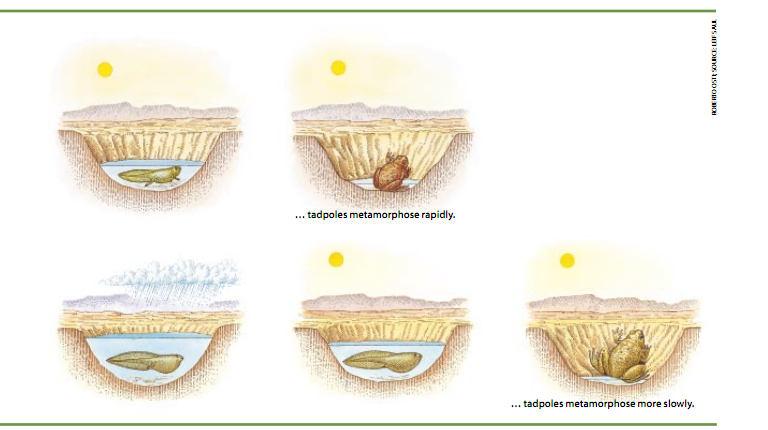
然而,有一点很清楚,那就是把CRH作为胎儿发育进程的主要调控因素来依靠在进化史上占有漫长的一段,其源头或许可以追溯到哺乳动物加入地球上两栖动物以及其它动物的阵营之前。例如,密执安大学的罗伯特·J·丹佛有证据证明,CRH可以影响栖居在沙漠中的西方锄足蟾(Seaphiopus hammondii)的蝌蚪的发育和变成蟾蜍的速率(见框内文字)。
和进化上的问题一样吸引人的是研究分娩的主要原因是要找到预防早产的方法。改进对人类分娩调控机制的认识已带来一系列的治疗方法。
干预的前景
作为一个恰当的例证,我们以及其他研究人员正在探查CRH作为早产预防抑制剂的价值。通过与美国国立卫生研究所的乔治·P·克罗索斯(Chrousos)的研究小组的合作,笔者及其在纽卡斯尔大学的同事最近得以证明一种称为“安塔拉明”(aatalarmin)的CRH拮抗剂可以延迟绵羊的分娩。若是这种拮抗剂能在非人类的灵长类动物中证明是安全有效的,那就肯定会在以后进行人体试验。催产素拮抗剂的人体试验目前正在进行之中,妇女的初步试验数据意味着前列腺素阻断剂可能也能用来延缓分娩。
发现早产高危妇女的研究工作也在进行之中。除了探查测定CRH在母体血液中的含量的价值以外科学家们还在查找早产的其它标志。笔者的实验室正在确定宫颈的胶原纤维降解酶的不当升高是否可以用作发现有早产危险的孕妇的标志。
在一项有趣的偶然发现中,笔者的研究小组得以证明,母体的CRH含量可以成为人工引产能否成功的有效标志。CRH含量高的孕妇比含量低的孕妇更有可能对引产措施产生反应。
目前看来,无论是对于创造发现早产高危孕妇的检查方法,还是对于开发调整CRH产量或以其它方式放慢调控分娩定时的胎盘钟的药剂,道路似乎都是畅通无阻的。这类面向应用的研究将会得到更基础性的研究所创造的许多成果的帮助。通过相互协调和配合,这两种研究就有希望实现一个宝贵的目标——让更多的孩子有希望实现其全部潜力,使时常与早产形影相连的体格和教育上的障碍无从产生。
【刘忠玉/译 冉隆华/校】
请 登录 发表评论