细胞怎样处理抗原
Victor H. Engelhard

细胞显示由它自己少量的蛋白质和入侵生物的蛋白质制造的分子复合体以告诫免疫系统有侵染存在。
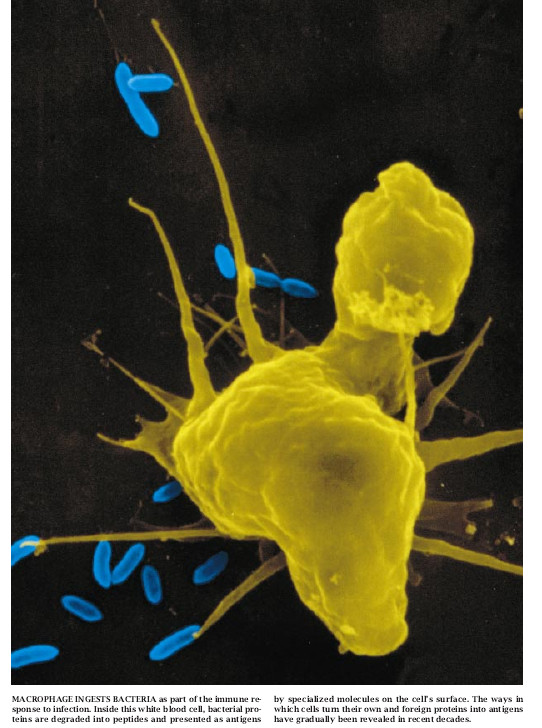
一切多细胞生物都具有比较原始的防御系统,以鉴别宿主体内的外来病原体并予以消灭之。此外,高等脊椎动物已进化成更为高级的免疫系统,它能判别各种病原体并对其做出选择性的应答。此类特殊免疫性的优点是免疫系统能够迅速地适应于在局部环境中经常相遇的那些病原体。
在生物分子水平上,脊椎动物机体的免疫系统的监视依靠于对抗原——免疫学的靶分子——即入侵者存在的信号之搜索。抗原绝非只是病原体的断片。相反,它们往往是由宿主细胞从少量病原体蛋白质和从叫做主要组织相容性复合体(MHC)的细胞蛋白质构建成的分子。抗原的加工处理和装配是所有免疫应答的灵活性、特异性和彻底性之关键。
抗原的处理以及免疫系统能够探查到它们在细胞表面的存在是一种极为复杂的现象。研究人员早已经相当详细地了解到了许多步骤。最令人感兴趣的是,抗原的处理直接依赖于细胞内合成和再循环所有的蛋白质以及将其在胞内各区域之间运转的机制。因此,更深入地了解抗原的处理澄清有病的细胞内和健康的细胞内在分子水平上发生的情况。这项研究的好处是最终将可对从感染到癌症的一系列疾患采取更适当的治疗方式。
在继续讨论抗原的处理之前,简要回顾一下免疫系统工作的一些情况也许是有帮助的。为产生特殊应答,免疫系统要使用大量的被称为淋巴细胞的白血细胞。淋巴细胞具有能以高亲和力结合抗原的表面受体。每个淋巴细胞表达的是结构的略为不同受体;因此每个淋巴细胞只对一种类型的具有特异性。免疫学家们估计,一个正常人体内的淋巴细胞总量可表达108%以上不同的抗原受体。这种完美的技能使免疫系统得以对它所遭遇的几乎所有的外来抗原都做出锐敏的特异性应答。
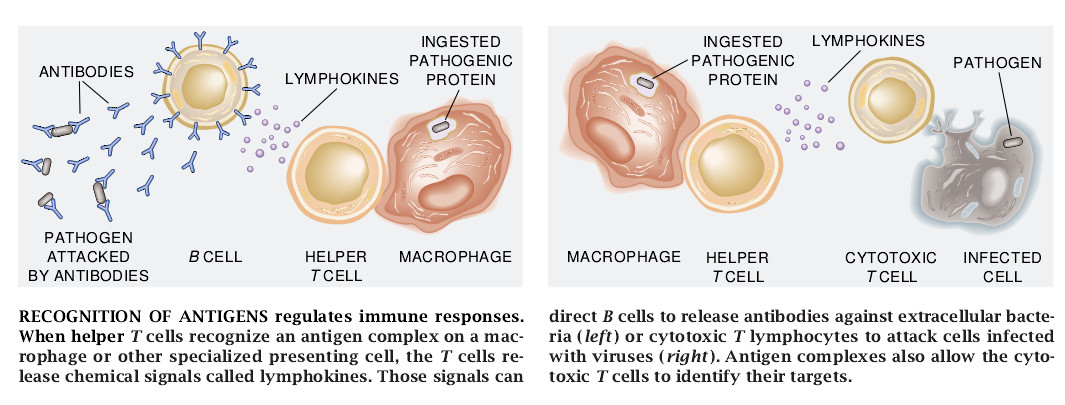
免疫系统使其应答的质量适应于病原体的特性及其入侵机体的方式。许多细菌和像蛔虫之类的大的寄生虫在血流或消化道这类机体的胞外空间形成侵染。为防治这些生物体,免疫系统部署了由β淋巴细胞制造的叫做抗体的可溶性抗原受体。抗体可直接结合寄生物并为其它免疫分子和免疫细胞的破坏作用提供目标。
病毒和许多其它的细菌以及引发疟疾、昏睡病的利什曼病等的原虫寄生虫并不是如此易于受挫的。它们在宿主细胞建立抗体接触不到的侵染点。要阻挡这些生物体,免疫系统的另一分支开始起作用。宿主细胞在其表面载有MHC分子。在被感染的细胞里,这些MHC分子与来自寄生物的小分子肽或蛋白质片断相结合并将其显示。寄生物肽和宿主MHC分子的复合体形成能被细胞毒性即杀伤性T淋巴细胞识别的抗原。T淋细胞能以此种方式鉴别和有选择地杀死受侵染的细胞,而把健康细胞保护下来。因此,肽-MHC复合体的功能之一是作为细胞受侵染的一种信号。
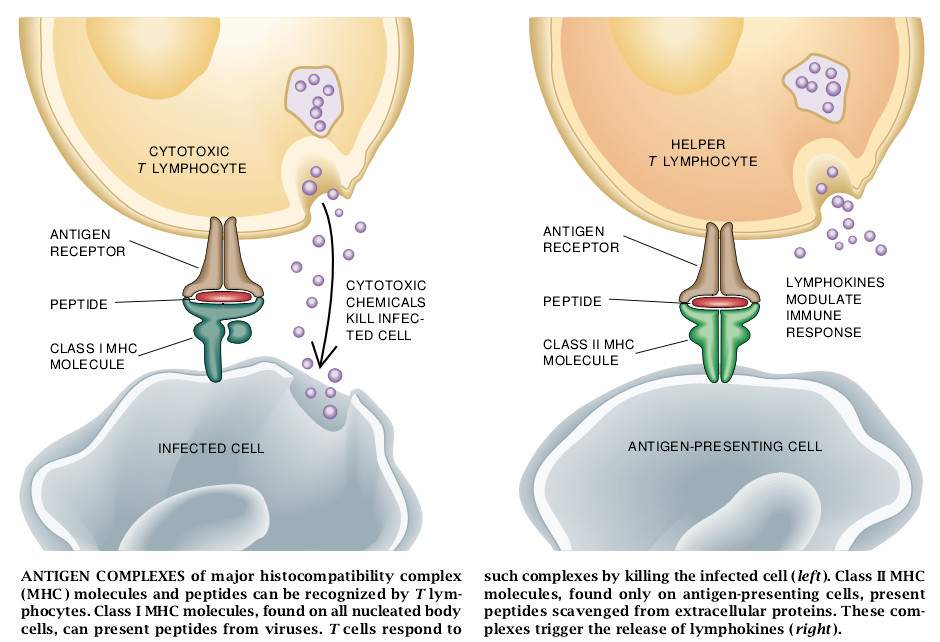
肽-MHC复合体在调节免疫应答方面也是重要的。有些特化细胞(比如叫做巨噬细胞的白细胞)巡行在机体内,吞食被它们发现的胞外物质,将其降解而产生肽,并把这些肽作为抗原呈现出来。这些呈现抗原的细胞从侵染点游动到淋巴节,在那里发动淋巴细胞去做出免疫应答;实际上,呈现抗原的细胞就像来自战争前线的信使。辅助性T淋巴细胞在识别出这些呈现抗原的细胞上的肽-MHC复合体后,就分泌类似激素的分子(淋巴激活素),以促进免疫系统细胞的分化。
因此,识别细胞表面上的肽-MHC复合体是启动所有免疫应答,特别是有效地消灭胞内寄生物的关键。在过去的20年间,世界各地的免疫学家们曾力图去发现MHC分子和各种类型的肽之间的复合体是怎样形成的。这些研究曾引导我们去了解MHC分子的结构怎样使这些分子得以结合有机体遭遇到的形形色色传染因子所产生的许多不同的肽。
MHC分子是由研究组织移植的科研人员最早鉴别的。在本世纪三十年代,设在巴港的杰克逊实验室的George D. Snell和英国米德尔斯伯勒的利斯特预防医学研究所的Peter A. Gorer叙述了小鼠染色体17上的一个遗传位点。这个位点是小鼠的一个品系向另一个品系移植组织是被接受还是被排斥的主要决定因子。他们把此位点命名为H-2(H代表“组织相容性”,此术语意即“组织接收”)。在本世纪50年代,巴黎大学的Jean Dausset和其他研究人员确定了人的相似遗传位点。
在许多实验室听做的进一步研究表明,H-2含有许多移植抗原基因(蛋白质表达于细胞表面并能由免疫系统识别)。“主要组织相容性复合体”这一名称反映出这种密切连锁在移植排斥和移植接受中的重要性。从组织学角度来说,人的这些分子类型常常被叫做人白细胞抗原(HLAs),而MHC现在是被作为一般标记来采纳的。
结构研究表明,由MHC编码的移植抗原有两种基本型,取名为MHCⅠ和MHCⅡ分子。
每种类型的MHC分子是极为不同的。小鼠和人类含有的这类分子超过100种形式,尽管个体通常表达的只是在每个类型的3-6种形式之间。
MHC分子的生理功能只是在60年代末期才变得明朗起来。纽约大学的Baruj Benacerraf和先后在以色列和哈佛大学工作的Hugh O. McDevitt各自进行的研究发现,豚鼠和小鼠的一些个体可以制造抗体来抗御一些简单的蛋白质抗原,而另一些则不可能。McDevitt使用许多小鼠的近交系证明,“应答性”(responsiveness)和“非应答性”是遗传上决定的性状,这些性状取决于由小鼠表达的MHCⅡ型分子的特定类型。
1974年,设在坎培拉的约翰·柯廷医学研究院的Rolf Zinkernagel和Peter Doherty有相似的发现:只要小鼠的某些近交系的大脑内部受淋巴脉络丛脑膜炎病毒感染后就死亡,而另一些小鼠近交系则存活了下来。在对病毒的应答中,这种意外的感染导致产生细胞毒性T淋巴细胞以攻击受感染的神经系统。出乎意料的是,T淋巴细胞通常保护机体免遭伤害,但在本病例中它们却参与了致命的自身免疫反应。正如这些研究人员所指出的那样,产生这些T淋巴细胞的能力与小鼠的一组特定的MHCⅠ型分子的表达有关系。
Zinkernagel和Doherty的研究取得了关键性的进展。因为他们证明了从一只小鼠身上分离到的T淋巴细胞可以识别取自第二只小鼠的受病毒感染的细胞——但只是在两只小鼠都表达相同的MHCI型分子时才如此。简言之,只有当合适的抗原和合适的MHC分子都存在时才可能发生免疫应答。这种对外来抗原和相应的MHC分子之双重要求被称为抗原的MHC限制性。
一些研究小组,最值得提及的是国立卫生研究所的Alan S. Rosenthal和哈佛大学的Darid H. Katy领导的研究小组证实,MHC-限制性抗原识别还可解释McDevitt发现的免疫应答性。B细胞不产生抗御McDevitt的简单蛋白质抗原的抗体,除非它们受到辅助T淋巴细胞的刺激。这些T淋巴细胞只识别已经接触过McDevitt简单蛋白质抗原,并提供适当的MHCII型分子的呈现抗原的细胞。
在此之后的10年里,许多研究小组都在力图弄清T细胞是怎样识别抗原和MHC分子的。起初在哈佛大学、后来在华盛顿大学的Emil R. Unanue实验室,国立免疫学和呼吸系统疾病Jewish中心(设在丹佛市)的Howard M. Grey实验室曾分别进行的研究都取得了创造性的突破。他们发现,为了刺激免疫免疫应答,胞外蛋白必须首先被摄入吞食并由呈现抗原的细胞分解成肽,然后这些肽结合到MHCⅡ型分子上去,并以辅助T细胞能够识别的复合体的形式呈现于细胞表面。这个过程的顺序——吞食抗原,把它们断裂成肽并将其结合到MHC分子去——被叫做抗原处理。
在抗原处理中还包括MHCI型分子。根据英国牛津John Radcliffe医院的Alain R. M. Town-send的体会,胞毒T淋巴细胞通过寻找由MHCI型分子呈现的病毒肽的方法来鉴别受病毒感染的细胞。在华盛顿大学的Thomas J. Braciale实验室以及斯克里普斯研究所Michael J. Bevan所做的进一步的研究确认,由MHCI型分子自然地呈现的全部肽都来自细胞质中的蛋白质。
所有这些研究结果和其他的研究结果都表明,有两种类型的MHC分子抽样检查在不同的胞内区域里处理过的抗原。与MHCⅠ型分子结合的肽一定来源于细胞自身的蛋白质。与MHCII型结合的肽的蛋白质源有时是在细胞生长的基质里。可是,这些肽更经常的是来自位于外膜上的蛋白质。
这些发现的重要意义在于细胞上的大多数MHC分子所呈现的肽系来自正常的细胞蛋白质而不是来自病原体的蛋白质。甚至在细胞吞食了外来抗原或被感染之时,呈现那些外来肽的MHC分子的数目也只是总数的一小部分。
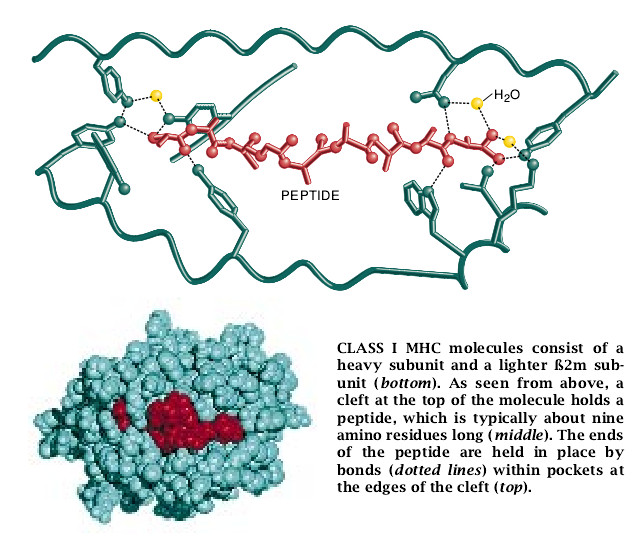
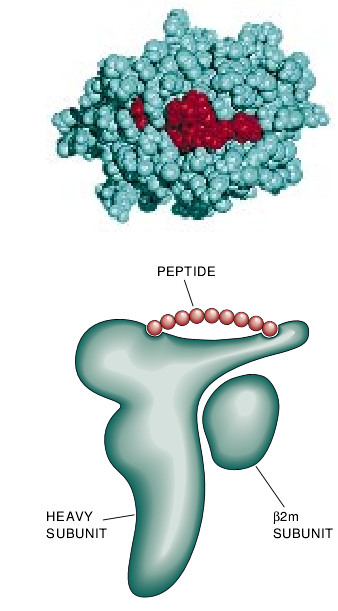
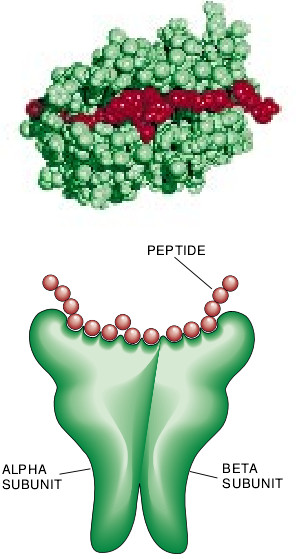
MHC分子结合特定肽的能力和参与抗原处理的能力是由MHC分子的结构和合成决定的。两种类型的MHC分子是由两种蛋白质亚单元组成的。MHCⅠ型分子各自由一个蛋白质重链和一个小得多的叫做β2m的轻链所组成。在MHCⅡ型分子中,这两个链的大小大致相同,但都要小于MHCⅠ型的重链。
虽然有这些差异,但由哈佛大学的Don C. Wiley和他的合作者所做的X晶体学的分析显示出MHCI型分子和MHCII型分子都有明显相似的结构。两种类型的MHC分子都以在其上部表面结合肽的地方有一深深的裂口为特征。裂口本身的结构是复杂的且含有一些能够与肽的不同部分相互作用的凹部。这些凹部在形状和特性上的差异使各种形式的MHC分子各对一定的肽有选择性亲和力。
许多分子免疫学家和蛋白质化学家仍在试图更准确地弄清是什么因素决定了这些亲和力。晶体学的研究已经给出了一些关于肽和MHC分子之间结合的线索。免疫学家们采取另一种方法也在探索所有结合到一种形式的MHC分子上去的肽的共同特征。尽管肽的结构的复杂性使这项研究遇到了困难。
串级质谱分析法的使用已使这项工作取得了很大的进展。在此方法中,在酸中从MHC分子内提取肽,纯化,然后通过质谱仪。此质谱仪能用于测定组成每种肽的氨基酸顺序。我的实验室的Robert A. Henderson,Eric Huczko和Ye Chen以及弗吉尼亚大学Donald F. Hunt实验室的Andrea Cox、Hanspeter Michel、Wanda Bodanar、Terry Davis和Jeffrey Shabanowitz是质谱分析法的具体操作人员。他们已经使用此项技术分析与一些人的MHCⅠ型分子有关的肽的结构。这些研究已经证实,MHC分子能够结合异常不同的肽群。人的细胞含有50万-100万之间的单一形式的MHCⅠ型分子;我们估计这些分子呈现有10000种以上的各种肽,此数目也许可达10万之多。
我们和其他研究人员已发现,与特定的MHCⅠ型有关的大多数肽共享有一些简单的结构特点以支持结合。结合到MHCⅠ型分子上去的肽通常有8个或9个氨基酸残基的长度。此种长度看来是适合于让肽的两个末端——氨基末端和羧基末端——吻合MHC结合凹部的对应末端处的裂口上。
肽内有些位置上的氨基酸还是被高度地保存了下来。例如,结合到叫做HLA-A2.1的人的MHCⅠ型分子上的大多数肽在其氨基末端的第2号位置上含有亮氨酸;在肽分子的羧基末端,最后一个氨基酸总是无电荷和疏水的。反过来说,结合于人的MHCⅠ型分子HLA-B27上的肽在第二号位置含有精氨酸。且其带有一个残基的末端是含正电荷和亲水的。
这样的信息以及其它结构的数据已描绘出一幅肽是怎样结合到的MHCⅠ型分子上去的精美示意图。肽的两个末端和2或3个附加的氨基酸残基装配到连接有凹部的MHC中适当分开的裂口内。这些连接提供了分子之间的大部分键合能。剩余的肽链伸出凹部的表面上,且不受与MHC分子相互作用的强烈约束,这后一种情况意味着能够容纳形形色色的肽的结构。由含有各种结构特点的病原体蛋白质产生的许多肽会让它们在适当的环境下结合到MHC分子上。实际上,研究人员应用这种有特色的信息己在少数病例中能够预测在可能出现感染的细胞上的肽-MHC分子。
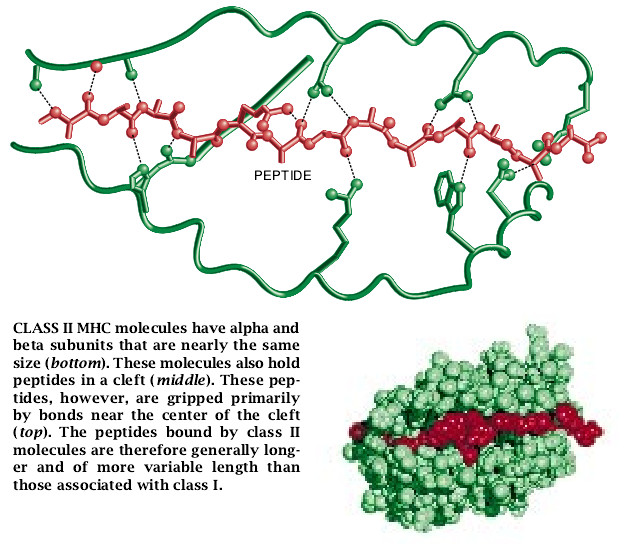
MHCII型分子的肽的结合位置是与MHCI型分子的相似的,但差异也是明显的。最重要的是,MHCII型分子连接的凹部缺乏供特异性地卡住肽末端的裂口。而大多数的结合发生于凹部的中间部位,因此,这种结合的肽比较靠近中部。结果,与MHCII型分子相结合的肽在长度方面表现出较大的变异,而且平均长度比与MHCI型分子有关联的肽明显地要长与任意给定的MHCII型分子的形式相结合的许多肽构成嵌套群:即它们共享一个核心的氨基酸顺序(MHC凹部内结合的氨基酸顺序),而只是在它们的氨基末端和羧基末端的长度方面有所不同。
MHCII型连接的凹部含有比MHCI型分子凹部更多的配置于中心的裂口,但关于它们在限制一个肽必须具有的氨基酸特点方面的重要性迄今仍知之甚少。其结果是,时至今日我们才开始确定可能准确地预测哪些将结合到MHCII型分子上去的结构特点。
与肽的结合作用是MHCⅠ型分子和MHCII型分子生物台成和装配之正常步骤。但正是由于每种MHC型分子肽源有所下同,所以它们装配的机制也有所差异。
构成MHCI型分子的重链和B2m轻链亚单位合成后,它们在被叫做内质网的膜细胞器内粘连在一起。如果B2m不存在,重链就不能够折叠成适当的构型。因此,它也不可能移动到像高尔基体这样的其它细胞器去,而是返回到细胞表面上它们的最终目的地。根据最新研究成果现己弄清楚,当重链-B2m复合体在内质网内进行这种旅行时还必须结合肽。
设在斯德哥尔摩的Karolinska研究所的Townsend和Klaus Karre最精巧地证实了此种观点。他们鉴定了一些突变细胞,这些突变细胞虽然足以正常数量合成的重链和B2m轻链但在其表面只含有MHCI型的标准数目的百分之五。这些链原来是非折叠的且封闭于内质网内。Townsend和Karre把适当的肽加入这些突变细胞之后,这些链就可正确折叠,而这些突变细胞也表达出数量比较正常的MHCI型分子。因此,肽稳定了重链和轻链之间的相互作用,以许多方式起着MHCI型分子第三种亚单位的作用。
鉴定出像Townsend和Karre所研究的,肽未能与MHCI型分子相结合的突变细胞后,刺激了一些实验室去研究这种效应。1990年末,四个研究小组同时鉴定了编码运输蛋白质的MHC中的两个基因。这些蛋质是一大族相似分子的成员。这些分子能帮助运输小分子穿过不同生物体的细胞膜。研究人员假设这种新的结合了蛋白质的MHC载着肽从细胞进入内质网。他们把由这些基因制造的分子适当地取名为TAP(与抗原处理有关联的运输体)。
跟踪研究已揭示,未能实现此类抗原处理的所有已知的突变细胞系都是这些TAF基因中的这一个或那一个基因有缺损。其它各种实验也都支持了这一假设,其中包括直接的证据。含有TAP的膜囊催化了小肽的运输。
由TAP运输的肽是怎样制造的呢?确切的回答仍然还不知道,但是对于叫做蛋白酶体(proteasome)的含酶复合体的参与,可以算作一个非常偶然的判断。在许多细胞小区内发现的蛋白体是圆柱结构。它们是几种不同的蛋白酶域蛋白分解酶的混合体,而且它们显然是细胞降解蛋白质的主要机制,此种机制或是延长了它们的有用性,或者是伤害乃至不正确地折叠。
弗吉尼亚医学院的John Monace已进行了一些最吸引人的蛋白酶体的研究。他证实,有时在蛋白酶体中发现有两个亚单位,它们是由直接靠近TAP的MHC中的基因编码的。通常,细胞内大约只有10%的蛋白酶体含有这些亚单位。可是如果细胞一旦接触γ-干扰素,那么在免疫应答期间淋巴激活素就会释放,细胞表达的这些亚单位就增加,它们就会与更多的蛋白酶体结合。(这样,细胞表达的MHC分子和TAP也都增加。)
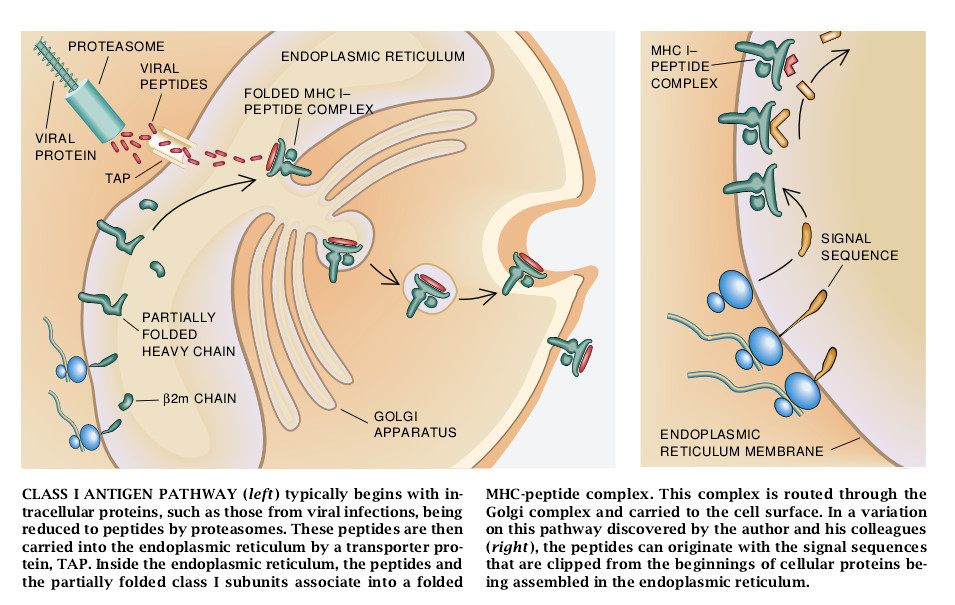
哈佛大学的Kenneth L. Rock和Alfred L. Goldberg最近曾指出,蛋白酶体内含有这些亚单位使之在碱基末端或疏水基氨基酸生成肽——能够正确地结合到大多数MHCⅠ型分子上去那些类型。两种亚单位是否还可改变形成的肽的长度以适合于MHCI型分子的大小,此种情况还不知道。人们可以想象在细胞质内制造的蛋白质被蛋白酶体降解并由TAP运进内质网,在这里它们就能结合到MHCI型分子上去。
然而,有种奇怪的发现是,许多缺乏一种或两种TAP成分的突变细胞仍然在其表面极高水平的表达了MHCⅠ型分子的一些形式。在我的实验室的Henderson和弗吉尼亚大学Hunt实验室的Michel都考察了此种情况的原因。他们发现肽在这些细胞上与所有的MHCⅠ型分子相结合看来是由细胞蛋白质的信号顺序决定的。在正伸出细胞表面或在其他细胞内部区域刚合成的蛋白质的氨基末端处发现的共同特征是信号顺序。当这些叫做核蛋白体的细胞器合成这类蛋白质时,这些顺序保证在蛋白质合成完成之前核蛋白体会附着到内质网上。实际上,信号顺序有助于直接将新的蛋白质向它们的最终目的地降解。
由于蛋白质已挤入内质网,酶从其前端剪断信号顺序。信号顺序一旦以上述方式释出内质网就可能为与MHCⅠ型分子结合的现成的肽源,藉以阻止突变处理细胞中抗原的失败。研究人员已弄清由T淋巴细胞识别的至少有两种肽是信号顺序产生的,这表明此种改变抗原处理的途径可能是十分重要的。
将MHCI型分子和MHCII型分子在内质网内装配,令人惊奇的是它们不去结合相同的肽。部分原因可能是由TAP运进内质网的肽没有会使它们能够稳定地结合到MHCII型分子上去的结构特征。
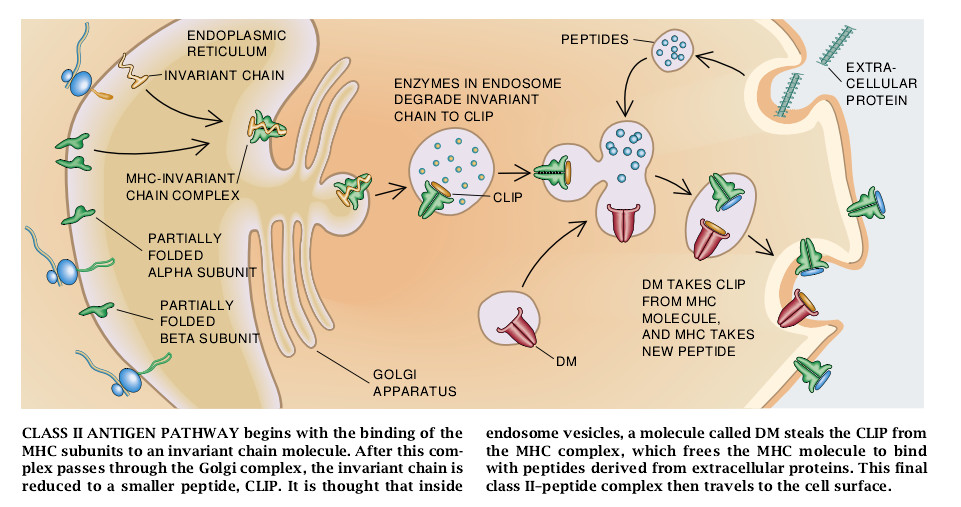
可是,也许比较中肯的原因是MHCII型单位合成后立即与叫做无变度链(invariant chain)或Ii的第三种分子结合。无变度链或通过直接的干扰与肽的结合或把MHCII型分子保特于特定的非折叠状态的方法来阻止肽与MHCII型分子的结合。无变度链还使MHCⅡ型分子沿着通向MHCI型分子细胞表面的路径改道,而大多数其他的表面膜蛋白则不仿效:通过高尔基器并进入核内体。
核内体是由细胞表面膜内折形成的膜囊。因此它们往往含有表面蛋白及其结合的配位体(它们结合的分子)。由于核内体通过细胞,它们的内部变酸并累积可降解许多囊状表面蛋白和配位体的蛋白酶。最后,核内体再循环到表面膜与膜融合并将基内含物返回到表面。
迪克大学的Peter Cresswell发现,当MHCII-Ii复合体移进内核体时,泡囊即向表面移动达6小时停止不来。在此期间,核内体的蛋白酶吞食无变度链,以此解除泡囊内MHCII型分子对其它肽的结合。这些肽中的许多当然都是由胞外源产生的。最后,MHCII型-肽复合体外移到细胞表面。
关于MHCII型-肽复合体形成的另一个重要的观点是通过考察由华盛顿大学的Betsy Mullins和Donald A. Pious创建的一些突变细胞而弄清楚的。MHCII型分子在细胞表面呈单个地下垂、易于变性的形式。这些分子的外观和习性类似于内质网中刚合成的MHCⅡ型分子。因此,人们自然地可以想象到这些下垂的表面分子还缺乏固定化的肽。不过直接从突变体中分离的分子表明,情况并非如此:下垂的分子被结合到由无变度链的一小区产生的一组肽上去。这些肽叫做CLIPs(MHCⅡ型结合的无变度链肽)。
这些细胞内的突变看来是干扰了MHCII型分子去结合任何一种肽的能力,而不是结合无变度链肽的能力。Mullins和Pious最近在各自的实验中证实,这些细胞中的缺损能影响一种新鉴定出的叫做DM的分子,这种分子在结构与普通的MHCII型分子有关,但亦有所区别。在他们研究成果出来之前,DM的功能是完全不知道的。
对MHCⅡ型分子来说,CLIPs和DM在正常的处理路径中的确切作用仍然还不清楚。一种有吸引力的假设是,作为无变度链的一部分的CLIP实际上拥有结合于MHCⅡ型分子上凹部的肽,或者它至少可改变MHCII型分子的结构以阻止其与其它肽的结合。无变度链在核内体中被降解后,CLIP仍然保持着与MHCII型分子的结合,直至它被DM主动地清除为止。
根据我们已有的经验,抗原处理机制是用细胞制造和摄取的过量的蛋白质产生有代表性的肽的样品。这些肽MHCⅡ分子上的显示反过来又使免疫系统得以去鉴别和破坏窝藏感染因子的细胞或其他异常的细胞。
MHC分子必须能够呈现许多外来的肽,而要这样做,其方法是使这些复合体的外观不同于与相似的宿主肽形成的复合体。此种要求也许可以解释各个体为什么可表达若干形式的MHCI和MHCII型分子以及人群为什么包含有几百种形式。这些形式中的一些显然比另一些更易去结合来自特定病原体的肽。
有意义的MHC变型的真实样品正开始在文献中出现。几年前,牛津大学的Adrian Hill和他的同事在人类身上发现了一些证据。对疟疾的感病性随某些MHCI型分子的表达而有所变化。看来赋予最大抗性的MHCI型分子的这些形式在疟疾流行区域内由自然选择法则支配而存活下来的人们中是特别普遍的。
可是,正如人们可以预料的那样,少数病原体已学会抗击按常规能挫败它们的抗原处理系统。例如,有几种病毒在其感染期其能够抑制MHC分子的表达。很多种腺病毒能制造可结合在内质网中刚合成的MHCI型分子的分子,并阻止MHCI型分子在细胞表面上表达。其它腺病毒则制造出干扰MHCI型基因表达的分子。细胞肥大病毒和单纯疱疹病毒干扰MHCI型分子的表面表达目前也得到了阐述,仅管它们使用的机制仍然还不清楚。虽然有这些例子,但抗原处理通常使免疫系统能充分地控制外来的感染。
也许还与控制癌症有关。由于许多肿瘤表达突变的蛋白质,所以免疫系统可以寻找由突变蛋白质产生的肽来作为细胞被转化以及在此细胞上产生肿瘤的方式的指示物。在已被鉴定的许多肿瘤中,MHCI型分子表达是减少了。增加MHC表达的实验操作往往使这些肿瘤更多的受到免疫系统的控制。一些最新的证据也揭示,有几个肿瘤细胞类型可以降低其TAP的表达,也许是为了避开T淋巴细胞的识别。
现在正在揭示肿瘤特异性T淋巴细胞能够识别的肽的本质。设在布鲁塞尔的路德维格癌症研究所的Thierry Boon和他的合作者已考查过识别人的黑素瘤细胞的T淋巴细胞之若干细节。他们指出,T细胞的一个目标虽然就是一组来自叫做MADE-1蛋白质的肽,MAGE-1是在各种各样的肿瘤中表达,而在正常组织中几乎测不出它来。国立癌症研究所的Boon、Steven A. Rssenberg以及弗吉尼亚大学的我的同事和我同时都鉴定过来自三种蛋白质的抗原肽,此三种蛋白质来自普通的黑素细胞和黑素瘤肿瘤细胞的表达。
这些结果暗示,抗肿瘤免疫性的有效性可能部分地受肿瘤细胞内异常的靶肽的可利用性的限制。增大抗肿瘤免疫性的一种方法肯定会包括进一步的鉴定T细胞能够识别的肿瘤细胞的MHCⅠ型-肽复合体,以及发展增加它们的免疫原性的战略。
不同寻常是,有一些例子表明抗原处理系统的作用竟有害于机体的健康。过去10年间,研究人员已得到了令人深思的发现:某些MHCII型分子的表达与诸如青少年期发作的糖尿病和类风湿关节炎等许多自身免疫疾病有关;在这些自身免疫疾病中,免疫系统悲剧性地攻击宿主的组织。这些MHC分子也许呈现的是来自宿主的肽并参与这类免疫攻击。免疫系统通常具有能够防止可能由它们引发的这类现象或阻止其破坏性应答的机制。在上述病例中这些机制为什么出故障,至今仍然是个迷。
来自宿主和外来病源的肽的呈现怎样与这些必要条件发展相关联是目前免疫学家们面临的最富吸引力的一些难题。随着详情变得越来越明朗,免疫学家们最终也许能够设计出可以有选择性的操纵抗原处理的治疗方法。有朝一日我们也许能够阻止那些加剧自身免疫疾病的抗原的呈现,或者增强对那些会显示感染或肿瘤的抗原的处理。可是目前身边的这些难题就足以使免疫学家忙个马不停蹄了。
【赵裕卿/译 颂平/校】
请 登录 发表评论