防治莱姆病
Fred S. Kantor

抗生素通常对此病有疗效,正在临床试验一种疫苗。研究计划的下一项是,怎样帮助慢性症状患者。
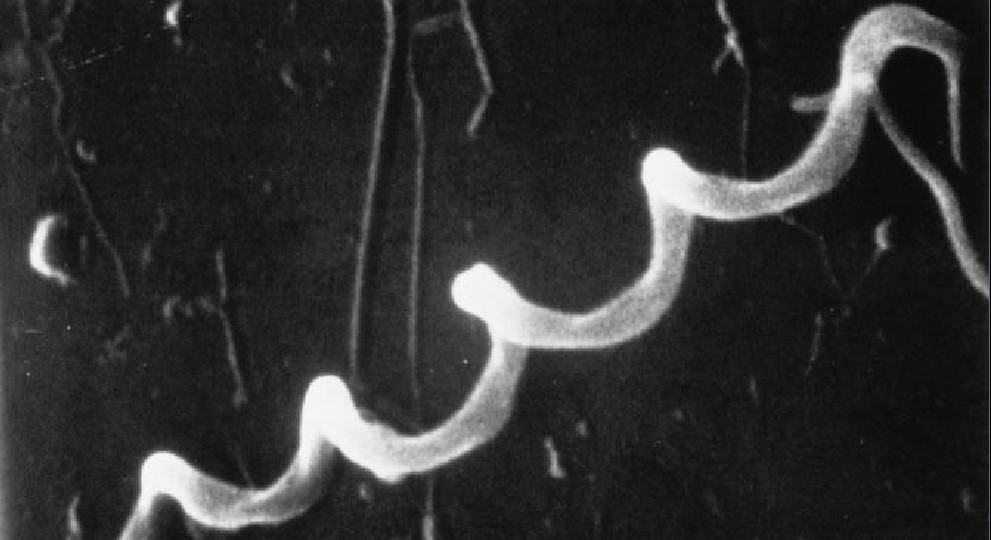
研究人员大约是在20年前首次认识莱姆病(Lyme disease)的。他们在较短时间内找到了病因(一种由蜱携带的微生物),证明用抗生素可以治愈大部分患者,并描述了未经治疗的莱姆病的典型病程。最近,这项研究又取得了另一个令人鼓舞的转机:开发出了一种疫苗,现在正在许多患者身上试验这种疫苗。与此同时,面前又出现了一个难题:为什么这种自限性的疾病会变成慢性的,而且有时会使某些患者衰弱不堪?现在,研究工作已进入了一个新的阶段,看来正是做好下列几项工作的好时机:总结头20年研究过程中了解到的各种情况,阐明疫苗是怎样开发出来的,着重介绍关于转向慢性病过程的几种最新的见解。
莱姆病最初是在康涅狄格州的莱姆被发现的。1957年,有两位母亲申述她们的孩子得了青少年类风湿性关节炎。这种可导致劳动能力丧失的疾病表现为关节肿胀和疼痛。这两名妇女很快了解到,并非只是她们的孩子得了这种病,该地区另外还有许多儿童和成年人被诊断出了类风湿性关节炎。这种病通常不是群发性的。因此,这两位母亲为了弄清此病突然蔓延的原因,就请教了耶鲁大学的研究人员。
到70年代末,耶鲁大学的Allen L. Steere和Stephen E. Malawista发现,他们调查的患者中有许多人得了一种奇怪的、可能产生不同症状的病,这些症状中包括有但并不限于关节肿胀,其病因显然是至少由一种蜱即肩突硬蜱(Ixodes scapularis,后又被命名为I. dammini)传播的某种微生物。这种蜱普遍生长在莱姆及其周围地区的草地和森林里。1982年,美国公共卫生局的Willy Burgdorfer鉴定出这种微生物是一种螺旋形细菌种,现在的名称是巴格多费利疏螺旋体。
研究人员在掌握了这种致病因子之后不久,就肯定了一种愈益强烈的猜测,即欧洲常见的某些皮肤病和神经症状实际上就是莱姆病的表现。从那时起,研究人员在世界的许多地区(包括澳洲、非洲和亚洲)都鉴定出了莱姆病。在美国,几乎每个州部有此病,但是最流行的地区是在东北部,在明尼苏达州和在北加利福尼亚(在那里捣乱的蜱是太平洋硬蜱即I. pacificus)。据报导,去年美国全国估计有8000例。
莱姆病会使人丧失劳动能力这一特点自然引起了人们的担心和警惕。但是在我看来,新闻媒介作了过分的报导,而公众也过分惊恐了。在大多数情况下,莱姆病是容易治疗的,而旦不会发展到慢性期。的确,莱姆病在不到10%未经治疗的患者中可能发展成严重的长期性症状。最新的研究证明,许多自认为得了慢性莱姆病的人实际上患的是其他病症。
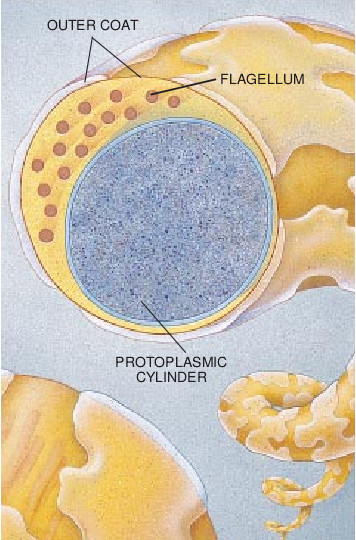
有人得莱姆病是因为感染了B. burgdorferi的蜱贴到了他的皮肤上。当这只蜱开始吸食这个人的血时,藏在它中肠里的B. burgdorferi就开始繁殖。这些螺旋体进入蜱的循环系统,转移到唾液腺,进而随同唾液进入宿主的皮肤。对于可能因此而受害的人来说,值得庆幸的是一只蜱必须贴在人体上达36-48小时之久才能够有可引起感染的足量的B. burgdorferi进入人体。这一事实为生活在莱姆病已成为地方病的那些地区里的人带来了方便,我们只要每天勤于检查自己的身体,就可以筑起强大的第一道防线。
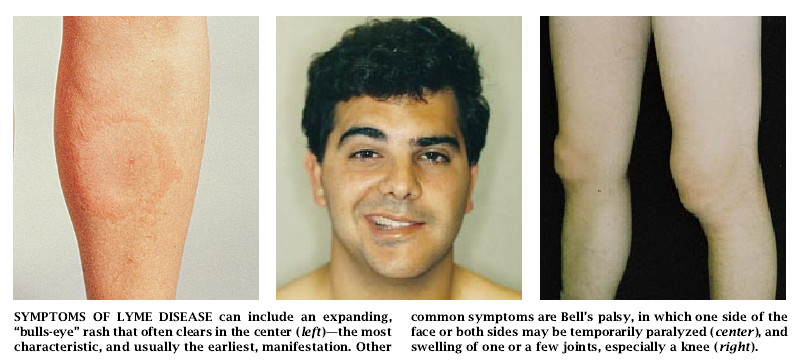
大多数受到感染的人最终都将出现一种或多种症状。也许有60%的患者会早一些注意到圆形的皮疹即慢性红色皮疹(ECM)。这些人在螺旋体进入皮肤后的一个月差三天即可在蜱咬部或其附近看到红点。这个变红的部位或发痒或刺痛,变得愈来愈大,也许会扩大到直径几英寸那么大。这个红斑在扩大时,其中心通常是明亮的,因此像一个靶子。另外一些患者可能得了这种“靶子”即“牛眼”形的红斑,但没有被发现,特别当被咬部位是在背部或在大腿上部和臀部之间的褶痕处吋。如果不进行抗生素治疗,那么这种红斑会在几星期内消失,但有吋也会在几天内退去。

蜱把B. burgdorferi引入机体皮肤内几天或几个星期后可能会出现侵害机体不同部位的另外各种早期症状。这些症状都是因螺旋体通过血流传播到许多组织里后引起的。经常发生类似感冒的症状,如寒战、发烧,疲劳感,关节和肌肉疼痛,食欲不振等。
大约有20%未经治疗的患者还会出现早期的神经方面的问题。这类症状之一是贝尔麻痹(面神经麻痹),面部一侧或两侧会麻痹数星期或数月之久才能完全恢复。另一些早期的神经性症状可能包括脑膜炎(预兆是头痛、颈部僵直和对光敏感)、脑炎(可能引起嗜睡、丧失记忆和情绪多变)和神经根炎(从脊髄伸向机体外周神经的根部被刺激,因此由这些神经控制的区域就感到疼痛甚至可能感到麻刺或麻木)。
在最初几个星期可能受到损害的另一个器官是心脏。大约在5-10%未经治疗的受感染者中出现的最常见的心脏问题是心室阻滞,即心律失调。大多数患者在医生作出诊断之前都意识不到这种失调现象,尽管有些患者会注意到他们的运动能力下降了。幸运的是,这种症状只持续一个星期到10天,而且几乎不需要在体内植入起搏器。
初期症状还可能包括轻度的肌肉骨骼障碍。患者可能会感到肌肉、腱或关节内时隐时现的游走性疼痛(但不肿胀)。许多患者发觉颞下颌关节受影响。这些症状通常经几个星期或几个月后会自行减退。尽管如此,在没有接受抗生素治疗的患者中有一半人在感染发作后有6个月左右的时间会在一处或几处关节,特别是膝关节中出现症状明显的关节炎(表现为关节肿胀和不适达数星期之久)。
在美国,因莱姆病而得了短暂性关节炎而又未经治疗的患者中,估计有10%会得慢性莱姆病关节炎。得了慢性关节炎的患者也许发现其关节不时会一而再、再而三地肿胀几个月,或者某些关节在长达一年多的时间里一直肿大并有疼痛感。关节炎的许多类型(包括类风湿性关节炎)的症状都是机体两侧相对的关节都受损,而莱姆病的关节炎则与此相反,通常是不对称的。
在欧洲,慢性关节炎极为罕见,但是长期性神经并发症,如缺少识别能力和痴呆却在许多患者的病例中都有记载。此外,有多达10%的未经治疗的欧洲患者在长达数年或数十年之久地遭受一种叫做纸皮炎慢性萎缩症的折磨。得了这种病的患者,其皮肤的受害部位发红,而且变得又薄又皱,像香烟纸一样。在美国,这类症状极为少见。某些症状的出现率多变可能是因为活跃在世界不同地区的B. burgdorferi的菌系不同。
可悲的是,在发病后期才诊断出的莱姆病病例往往都对抗生素治疗呈现出抗性。医生们有时对慢性莱姆病的患者一次又一次地进行长疗程的抗生素治疗。但是,这种可能产生严重副作用(如诱发形成胆石)的治疗方法的效果尚未证实。
有时会出现一系列附加症状。下列情况就足以说明这一点,即尽管皮肤、心脏、关节和神经系统是B. burgdorferi特定攻击的靶子,但是实际上任何一个器官系统都可能因分布在机体内的B. burgdorferi而得病。
导致B. burgdorferi感染症状的确切的分子活动还有待阐明。有些迹象表明这些分子活动是由机体自身对群集在靶部位的细菌作出的发炎反应。在发炎反应过程中,免疫系统的分子和细胞(如抗体分子和巨噬细胞)集中在受到感染的组织里并试图消灭一切入侵者。这种发炎过程可导致肿胀、变红,有时还会因此而发生全身症状,如发绕。
不管引发莱姆病的原因是什么,避免严重后果的关键是迅速诊断和治疗这种潜在的疾病。不幸的是,初发阶段的莱姆病很难确诊,特别是其特有的红斑不明显时。之所以有这些问题是因为其他各种症状(如类似感冒的主要症状)可能是由其他许多因素引起的。此外,诊断莱姆病用的验血方法能够检测到的抗体,在大多数情况下都要在感染发作后几个星期或几个月才会出现在血流里。由于有这个特点,所以在早期诊断时验血是不可靠的。
研究人员们正在开发其它的检验方法,与此同时,许多主管部门都建议不要只治疗蜱咬。医生们必须靠他们自己的判断来决定莱姆病是否就是病人主诉的并发症的可能起因。
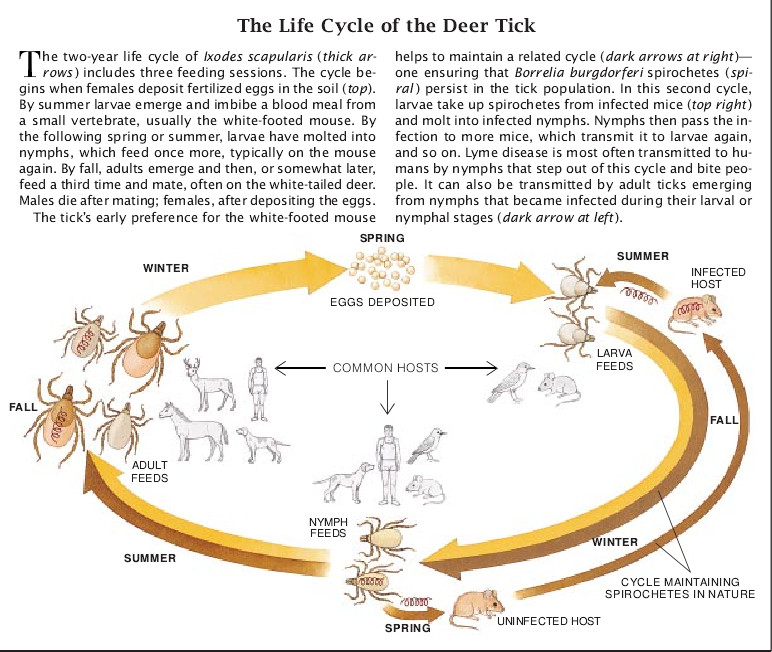
大多数患者都在春季、夏季和秋季出现症状。现在知道这一模式反映了硬蜱生活史的特点。这一生活史包括在其发育的三个阶段的每个阶段中吃一次血(在几天内)。硬蜱在每个发育阶段都有其喜爱的宿主,但是在每个阶段都可能有多种动物(包括人)被选中。就拿在美国的莱姆病的最大祸首肩突硬蜱来说,它在春季产下卵,于夏季变成幼虫。这种幼虫随即粘附到某种小的脊椎动物(通常是白足鼠Peromyscus leucopus)身上,吸食第一次血。如果此时宿主已经感染了B. burgdorferi螺旋体,那么吸它血的硬蜱幼虫也会感染这种螺旋体。
有时候,幼虫吸血后蜕化成若虫。在下一年的春季和夏季(五月中到七月),若虫进行第二次吸血,如果幼虫是受到感染的,那么若虫也将是被感染的,因此能把感染传播给它的宿主。使大多数人受感染的罪魁祸首就是这种在吸血前像罂粟籽那么大的若虫。但是这种若虫还是喜欢白足鼠或其他小型脊椎动物作为它们血食的来源。
到十月份,若虫蜕化成苹果籽那么大的成虫。那时(或者有时是在冬季或春季)成虫就吸血并交配而产下受精卵,重新开始新的生活史。肩突硬蜱的成虫通常在白尾鹿(Odocoileus virginianus)身上完成这些活动,所以人们常把肩突硬蜱叫做鹿蜱。白尾鹿本身不滋养B. burgdorferi群落,但确实会把蜱带到人生活和游玩的地方。
在美国东北部,15-30%的肩突硬蜱及该种属50%左右的成虫都是被感染的。成虫比若虫更可能具有感染性,因为它们有更多的机会去吸某个受感染宿主的血——一次在幼虫期,另一次在若虫期。在有些地方(像Block岛和Nantucket岛),这个数字还要大。即使如此,在东北部的大部分地区里,被肩突硬蜱叮咬过的人中估计只有1-3%得莱姆病。
在加利福尼亚传播莱姆病的蜱都在能完全抵制B. burgdorferi感染的壁虎或其他一些动物身上吸第一次和第二次血。因此蜱(因此也包括对人)的感染率就比美国的东北部要低得多。莱姆病在欧洲和亚洲某些地区的传播情况也是如此。
大约在5年前,我们几个在耶鲁大学搞研究的开始考虑,我们能不能发明一种可以预防人们得莱姆病的疫苗呢?我们这个研究小组的最初几位成员,除了我以外,还有John F. Anderson、Stephen W. Barthold、Erol Fikrig、Richard A. Flavell和Stephen Malawista。在一开始,我们需要证实有可能诱导人的机体去保护自身不受B. burgdorferi的入侵。我们从生活在纽约州Montauk附近、长岛外围的居民的经验中得到了鼓舞。在莱姆病被认定为一个病种之前,这个地区居民经常会突然患一种叫做Montauk膝的病。现在我们知道这就是莱姆病的一种症状。膝盖肿大几个星期后才恢复正常。民间传说,这种病一旦痊愈就永不复发。不再复发就意味着这首次感染可诱导免疫系统去防止新的侵袭。
有些动物试验也表明免疫接种是可能的。特別应该指出的是,明尼苏达大学的Russell C. Johnson把灭活的B. burgdorferi注入仓鼠体内以期诱导其免疫系统有力地去阻止外来的螺旋体。后来他证明仓鼠确实抵制了在此之后注入其体内活的B. burgdorferi螺旋体的感染。
我们的试验工作的第一步是确定螺旋体本身的哪些组分最能诱发防御性免疫反应。我们之所以特别注意到螺旋体外表面上的蛋白质,其部分原因在于表面分子往往最容易接近宿主的免疫系统。
到1989年,德克萨斯大学圣•安东尼奥分校健康服务中心的Alan G. Barbour克隆了编码两种这样的蛋白质,即外表蛋白质A(OspA)和外表蛋白质β(OspB)的基因。我们用OspA基因合成了OspA蛋白质并把这种分子注入小鼠体内。我们感到高兴的是,这些小鼠完全击退了大剂量B. burgdorferi螺旋体的挑战。我们证明,在接触的螺旋体量较少的情况下,Osp也能保护小鼠免受其感染。
后来,我们和John Sears(当时还是耶鲁大学的医学院学生)确定了参与免疫反应的的抗原片段。它驻留在和蛋白质羧基(COOH)末端相连接的那个分子的一半处。这项研究还揭示由OspA和OspB诱发的免疫应答主要是由能识别和结合到这些抗原上去的那些抗体引导的。
尽管在我们早期的研究中证明了OspA疫苗是成功的,但是我们在着手进行人体试验之前还有更多的工作要做。头一件事是要注意到主要是由昆虫学家们表现出的一种担心,即由疫苗诱发的免疫系统可能抵御不了不是用注射器注入的,而是由蜱叮咬传入机体的螺旋体所引起的感染。进一步用蜱进行的试验表明这种担心是多余的——试验给了我们出乎意外的结果。在免疫接种后的动物身上吸血的蜱,其中肠里的螺旋体消失了。很明显,蜱在吸食经免疫接种的小鼠的血时,同时也摄取了抗-OspA抗体和另外一些可消灭螺旋体的免疫物质。
我们立即意识到,如果我们能赋予自然界的小鼠以免疫力,那么我们也就不需要对人进行免疫接种了。清除小鼠的螺旋体就可以迅速减少被感染的动物。这样一来,受感染的蜱就会减少,莱姆病的威胁就可能因此而消失。在这一前景的激励和一些初步研究成果的鼓舞下,我们试图在小鼠的食料中加入少量OspA来对它们进行免疫接种。使我们失望的是,这些小鼠并没得到免疫力。尽管如此,对野外的小鼠进行免疫接种仍然是个有价值的目标。
我们还必须注意到另一些问题。理想的疫苗应能防止B. burgdorferi的任何菌系对人体的侵袭。我们研制的以取自单一菌系的OspA为基础的疫苗也能抵御其他菌系吗?我们在大量的研究工作中对动物进行免疫接种后就让它们去接受从取自全国许多地区的蜱身上分离到的B. burgdorferi的挑战,没有一种菌系能感染接种后的动物。Nantucket岛上的情况也是如此,尽管那里的B. burgdorferi是从OspA的抗原区略有不同的野生蜱身上分离到的。这些研究结果使我们确信,单一的OspA疫苗能保护人们使之免受在美国可能遇到的B. burgdorferi的大多数菌系的感染。但是,这种疫苗在欧洲也许不那么有效,因为那里的菌系更多。
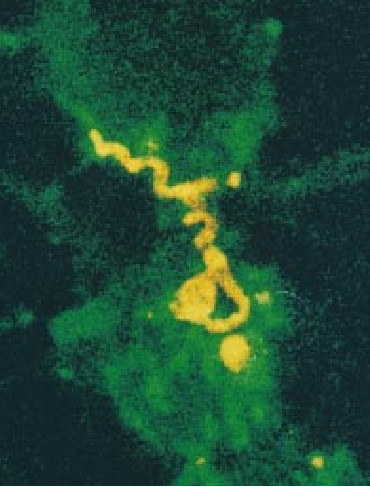
自从完成了上述研究后,在美国又发现了能形成高度突变型的B. burgdorferi的一些突变型。其中有一些可产生OspA异常短的变型或制造出抗原区被通常见于OspB蛋白中的抗原区所替代的杂交蛋白。尽管如此,这类突变在野外根本不常见到。OspA并不是因具有疫苗价值而被研究的唯一一种蛋白质,但是迄今为止它是最有希望作疫苗用的一种蛋白质。在80年代中期,位于蒙塔那州的美国公共卫生局的Tom G. Schwan指出,B. burgdorferi外表上的另一种蛋白质可能被选作疫苗。这种按其分子量而被简称为39千道尔顿蛋白质分子很引人注意,因为在世界各不同地区的B. burgdorferi的菌系中发现了一种基本不变的类型。如果由它诱发的抗体被证明对人有保护作用,那么就可能在世界范围内使用一种疫苗了。但是我们和其他人都未能证明这种分子能诱发防御性免疫力。
还有一种几乎不因菌系不同而有所差别的表面蛋白OspC看来也是令人失望的。早先关于它可能产生防御作用的说法一直没有得到证实。最近,研究人员克隆了编码另外三种表面蛋白(OspD,E和F)的基因。遗憾的是,没有哪一种能在接种后的动物身上诱发强烈的防御反应。
人们在继续努力寻找有用的抗原的同时,一直在进行着OspA疫苗的临床试验,正在评价分别由不同的制药厂生产的两种实质上相同的疫苗。如果一切顺利,那么其中至少有一种到1996年可望在美国上市。生活在欧洲的患者参加了这些研究。他们的经验将使我们考虑这样一个问题,即欧洲是否需要另一种疫苗。
有一段时间,曾经希望能诱发强烈抗体反应的疫苗也能用于早期治疗。但是,动物试验排除了这种可能性。在接触了受感染蜱2-3天后就被注入防护性抗体的动物未能制止B. burgdorferi螺旋体在其体内的繁殖。这种治疗方法和被蜱叮咬后立即处理一样都不成功,其确切原因还有待进一步搞清。
即使用了随时可以得到的疫苗和抗体治疗,仍然还有一小部分人会受到感染,进而发展成慢性症状。为了帮助这些人,研究人员首先必须了解造成慢性症状的一些变化。有一个学派推测晚期病症起因于自体免疫过程。这种观点认B. burgdorferi螺旋体以某种方式诱导免疫系统把宿主自己的蛋白质中的某一种蛋白质当成外来蛋白质。这样一来,防御系统就会开始攻击正常的组织并在螺旋体被消灭后很长一段时间还保持其攻击性,有利于这种自体免疫学说的证据并不充分。尽管如此,强力的抗体(总该能杀死螺旋体吧)未能消除症状这一事实多少使自体免疫说有了些分量。
另一种论据较为充分的学说提出的假设是,慢性症状起因于螺旋体在机体内的长期驻留。换句话说,有一小群螺旋体在躲避掉机体通常有效的免疫防御(还有抗体)后继续在某个角落里繁殖。感染和潜在的有效的免疫反应共存的现象叫做伴发性免疫力。这种现象被认为是许多病(包括某些癌症和寄生虫病)的慢性症状的根本原因。
如果真是伴发性免疫力在起作用,那么人们理应有希望在血液里发现大量抗体(发生免疫应答的信号),同时在机体里可以见到螺旋体(发生感染的信息)。正如预料的那样,我们和其他研究人员从呈现复发症状的患者的循环系统里发现了抗B. burgdorferi的抗体。此外,还从循环系统中有大量抗体的一些患者的皮肤、关节和脊髓中分离到了通常很难从人组织中得到的活的螺旋体。
利用聚合酶链式反应(PCR)间接也证明了在慢性莱姆病中起作用的螺旋体。这种试验方法可以扩增极少量的DNA。试验揭示,在循环系统中有大量抗B. burgdorferi抗体的一些慢性莱姆病患者发炎的关节里有B. burgdorferi的DNA。我认为,也存在完整的B. burgdorferi,因为螺旋体的DNA在携带它的螺旋体死亡后是不可能长时间存在的。不过,仍然可以设想这种DNA仅仅是早已消失的细菌留下的痕迹。为辨明这两种解释而进行的研究将很快解决这个问题。
B. burgdorferi螺旋体怎么能逃避抗体的毁灭性打击呢?对于这种细菌来说,办法之一是改变其自身的表面,使抗体看不到它们。例如,它们可以彻底改变其一个或几个表面抗原的结构。这样的先例在微生物界是很多的;当微生物发现自身处于敌对的抗体环境中时,往往会变换其外壳的组成。但是,正如早已指出过的那样,B. burgdorferi看来并没有倾向于产生这些变化。此外,从已经感染了几个月甚至几年的动物身上找到的螺旋体和刚引起感染(甚至在已经发动强大的免疫防御攻势的动物身上)的螺旋体并无差异。
尽管这样,还有另一些改变其外壳的方法。也许细菌会放出表面抗原,诱使宿主的抗体去攻击游离的抗原而不去攻击病原体本身。此外,细菌还可能用宿主的体液或分子掩盖自己。这样,免疫系统就不去理会它们了。
B. burgdorferi除了伪装其外表外,还可能躲藏在抗体难以到达的地方。细胞内部就是一个明显的避难所,因为细胞膜把病原体和抗体隔开了。有一实验室确实发现B. burgdorferi能存活在噬菌体里。不可思议的是,巨噬细胞恰恰是通常和抗体一起攻击B. burgdorferi的一种细胞。巨噬细胞在攻击过程中摄入并分解与抗体结合在一起的微生物。当存在伴发性免疫力时,有些螺旋体能够设法进入一个特别的可免受攻击的隔间里,躲开巨噬细胞为消灭摄入的“猎物”而部署的那些分子。
没有哪一种重要的策略(不管是改变外壳还是躲起来)能够令人充分满意地说明B. burgdorferi是怎样逃避死亡的。但是,这两种方法再加上另外一些方法可能使细菌得以逃避抗体和抗生素的攻击而生存下来。正在进行的研究最终会揭示螺旋体究竟使用的是哪些方法,从而提出防治它们的办法。
值得注意的是,关于莱姆病的各项研究可能有助于更深入地了解与莱姆病有许多相似之处的梅毒。引发这种性病的微生物是另一种梅毒密螺旋体(Treponemapallidum)。这种螺旋体也能散播到许多不同的组织里,并在某些人身上引发慢性的耐抗生素的疾病。此外,梅毒的许多症状都和莱姆病相似。Treponemapallidum和B. burgdorferi一样,也能够引起皮肤红斑、心脏异常、神经痛和痴呆。但是和B. burgdorferi不一样的是,很难在实验室里培养Treponemapallidum。研究人员在阐明B. burgdorferi引发感染和机体对其产生免疫力这两种现象的分子基础的同时,必将会产生一些关于预防梅毒和缓解其慢性症状的新想法。
综上所述,在1994年,莱姆病的研究重点已经大大不同于70年代和80年代了。莱姆病的起因和预防的可能性已不再是急待解决的问题。当前面临的巨大挑战是找到一种适用于全球各地的疫苗,了解引发慢性症状过程和改进晚期症状的治疗方法,依靠勤奋和幸运也许很快就能解决这些难题。
【颂平/译 赵裕卿/校】
请 登录 发表评论