细胞蠕动的机制
Thomas P. Stossel

细胞蠕动时,有一种部分流体细胞质短暂地变得稳定。这种转变取决于蛋白质支撑材料的有序装配和拆卸。
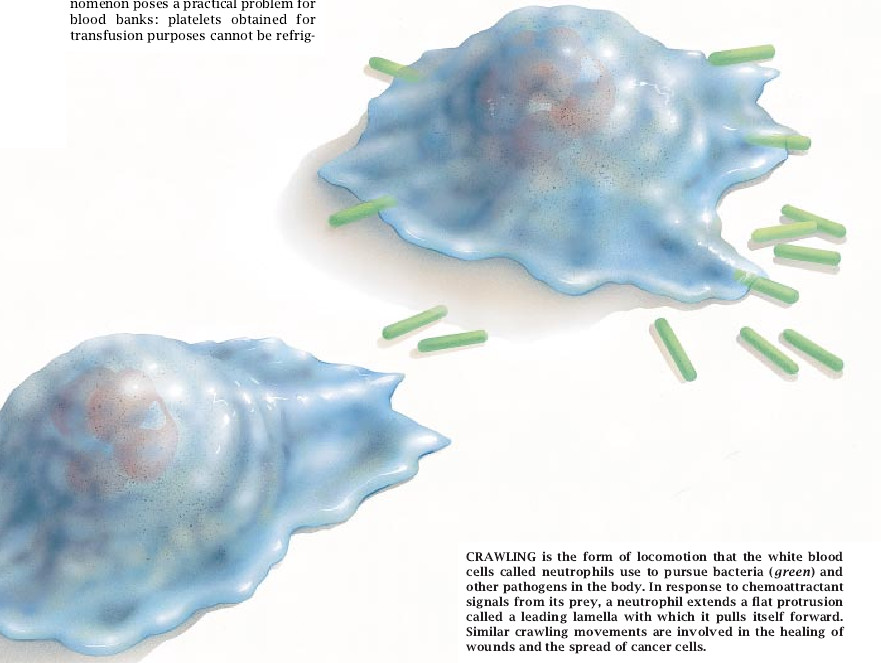
当人们知道自己体内有许多细胞在全身蠕动时,常常会感到惊慌甚至恐慌。然而细胞蠕动是我们生存所必需的。没有它,我们的伤口就不会愈合;血液也不会产生凝块去阻塞伤口;免疫系统也不可能战胜感染。遗憾的是,细胞蠕动也可能对像破坏性炎症和血管中粥样硬化斑的形成这样一些病程起消极作用。癌细胞蠕动可能使之向全身扩散,正是由于癌症失控的细胞生长问题,所以所有肿瘤都要顺从地进行手术切除。
观察细胞蠕动己揭示出关于蠕动机制的令人信服的观点。1786年,丹麦生物学家Otto F. Muller把蠕动的细胞描绘成“伸出一个玻璃状锥的透明凝胶体”。“凝胶状”一词是受拉丁语动词“成凝胶状”(gelare)之启发,意即“冻结”。细胞内这种物理状况变化的概念——正如我们现在把它称作“溶胶-凝胶转换”——对于描绘细胞蠕动的机制和分离这种机制的分子成分来说都是非常有用的。
细胞蠕动甚至还为若干种疾病未来的医疗方法指出了方向。其中显然包括传染病和癌症。由囊性纤维变性可能也要包括在内。
正在愈合的伤口处的细胞和癌症细胞蠕动比较缓慢,每小时的速率0.1到1微米。相反,体内抗御感染和出血的细胞移动非常快。人体为战胜感染每天都要产生1000亿以上的称为中性白细胞的白血细胞。形成于骨髄的中性白细胞,缓慢移动出骨髓,在血流中游弋数小时,然后缓慢移出毛细血管并进入其它组织。这些移动的细胞以每分钟髙达30微米的速率巡视并吞食感染皮肤、气道和肠胃道的微生物。中性白细胞将以此种方式移动几毫米。事实上把体内所有中性白细胞每天主动地移动的距离加起来也许可以环绕地球两圈。
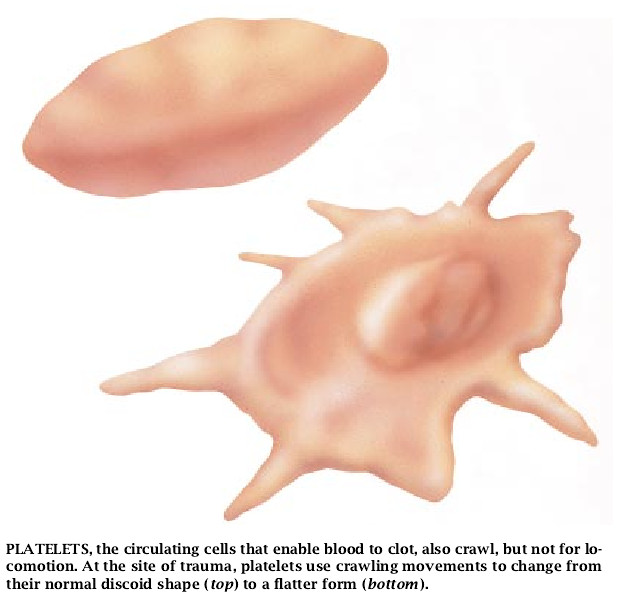
被称为血小板的细胞不能移动,但它们经过迅速蠕动到停止流血的过程中要改变自己的外观。当血小板在血液中循环时,它们是细小的圆盘状物体。可是,在创伤处它们迅速地扩散成类似于多刺的薄饼形状以堵塞受伤血管的渗漏。

正如通过光学显微镜所看到的那样,细胞蠕动包括细胞外层(表层)的膨胀和收缩两个过程。与点缀有各种各样的亚细胞器的细胞深层区域不同,细胞表层则显得光滑而均质。
细胞的蠕动听命于外来的指令。白细胞跟踪化学吸引剂,即由微生物和受伤组织发生的各种各样的分子。刺激细胞分裂的生长因子也能够诱发定向的细胞运动。凝血酶通过血液凝结反应使血小板改变形状。
使细胞开始蠕动的大多数试剂的作用方式都是先和细胞外膜上的特异性受体起反应。接着,与受体的结合作用诱发一系列总括起来称之为信号传递的分子反应,以控制促使细胞蠕动的表层重排。可是,除此之外,如低温之类的其它一些刺激因子显然能够绕过膜受体而仍能引起这些表层的变化。例如,假若血小板受冷,它们的形状就会发生不可逆的变化。这一现象对血库提出一个实际的问题:输血用的血小板不能用冷冻法来减缓它们的变性和最大限度地减少细菌的生长。
细胞在开始蠕动时,它的一部分表层区流动而形成被称为前导片层(leading lamalla)的扁平突出物。显微学家最初把这些片层叙述为“透明的”即“玻璃状的”,原因是它们缺乏细胞器。被叫做“丝状假足”的毛发样突出物供给过量的膜以调节片层的外伸;它们还被用于把突出物推回细胞。片层的底部附着于下表层,主要是通过粘附于膜的蛋白质的作用。这些蛋白质和基质上的分子之间的结合提供了使细胞体将自身向前推进的推动力。接着片层离开基质并再次向前流动。伸出、附着、收缩和脱离等步骤常常是如此的密切合作,使细胞表现出向前滑动,就像环绕于山腰的一朵云霞。
在这些运动的过程中,细胞体的性能就像溶胶一样(随所施应力而流动的液体),可是,当你用显微探针拨弄前导片层或试图将其插入毛细血管中时,你就会发现它抗变形。此结果表明,细胞体还是一种凝胶——一种有弹性的结构,它主要是液体的特性,但也具有一些固体的性质。细胞体变形与所施的应力有关,但它能记住初始的构型,因此当应力去除后,细胞体表现出有弹性的反弹作用。这种弹性变形与所施应力的比率是刚性模量系数。
凝胶还具有重要的离子特性和水力学特性,其中包括阻止溶质流动的能力,很像海绵的贮水能力。细胞表层的弹性和贮水特性来自细胞质内的水溶性聚合物。这些聚合物还可用作施加收缩力的脚手架。
医学研究协会的Dennis C. H. Bray根据关于溶胶-凝胶转换的古老想法已弄清楚了细胞蠕动的机制。他把细胞想象为用凝胶环封闭的溶胶。当细胞受刺激时,凝胶受收缩压力的支配。可是,溶胶没有压缩性,所以在初始刺激或最大刺激时凝胶强度变弱之前不会发生任何情况。然后,流体静压力会在损伤之处使细胞膜形成光滑的突出。这种突出不久就会用新的凝胶物质填充,而成为早期显微学家所看到的玻璃状片层。细胞就以此种方式前进。如果凝胶中的此种损伤出现于片层的基部而不是在顶部,那么突出就缩进细胞体内。
这个模型也可解释所观察到的蠕动细胞的行为,细胞生物学家所面临的挑战是鉴定出表层凝胶的分子结构,并阐明在对刺激的应答中溶胶和凝胶状态之间怎样进行细胞物质的平稳而迅速的转化。
70年代初,当我的同事和我开始研究细胞蠕动的分子机制时,最先想到的分于结构是肌动蛋白和肌球蛋白。从40年代起,人们就已经知道肌动蛋白和肌球蛋白是骨骼肌的主要蛋白质;而在60年代,名古屋大学的Sadashi Hatano和Fumio Oosawa还在变形非肌细胞中发现肌动蛋白和肌球蛋白。其他研究人员证明,组成中性白细胞总蛋白质的10%的肌动蛋白和组成血小板20%的肌动蛋白均集中于细胞表层和前导片层中。
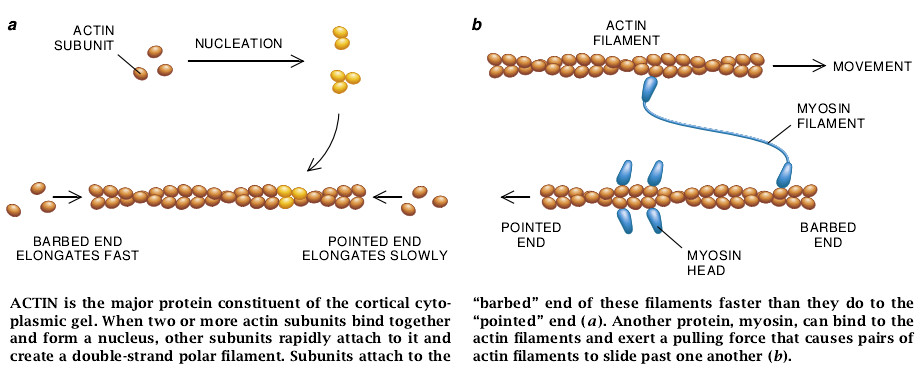
肌动蛋白已被鉴定为能聚合成长的双螺旋丝状体的一种球状蛋白。当时已经知道肌球蛋白分子比较复杂:它们有结合肌动蛋白丝的球状“头”区和自我结合形成二极肌球蛋白丝的螺旋状“尾”区。1963年MRC(医学研究协会)的Hugh E. Huxley证实,肌球蛋白的头以锐角的角度结合到肌动蛋白丝上;在电子显微镜下以肌球蛋白头装饰的丝看起来就像一连串箭头。因此,研究人员把肌动蛋白丝的两极定义为“尖锐的”和“具倒刺钩的”。
Huxley还提出肌肉收缩是肌动蛋白和肌球蛋白丝状体与尖端方向运动的肌动蛋白丝状体作反向滑动的结果。这种滑动所需的能量来自肌球蛋白头对三磷酸腺苷(ATP)的酶解作用。正如东京大学的Setsuro Ebashi所证明的那样,肌肉细胞中的这种化学反应是由作用于肌钙蛋白和原肌球蛋白(这是粘附于肌动蛋白丝表面的另两类蛋白)上的钙离子调节的。
70年代中期,国立健康研究所的Robert S。 Adelstein发现,钙还能够控制肌球蛋白分子的理化活性。在非肌肉细胞中,钙间接地诱发化学反应把磷酸根加进肌球蛋白的头里去。一旦以此种方式磷酸化,肌球蛋白就能够对肌动蛋白丝施加收缩力。其它酶类则移走磷酸根并使肌球蛋白失活。所有这些研究都暗示,细胞的刺激作用通过改变钙的水平和激活肌球蛋白来诱导表层肌动蛋白网络的收缩。
我的细胞蠕动化学过程的初步研究的目标是肌动蛋白凝胶的本质。这项开始于1974年的研究是在哈佛医学院与John H。 Hartwig合作进行的。我们最早发现,当我们在一定的实验条件下搅拌白细胞的提取液时,大量的肌动蛋白将随一种不知名的髙分子量蛋白一起沉淀。我们纯化了此种高分子量蛋白并将其取名为结合肌动蛋白的蛋白(ABP)。
大约与此同时,玛诺的夏威夷大学已故的Robert E. Kane也曾报导过:“海胆卵的提取液开始时是液体,接着胶凝成固定的状态。这些凝胶充满丝状的肌动蛋白。因此,我们和其他研究人员都明白了来自不同类型细胞的提取液可以形成相似的富含肌动蛋白的凝胶。低浓度的ABP与大量的肌动蛋白相结合,所以我们有理由认为ABP能使肌动蛋白凝胶化。”
Hartwig和我证实,ABP可以诱使肌动蛋白溶液的弹性急剧増加:丝中每1000个肌动蛋白分子中只有一个ABP分子可能使肌动蛋白溶胶变为较为稳定。没有任何其他结合肌动蛋白的分子在形成肌动蛋白凝胶方面会接近于这种效率。此事实暗示出这种胶凝作用是怎样发生的。
如果你把一大堆坚硬的杆(像肌动蛋白丝那样)推入容器中并摇动它们,那么热力学函数将驱动这些杆排列成平行的束。在细胞表层内侧假设肌动蛋白丝以相同的方式排列,而各种细胞蛋白就能把这些并连的丝交联成较稳定的束。这些平行排列的肌动蛋白丝对丝足具有抗拉强度。交联的肌动蛋白束还能够与粘性分子结合形成被称为粘附斑的多分子组合体。然而,这些束对于构成均一的片层凝胶是没有用的。
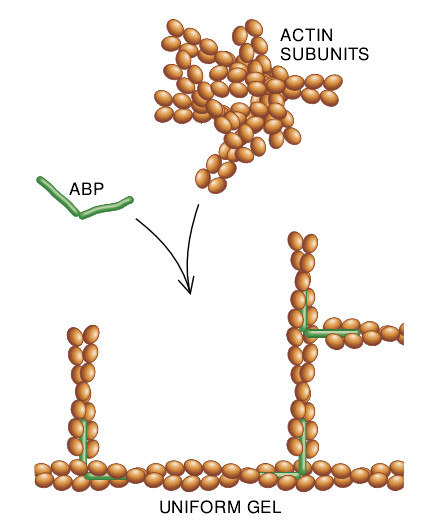
另一方面,把丝添补进均一的、矩形的三维网络中去的蛋白质就会非常容易地形成这样的凝胶。Hartwig和我推理,ABP要如此有效地形成肌动蛋白凝胶,它就必须使肌动蛋白丝大致以直角的角度产生分枝。1981年我们得到了由ABP交联的肌动蛋白丝的电子显微照片,并发现丝确实呈直角分枝。
随着我们对ABP的结构有了更多的了解,就更能理解分子装配肌动蛋白凝胶的技巧了。ABP是一个非常大的丝状体分子,每个ABP亚单位的一端结合肌动蛋白,而另一端似乎与另一个ABP亚单位的相似端结合。在ABP亚单位的两端之间含有可反复拉长的重叠结构;这些结构赋予亚单位以更大的稳定性并让它们远距离地去控制住肌动蛋白丝。
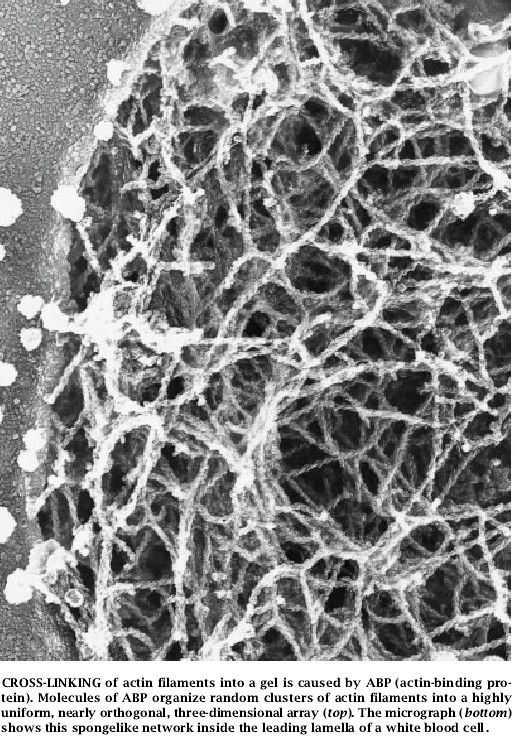
哈佛大学的Paul A. Janmey应用能够测定凝胶机械特性的仪器证明,由ABP交联的肌动蛋白凝胶是非常稳固而有弹性的:发现细胞中处于各种浓度状态的肌动蛋白和ABP都可以容易地提供外伸片层所需的刚性,而且,当时在我们实验室工作的京都大学的Tadanao Ito证实由低浓度的ABP交联的肌动蛋白凝胶还能够阻滞水的流动。在我们实验室休假的另一位科学家、瑞典林雪平大学医学院的Olle I. Stendahl应用荧光抗体证明,ABP分子位于白细胞表层区。这些发现全都支持了ABP在细胞表层帮助把肌动蛋白丝装配成凝胶。
Hartwig出于对由ABP交联的肌动蛋白凝胶显微结构的好奇,决定采用目前在华盛顿大学执教的John Heuser开创的一项技术以高的分辨率来检测它们。该方法是在液氦中快速冷冻样品以保存它们的结构。使用在真空中升华的方法去除样品上的冰:剩下的物质用金属遮蔽使之在电子显微镜下能够看得见。
Hartwig证明,在试管中,肌动蛋白在ABP的存在下形成了均匀的随机极化的丝状体矩形网络。丝状体的平均长度为1微米且每100毫微米处置直角分枝。他发现在白细胞片层内侧几乎是相同的网络:ABP分子位于丝状体之间的分枝点处。这种构造与丝足的构造不同,丝足中的肌动蛋白丝全是平行的,它们的具钩刺的一端远离细胞体。因此,我们的研究有力地暗示ABP是形成前导片层的具有弹性的、海绵状的肌动蛋白凝胶之最佳候选者。

ABP作用之最好证据来自如下的提问:“假如细胞没有ABP将会出现什么情况呢?”在C. Casey Cunningham领导的一项研究中,我们实验室分析了由患恶性黑素瘤的六位病人的肿瘤所产生的细胞系之蛋白质组成。这些细胞系之三个系含有ABP,其余三个系则没有。含有ABP的细胞具有蠕动细胞的典型特征:它们伸出玻璃状片层并向化学吸附剂移动。相反,缺乏ABP的细胞有正常的丝足,但其行为像它们的表层似的是不稳定的。它们没有突出前导片层并在受到刺激后蠕动。反之,由于不稳定的球形空出物(或疱)而处于不协调状态的细胞则扩张和收缩它们的整个表面。正常的细胞间或产生疱,而缺乏ABP的细胞则不断地形成疱状物。
我们对这些观察的解释是,在缺乏ABP的细胞中,表层的凝胶是脆弱的。当溶胶因细胞收缩而流动时,它的运动不易调整并产生球形突出物。在疱状物内,肌动蛋白丝不能成形为均一的凝胶,但它们最终可以形成一个具有足够粘性以回缩进细胞体的质团。当我们把ABP亚单位的工作基因插入这些缺失细胞后,它们的永久性疱状物消失,而且它们产生了蠕动的能力。
要使细胞蠕动,肌动蛋白凝胶必须自我重塑。细胞静止时,大约有一半的肌动蛋白不是聚合的,而是形成能随溶胶流动的单个的蛋白质亚单位。受刺激后只在某些胞内位点处有肌动蛋白聚合。在蠕动的细胞中,聚合的肌动蛋白总量总是恒定的:一部分的聚合作用与另一部分解聚作用相平衡。
正如Oosawa所确定的那样,肌动蛋白自发地聚合成丝状体需要2或3个肌动蛋白亚单位最先汇聚成一束(或核)。此种情况经常发生,但一旦核已形成,它就迅速地一直添加更多的亚单位使之延伸到最初的丝状体的末端。许多研究人员已证明,肌动蛋白丝具倒钩刺的一端比尖锐的一端伸长得快得多。
细胞用两种普通类型的控制蛋白来调节肌动蛋白的装配和拆卸。已知这些类型中之一的蛋白有三个亚类,忧先或只能与肌动蛋白亚单位结合。宾州大学的Vivianne T. Nachmias和Daniel Safer用蛋白质肌球蛋白进行研究,确定这些蛋白质抑制了肌动蛋白亚单位的自发成核作用。这些蛋白质还把亚单位添加到尖锐的一端上去。
这些结合肌球蛋白亚单位的蛋白质减慢而不是阻止把肌动蛋白亚单位添加到具有倒钩刺的一端。因此,它们本身不能阐释为什么在细胞内有如此多的肌动蛋白仍然未能聚合。要完整解释需要用另一种类型的控制蛋白质在具有倒钩刺的一端控制施加影响的第二种形式。
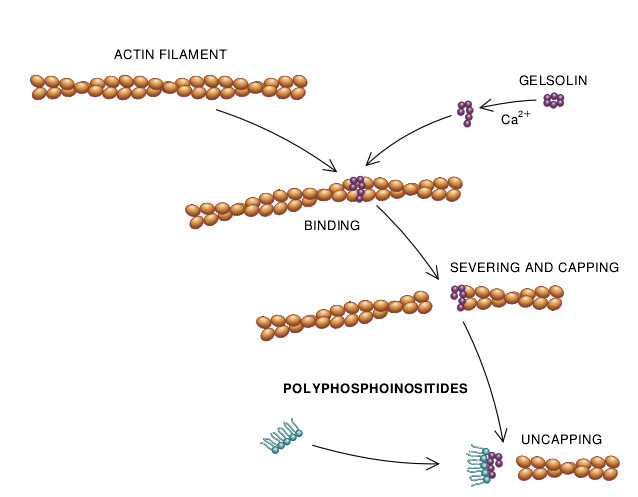
目前在得克萨斯大学达拉斯分校任教的Helen Lu Yin和我发现,这些最先结合肌动蛋白的蛋白质是1975年从白细胞中提取的。在细胞内侧就会发现在能刺激细胞蠕动的各种钙浓度的存在下,经蛋白质“戴帽”(caps)或阻遏的肌动蛋白丝的具倒钩刺的一端借此以阻止增添更多的亚单位。它还断裂支持丝状体结合在一起的亚单位的键——供丝状体将自己牢固地添加到刚暴露的具倒钩刺的一端。由于这种蛋白质急剧地缩短肌动蛋白丝的长度,它还能把肌动蛋白凝胶转变成溶胶。所以,我们将此种蛋白质取名为“凝溶胶蛋白”(gelsolin)。
发现凝溶胶蛋白后,跟着许多实验室的研究人员识别了各种各样的其它结合肌动蛋白的蛋白质,这些蛋白质或割断肌动蛋白丝或结合到肌动蛋白丝的具倒钩刺一端上,或者兼作两用。这些蛋白质可被分成三个亚类。其中之一是具有与凝溶胶蛋白有关的主要结构之扩展了的戴帽蛋白质的家系。这些蛋白质中的一些但不是全部亦可割断肌动蛋白丝。结构上不同的第一亚类蛋白质通常叫做帽子Z(capz)蛋白质;它是由在约翰•霍普金斯大学工作的Thomas D. Pollard和Shin Lin各自在变形虫和血小板中最先鉴定出的。第三亚类蛋白质是由科罗拉多州立大学的James R. Hamburg和医学研究协会的Alan S. Weeds最早发现于脑组织中,它含有丰富而不易断裂的肌动蛋白丝。这一亚类的蛋白质被命名为ADF、科菲林(Cofilin)、德帕丁(depactin)和阿克托福林(actophorin)。
钙使凝溶胶蛋白系统的蛋白质粘附于肌动蛋白丝的具倒钩刺的一端,但正如拜洛医学院的Joseph Bryan所指出的那样,单是移去钙不会使凝溶胶蛋白放松它的控制。有一段时期,没有人知道这种结合是怎样逆转的。其后在1987年Janmey和我把斯托克霍姆大学的Ingrid Lassing和Uno Lindberg对多磷酸肌醇磷脂的观察继续进行下去。这一类型的磷脂分子在细胞内是常见的成分,它对细胞内的信号传递有影响。Lassing和Lindberg已注意到多磷酸肌醇磷脂可以降低原菲林(profilin)的亲和力,此原菲林系1977年Lindberg研究肌动蛋白亚单位时发现的一种能结合肌动蛋白亚单位的蛋白质。
我们已证实这些磷脂对凝溶胶蛋白具有双重影响。它们特异地抑制凝溶胶蛋白割断丝的活性,而且还使之从肌动蛋白丝的具倒钩刺一端脱开。世界各地的许多实验室进行的各种各样实验已进一步表明,多磷酸肌醇磷脂几乎抑制所有戴帽的和割断的肌动蛋白丝的蛋白质之结合肌动蛋白的活性。
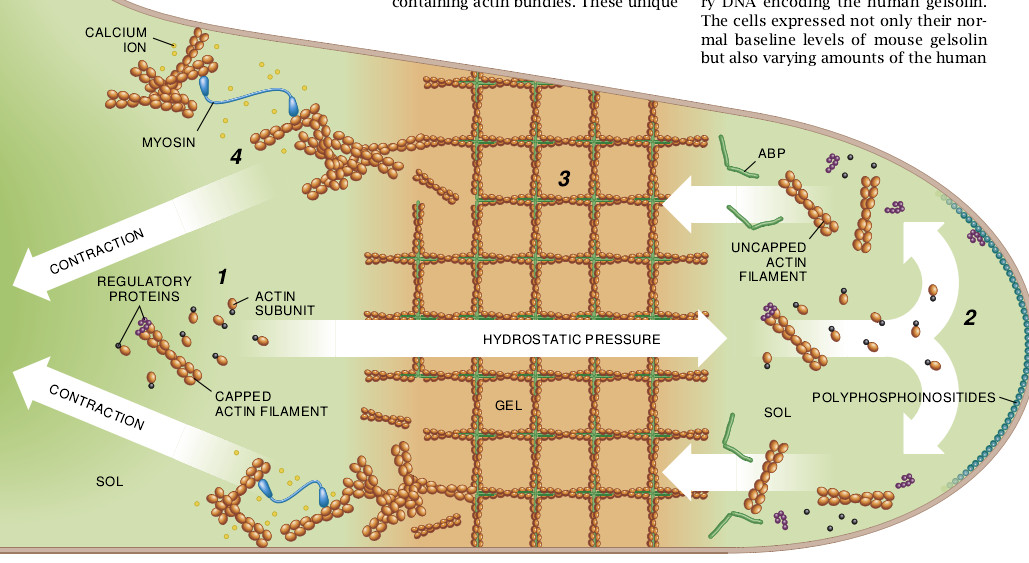
针对调节细胞蠕动模型的所有信息综合起来就是刺激诱发的信号传递和细胞表层内肌动蛋白凝胶的重塑。当化学吸附剂和其它试剂刺激细胞时,细胞膜中的酶类开始合成或分解多磷酸肌醇磷脂。分解反应的结果之一是把钙释放进充满来自膜结合贮藏泡的细胞之溶胶内。由于钙激活凝溶胶蛋白系统的戴帽肌动蛋白的蛋白质,所以多磷酸肌醇磷脂的降解会导致肌动蛋白的解集作用。
另一方面,多磷酸肌醇磷脂的合成可能使未戴帽的肌动蛋白丝接近质膜。借此则会促进把肌动蛋白装配成伸长的丝。对未戴帽的肌动蛋白丝来说,多磷酸肌醇磷脂的有效性是受它们的化学环境影响的。冷冻可使血小板中的肌动蛋白不可逆地成为凝胶,这是因为它引起细胞膜内相的改变和存在的这些磷脂发生了永久性的变化所致。
为使细胞蠕动,单靠肌动蛋白形成凝胶是不够的,还必须尽可能地把肌球蛋白戴在此种凝胶之上。根据我在前面已阐述过的,钙通过磷酸化肌球蛋白来激活表层肌动蛋白收缩;它还通过激活凝溶胶蛋白和有关的蛋白质来部分地溶解肌动蛋白凝胶。凝胶必须充分地解集以便让肌球蛋白去移动肌球蛋白丝,可是又不能这样彻底地把凝胶完全地变成液体。
目前在卡内基•梅隆大学任教的D. Lansing Taylor已把这种协调的现象称为“溶胶化作用-收缩作用耦合”。他和他的同事已使用肌动蛋白丝、ABP和凝溶胶蛋白的混合物来证实这一机制的可行性。肌球蛋白亚单位和从溶胶化的凝胶渗出液释放出的戴帽的短丝穿过片层进入突出物的膜内。在此处多磷酸肌醇磷脂不给丝戴帽,这些丝则通过亚单位而伸长并渗入进凝胶。
对活细胞的观察支持了调节肌动蛋白装配及其与细胞蠕动的关系的这种描述。武斯特实验生物学基金会的Yu-li Wang把荧光标记的肌动蛋白微注射进蠕动的成纤维细胞内。他声称标记的肌动蛋白已在细胞的前缘处渗入进了丝中。约纽艾伯特•爱因斯坦医学院布伦克斯分校的John Condeelis、宾州大学的Sally H. Zigmond和哈佛大学的Hartwig已发现,用化学吸附剂刺激的细胞都使肌动蛋白丝露出具倒钩刺的一端。Hartwig用资料证明,在血小板迁移中肌动蛋白丝的断裂取决于细胞内钙的出现。这些结果有力地暗示凝溶胶蛋白系统的蛋白质是用于蠕动的。
我已经讨论过的包括钙、磷脂和结合肌动蛋白的蛋白质在内的这些机制很明显不只是用作调节细胞内肌动蛋白装配的。例如,肌动蛋白亚单位可结合ATP(三磷酸腺苷)或ADP(二磷酸腺苷)。含ATP的亚单位比含ADP的亚单位能更有效地聚合。在聚合作用期间,结合的ATP分子还可酶促转化成ADP而释放出能量。当肌动蛋白亚单位从丝中脱离出来时,它们把它们的ADPs换成ATPs。设在Gif-sur-Yvette的法国国家科学研究中心实验室的Marie-France Carlier和其他研究人员已提出,结合肌动蛋白亚单位的蛋白质原菲林催化了这些结合和交换反应。据此,肌动蛋白亚单位的聚合能力、形成丝状体结构的能力和调节其它蛋白质影响的能力都要受原菲林的影响。照这样,这些反应还是肌动蛋白-凝胶重塑的重要控制者。
并非细胞的所有表面运动都要依赖于肌动蛋白凝胶的重塑,在片层中的情况就是这样。加州大学旧金山分校的Timothy J. Mitchison曾指出,有丝分裂后细胞的扩展可能包含通过一类单头的肌球蛋白分子沿含有肌动蛋白束的丝足的轨迹运动来向外运输肌动蛋白网络。这些单一的肌球蛋白是由国立健康研究所的Pollard和Edward D. Korn发现的。
丝足扩展的机制显然是与片层突出物的扩展机制不同的。宾州大学的Lewis G. Tilney于70年代初最先指出,丝足扩展包括肌动蛋白装配。加利福尼亚大学伯克利分校的George F. Oster曾提出过这些叫做布劳恩爪(Brownian ratchet)的突出物之机制。在他的模型中,细胞膜内温度的变动驾御了肌动蛋白装配的方向和丝足伸出的力。
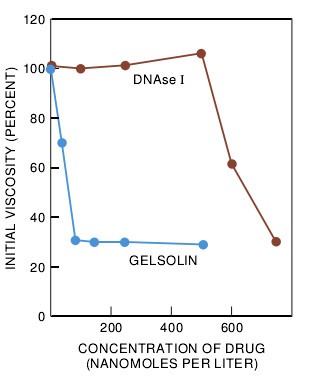
研究细胞怎样蠕动的一个理由是希望能够修饰这种活性——使细胞蠕动加快或放慢。凝溶胶蛋白和相类似的蛋白质水平的变化可以影响细胞因受到刺激而蠕动的速率。当哈佛大学的Cunningham、David J. Kwiatkowski和我建立起遗传工程上携带有编码人凝溶胶蛋白的DNA之小鼠成纤维细胞培养系时,此种期望已得以实现。这些细胞不仅表达了它们正常的小鼠凝溶胶蛋白之原始水平,而且还表达了不同总量的人体蛋白质。试验表明,这些细胞移动的增加与它们的凝溶胶蛋白浓度成正比。
这些结果证明,调整细胞蠕动的胞内结构能够影响移动的速度,至少在实验室里是这样。有效利用更精确的遗传操纵是不难想象的。例如,加速成纤维细胞的移动就可以加快伤口的愈合相反,如果我们可以部分地抑制细胞蠕动,那我们就能够阻止坏死性炎症对白细胞的破坏,或者阻止由激活的血小板介导的冠状动脉血栓的形成。
在1979年可能就已经出现这项研究计划的比较直接的有实用价值的附带效果。阿普萨拉大学的Astrid Fagraeus和Rene Norberg以及杰尼瓦大学的Christine Chaponnier和Giulio Gabbiani经各自独立的研究发现,血浆中的某些物质可引起丝状肌动蛋白解聚。这种活性的分子基础,后来由其他研究人员证明是存在于共同起作用的两种血浆蛋白中的:Gc球蛋白(一种能结合肌动蛋白的遗传多形性蛋白质)和一种分泌的凝溶胶蛋白型。
根据一些研究人员已经证实的那样,受伤害的动物和人在其血液中往往含有胞外肌动蛋白;而且,他们的球蛋白和血浆凝溶胶蛋白的水平是下降的。哈佛大学的Stuart E. Lind和宾州大学的John G. Haddad都同时发现,由于胞外肌动蛋白对血液的凝固作用之复杂影响,它可能对组织有毒害作用——甚至可能致死。因此,Gc球蛋白和血浆凝溶胶可能是清除肌动蛋白系统的组成部分。
最近我们已看出,这类肌动蛋白的清除作用在囊性纤维变化(一种最常见的影响欧洲血统人口的遗传疾病)中可能是重要的。一种尚不清楚的基因缺损,即编码运输氧化物的调节蛋白基因的突变,由于某些未知的原因,造成肺部气道的异常分泌。结果,肺部发炎并受细菌感染。在包括中性白细胞在内的大量蠕动过程中气道内充满了随即变性的白细胞。这种脓性物质使肺部粘液胶凝成高度粘滞的能够逐渐窒息囊性纤维变性病人的粘性块状物。
囊性纤维变性病人粘液的胶凝作用长期以来一直被归因于由垂死的中性白细胞核释放的DNA聚合体。为治疗这种疾病,医学研究人员因此而开发了一种遗传工程的酶型,叫做脱氧核糖核酸酶I(DNA酶I)。最近该酶已被核准供临床使用。这种DNA酶I在离体条件下可使病人气道分泌物的稠度变小。据报道,这种药物被吸入后。它能改善肺的功能。显而易见的,此药物是通过酶解长的DNA聚合物而起作用的。
虽然如此,我们对肌动蛋白成胶作用的研究揭示,DNA酶I通过不同的机制也可以取得有益的结果,1963年Lindberg提纯了一种能抑制天然类型DNA酶I的蛋白质。10年后,当他利用休假在冷泉港实验室工作时。他和Elias Lazarides确定这种抑制蛋白就是肌动蛋白。像Gc球蛋白那样,DNA酶I紧密地与肌动蛋白亚单位相结合。如果DNA酶I的存在数量充足,它就能通过阻止把亚单位添加进皱缩的丝状体的方法来解聚肌动蛋白丝。因此,我的同事和我决定留心丝状的肌动蛋白——它在白细胞内可能与DNA—样量大——是否可能对囊性纤维变性的粘液成胶作用有明显的促进作用。
我们的研究发现,肌动蛋白存在于病人的痰中,它可以就在那里抑制DNA酶I的DNA的裂解活性。我们还证明,补充血浆凝溶晈蛋白降低了粘液的粘滞性。凝溶胶蛋白在稀释粘液方面事实上显得比DNA酶I更有效(其实我们已预计到凝溶胶蛋白可割断肌动蛋白丝)。由于DNA酶I和凝溶胶蛋白是通过不同的机制起作用的,所以有可能把它们合在一起发挥综合疗效。凝溶胶蛋白是体内正常的胞外组成物。把它用于气道,理论上应该是无毒的而且不应该引起免疫应答。临床研究也许有一天能够把这些成果转化成对囊性纤维变性的适当的治疗方法。如果是这样的话,这次研究将更加充实生物学家们以前的研究成果,生物学家们对于像在蠕动细胞中肌动蛋白凝胶化这样一些难解的问题所作的基础研究,必然会推动医学的进步。
【赵裕/译 颂平/校】
请 登录 发表评论