免疫与无脊椎动物
Gregary Beck*, Gail S. Habicht**
人类和其它哺乳动物的极其复杂的免疫系统进化了亿万年——有时以惊人的方式进化。
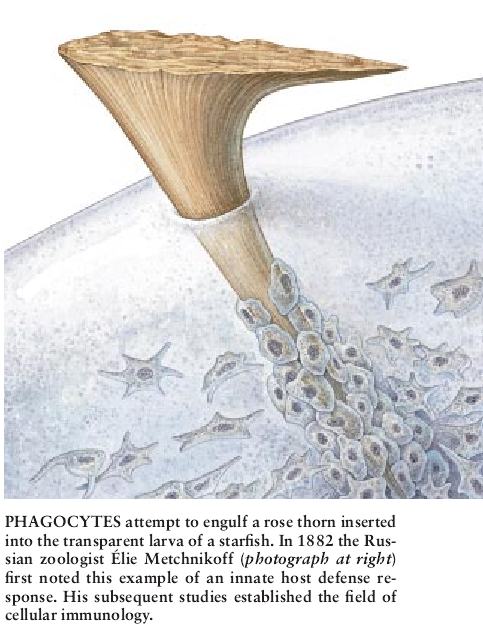
1882年12月,一位名叫Elie Metchnikoff的37岁俄罗斯动物学家在西西里东北海岸的墨西拿城沿海滩进行了一次致关重要的散步。他带了一只细小的、透明的普通海星幼鱼回到他的小别墅,用玫瑰束刺穿了这只小海星。第二天早上当他观看它时,发现覆盖在玫瑰刺上并试图吞没它的致密的细胞。
他立刻意识到这种观察结果的意义——这些细胞正试图以称作噬菌作用的过程摄食入侵者来保卫这只幼鱼。已经知道在某些专化的人体细胞遇到细菌或酵母菌时会发生噬菌作用,但Metchnikoff的重大发现是噬菌作用实际上起一种更加广泛的作用。事实上它是一种基本的机制,整个动物王国的生物通过这种机制来保护它们自己免受侵袭。利用这种锐利的洞察力和随后的研究生涯,Metchnikoff创立了细胞免疫学这一学科。因为他的开创性研究,他与Paul Ehrlich合得了1908年的诺贝尔奖,后者是称作体液免疫的其它免疫基础成分重要性的一位早期支持者。

作为Metchnikoff的成就令人佩服的是,不是他所完成的程度。重要的是,他的具有里程碑意义的试验对象海星是自它至少在6亿年前出现以来,实际上保持不变的一种动物。在刺穿海星后,Metchnikoff在西西里是年12月的那一天观察到的奇观与有脊柱的第一种活的动物——脊椎动物——出现之前数千万年的地球原始海中可观看到的没有多大的差别。
Metchnikoff十分清楚这一事实,而且他的研究将最终表明,所有现代动物的寄主防御系统源于在开始有生命以来就居住在地球上的无数生物中,因此还诞生了另一个学科:比较免疫学。通过研究不同的生物有些非常古老—比较免疫学家得到独特的见解,它使我们从另一个角度看到所有进化创造中最复杂最奇妙的一种创造:人和其它高级哺乳动物的免疫系统。这个学科也往往导致对进化自身的本质的理解:地球上构成90%以上的物种的无脊椎动物证实了它们的表面“原始”寄主防御机制的效能。此外,比较免疫学已使研究人员发现几种与免疫有关的物质,这些物质似乎表明大有希望用于人类。
我们的认识和免疫学工具近来的进步在比较免疫学中已形成了一个多产的时期,可以说是第二个黄金时代。应用最近几年发展起来的分子和细胞生物学工具,研究人员已对如海星、昆虫、鲨鱼和蛙之类完全不同的动物的寄主防御系统建立了一个给人印象深刻的认识的基础。
免疫如何起作用
为了充分地评价在若干亿年中免疫系统经历的进化的曲折变化,必须弄清它们如何起作用。对任何免疫系统最根本的要求是区别寄主躯体的正统的部分与可能存在的称为“非自我”的外来物。第二个职能将是消除那些非自我的入侵者,这些入侵者往往是危险的细菌或病毒。此外,免疫系统能够识别因损伤或如癌症之类的疾病而改变了的“变节自我”(细胞或组织),而且一般消除这些“变节自我”。大多数免疫学家都同意,如人类这样的哺乳动物的免疫系统有认别和消除人侵者这两种最复杂的机制。
设想当一个周末(业余)园丁在一颗玫瑰刺上扎了她的手指时会发生什么。在流血止住后几分钟内或者立即,免疫系统开始发挥它的作用以消灭侵入伤口的不受欢迎的微生物。吞噬细胞的白血细胞(称作巨噬细胞)已经在场(或迅速到达)。这些细胞不仅吞食和破坏任何入侵的微生物,而且还释放出可活化免疫系统的其余部分和向可能需要的其它吞噬细胞发出警报的蛋白质。
这种快速的细胞应答有时被称作天然免疫或先天免疫,因为执行这一免疫任务的细胞在入侵者出现以前在体内就已经是活化的。所有的动物均具有这种防御性机制,据信它是最古老的免疫形式。例如,Metchnikoff那尾海星幼鱼中观察到的就是先天性细胞免疫。
先天性免疫的另一个成分被称为补体。它是由血液中30多种蛋白质组成。这些蛋白质以一种阶式依次发生作用,以鉴别和消灭入侵者二先天性免疫一般足以破坏入侵的微生物:如果先天性免疫不足以破坏入侵的微生物,脊椎动物依赖另一种应答:获得性免疫。
获得性免疫的士兵是称为淋巴细胞(其集合功能如同一支军队)的专化性的白血细胞。淋巴细胞通过血液和淋巴结移动,而一般是静止的。但如果它们遇到与外来微生物有关的称作抗原的特异分子时,它们变为活性的并繁殖。淋巴细胞分为B和T两类。B淋巴细胞分泌抗体——与抗原相结合并有助于消灭抗的防御性蛋白质。人体一般含有1000亿多个B淋巴细胞,其中每个都分泌与大多数其它抗体不同的抗体。T淋巴细胞有许多作用;例如它们识别和杀死在其表面含有非自我分子的细胞。它们也帮助B淋巴细胞生产抗体。
获得性免疫是高效的,但为了使其动员需要花若干天的时间,因为应答是极为复杂的。一个入侵的微生物必须与正确的T淋巴细胞或B淋巴细胞相接触;巨噬细胞必须被活化以提供协助者;活化的淋巴细胞必须分裂;所有涉及到的白血细胞必须合成和释放可增强其应答的蛋白质;B淋巴细胞必须生产和释放抗体。
然而获得性抗体也有一个标志性的特征——免疫记忆——它能缩短延迟时间。免疫记忆由基于DNA的机制产生,这种机制使人体的淋巴细胞识别如此惊人多样性的抗原。尽管每个淋巴细胞只能认别一种抗原。实质上。与入侵微生物的每次相遇都在一定的B和T淋巴细胞中打上一个遗传的蓝图。下一次这些细胞遇到相同的入侵者,它们就以比第一次更快和更有力地产生响应的方式应用这个蓝图。这种现象正是使对儿童可能采取熟知的加强剂量注射(即免疫接种)的现象。我们例子中的园丁随着时间的流逝可能忘记她的不关紧要的刺痛,但她的免疫系统决不会忘记。
开端
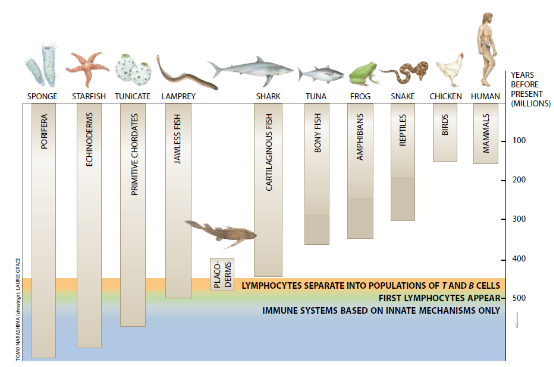
正如我所描述的那样,如哺乳动物这样的高等脊椎动物之免疫系统能够被划分为两个主要类型的应答:先天性的和获得性的。后者包括作为一个显著的、区别性特征的免疫记忆。这种应答是由许多不同的因素介导的:巨噬细胞和其它吞噬细胞。B和T淋巴细胞、抗体和许多其它参与的蛋白质。比较免疫学的核心问题之一是:这些特征——或相似特征——中有好多出现在其它较古老的生物类群中?
这些特征有相当多出现在其它较古老的生物类群中;事实上,免疫的某些成分住几乎所有活的生物中都是可检测到(噬菌作用就是一个例子)。经过亿万年,这些成分中的一些从一种生物基本上无变化地转入到下一种生物中,其它的特性是高等脊椎动物所特有的。但是与无脊椎动物寄主防御系统的情况具有有趣的相似性。这些相似性是重要的,因为它们表明,无脊椎动物的这种机制是相应较晚的脊椎动物机制的前驱。总之,这些联系可能是从更为古老的生物经过亿万年进化为人类和其它哺乳动物的免疫系统之最有说服力的证据。
不足为奇当生命产生时寄主免疫系统即开始,对于原生动物这种所有活的生物中最简单的一种就是如此。原生动物(它可追朔到约25亿年前)是单细胞的生命形式,换句话说,它们仅在一个细胞中就完成各种生理功能在原生动物中,呼吸、消化、防御和其它功能至少部分地是由吞噬作用在执行,在它的防御功能方面原生动物的吞噬作用与在人体中发现的吞噬细胞所执行的吞噬作用并无很大的差异。
在从海星到人类的动物中,吞噬细胞通过一个循环系统或(在海星的情况下)通过一个充满液体的体腔而移动。在缺乏体腔和循环系统的多细胞动物中(例如海绵),漫游的吞噬细胞在组织及其周围的孔隙中巡逻。
免疫的另一个基本问题——区别自我和非自我的能力——也从生命史的初期开始存在至今。一些原生动物生活在成千上万个生物群落中而且必须能够彼此识别。很难设想,在不能区别自我和非自我的情况下,集群的生命或性繁殖怎么能发生;因此,很有可能原生动物具有这种能力。甚至在某些科学家看来是最古老和最简单的后生动物(多细胞动物)的海绵也能够区别自我与非自我,它的细胞攻击来自其它海绵的移植物。
但是,这种排斥反应与脊椎动物中发现的排斥反应不一致。在脊椎动物中,由于免疫记忆,如果来自一个供体的一片移植物被排斥,来自同一供体的第二片移植物将被更快地排斥。但是在海绵和水母中,第二次排斥并不比第一次排斥快。这些结果表明,脊椎动物系统的基础即免疫应答的记忆成分不存在于海绵和水母中。用海星和其它高等无脊椎动物进行试验支持这一结论,这些生物也缺少免疫记忆。
脊椎动物免疫系统的其它两个特征—补体和淋巴细胞—在无脊椎动物中也缺少,但是无脊椎动物中似乎有两者的类似物。作为补体的替代物,包括各种昆虫、蟹和蠕虫在内的几门无脊椎动物表现称为原酚氧化酶(proPO)系统的类似响应。proPD像补体系统那样被一系列的酶活化。多级反应以proPO转化为完全活性的酶酚氧化酶而告终,后者在用胶囊包住外来物体方面起作用。瑞典乌普萨拉大学的Kenneth Soderhall和苏格兰Gatty海洋实验室的Valerie d. Smith已指出,这个系统也为其它目的服务,包括血液凝结和杀死微生物。
无脊椎动物缺乏淋巴细胞和基于抗体的体液免疫系统。然而,它们的确有似乎是脊椎动物免疫的这些方面前体的机制。例如,在蚯蚓中已发现淋巴细胞样的细胞——这种动物或许出现于5亿年前。也许更为显著的是,所有无脊椎动物具有其功能似乎类似于抗体的分子,它们可能是抗体的先行者。这些分子(称为外源凝集素的一组蛋白质)能够与细胞上的糖分子结合,因此使细胞呈粘性并使得它们结成块。外源凝集素必然进化得十分早,因为它们是普遍存在的;除无脊椎动物外,还在植物、细菌和脊椎动物中发现它们。
尚不能精确地知道外源凝集素在免疫应答中的作用;它们似乎在标记侵入有机体方面起作用,这些有机体或许被不同的糖分子所覆盖。从蚯蚓、蜗牛、青蛤以及实际上各种其它无脊椎动物分离的外源凝集索参与包被外来粒子,因此促进吞噬作用。在各门动物中都能发现有不同糖特异性的无数外源凝集素。从麻蝇(Saccophaga peregrina)和海胆中分离的外源凝集素与称为collectin的一族脊椎动物蛋白质有关。在人体中,Collection在包被微生物的先天性免疫中起重要作用,因此它们能够更加容易地被吞噬细胞和被活化免疫细胞或补体所识别。

此外,虽然在无脊椎动物中未发现抗体,但却发现了一些在结构上和功能上相似于它们的分子。抗体(也称作免疫球蛋白)属于非常大,非常老的分子家族——免疫球蛋白超家族。在这一类的分子全都有称作Ig褶的特征性结构。它们起着不同的功能,但一般涉及识别非自我以及其它种类的分子。
或许Ig褶在后生动物进化期间出现,那时专化性的细胞开始有必要相互识别。这种褶可能原来是鉴别自我中所涉及到的型识别分子;后来,它进化为也能识别抗原的某种东西,从而为真正的免疫球蛋白的出现作好了准备。
从蛾的血中分离的一种蛋白质hemolin是免疫球蛋白超家族的成员。它与微生物的表面结合,并参与它们的移除。研究已鉴定出了几种无脊椎动物(蝗虫和蝇)以及低等脊椎动物中的其它超家族分子。这些观察表明,基于抗体的免疫应答虽然局限于脊椎动物,但在无脊椎动物的防御机制中有它们的根源。
免疫调节的前体
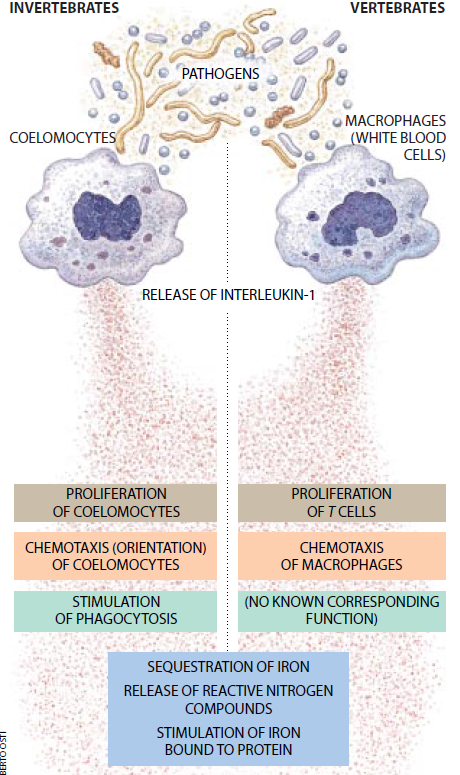
进化似乎不仅保存了在无脊椎动物中发现的寄主防御机制的许多功能,而且也保存了这些机制的许多控制信号。我们自己的研究近来集中在分离无脊椎动物中与脊椎动物的细胞激活素相似的分子。细胞激活素是被能刺激或抑制免疫系统的其它细胞并对其它器官也有影响
的各种活化免疫(和非免疫)细胞释放的蛋白质。细胞激活素包括干扰素、白细胞介素(如IL-1和IL-6)和肿瘤坏死因子(TNF)。这些分子是脊椎动物免疫各个方面的关键的调节物。
我们认为无脊椎动物有几个理由,应有工IL-1或相似的祖先细胞激活素。首先,这些分子调节脊椎动物免疫的一些最原始的机制;其次,在许多不同的脊椎动物中IL- 1的结构和防御功能是相似的,表明这种分子是由一种共同的前体进化而来。最后,产生IL-1的这种白血细胞即巨噬细胞在整个动物王国中是普遍存在的。
我们从普通大西洋海星(Asterids forbesi)的体腔液中分离出了其行为在许多方面像 IL-1的一种蛋白质:它的物理、化学和生物学特性是相同的;它刺激脊椎动物细胞对IL-1的反应;而且识别人IL-1的抗体也能识别这种蛋白质。因此,我们已发现,许多无脊椎动物具有与脊椎动物的细胞激活素相关的分子。蠕虫和被囊动物(海鞘)带有与IL-1和TNF相似的物质。作者之一(Beck)在烟草天蛾中已发现相似于IL-1和IL-6的分子。因此,无脊椎动物具有这三种主要脊椎动物细胞激活素的相关物质。
这些无脊椎动物细胞激活素似乎执行与脊椎动物的细胞激活素相似的功能。我们发现,在海星中叫做体腔细胞的细胞(相当于巨噬细胞)产生IL-1。在加州大学洛杉矶分校的Edwin L. Cooper和现在在悉尼大学的David A. Raftos所作的实验中,我们指出,IL-1刺激这些巨噬细胞的同等物吞没和破坏入侵者,因此无脊椎动物细胞激活素似乎是协应答和谐一致,正如脊椎动物细胞激活素在先天性免疫中所起的作用一样。
从蛙中分离药物
比较免疫学不仅仅是在无脊椎动物中寻找脊椎动物防御系统的类似物,相反对无脊推动物的研究有时揭示新型的防御类型,这些防御类型也仅在以后才在脊椎动物中被鉴别出来。
例如,无脊椎动物的关键防御分子是抗细胞的肽和蛋白质。这些分子——其中有些作为人类的药物有潜在的重要使用价值——一般是在先天性应答的初期从生物的血细胞中释放出来。从无脊椎动物中分离的最普遍的抗细菌蛋白质是溶菌酶,它也是分离的第一种物质。当感染开始或当暴露于构成细菌细胞壁的蛋白质时昆虫产生溶菌酶。有趣的是,溶菌酶在入体中也是先天防御的一部分。例如,在唾液中它起防御口腔受细菌感染的作用。
1989年Hans G. Boman领导的斯德哥尔摩大学的一个研究小组在蚕蛾(Hyalophora cecropia)中发现了有消灭细菌特性的肽。他们定名为细克入破素(cecropin)的这类肽能够在对动物细胞无害的足够低的浓度下杀死细菌。它们穿入细菌,使细菌细胞破裂。最近从猪肠的上部中分离出了与细克入破素有关的5种不同分子,它们在肠内有助于调节动物消化道内的细菌含量。当前它们正被开发作为人用的抗细菌成分。
国家科学研究中心(CNRS)斯特拉斯堡研究所的Jules A. Hoffmann及其同事一直在研究昆虫中叫作防御素(defensin)的另一组抗细菌肚。已从几个昆虫目中分离出了防御素,而且它似乎是最普通的一组诱导抗细菌肽。与细克入破素相同的是,防御素是相对较小的蛋白
质分子。与细克入破素不同的是,它们杀死细菌的方式尚未完全弄清。哺乳动物防御素也是很小,但其它方面与昆虫防御素极少有共同之处。这些事实表明,小的抗细菌肚是动物迅速展开的防御前线的一个基本部分。
较低等的脊椎动物物种一也产生独特的寄主防御分子。1987年,当时在国家卫生研究所的Michael Zasloff观察到,非洲有爪蛙不需要抗生素和其它治疗就能完全从不消毒的外科手术中康复——尽管它们是在充满细菌的水中恢复健康。通过寻找这种不平凡的保护的根源,他最终从蛙的皮肤中分离到两种肽——他把它们定名为magainins 1和2。(“magainin”来自希伯来语单词“盾”。)这种化合物表现广范围的抗细菌、真菌和原生动物的活性。与magainin结合的抗体也与如皮肤和肠衬料之类的人表皮组织的细胞结合,这表明人体合成类似的分子作为抗病原的一线防御分子。
遍布的遗产
肽抗体(以及其它独特的寄主防御方法)最初是在无脊椎动物中发现的这一事实可能有助于促进对深奥的防御系统的研究,这种防御系统己在免疫研究的“浪潮”中被冷落在一边无人问津。谁知道有好多潜在的拯救人类生命的化合物仍有待去发现?
对无脊椎动物的寄主防御系统的研究没有引起多少注意,这是令人吃惊的,因为这种研究在许多方面产生效果。正在发现所有活的物体的新的、不同的防御功能特征。而且通过考察古老的祖先生物,我们也正在了解关于它们的进化后代。
最后,通过分析如在非脊椎动物中发现的不太复杂的系统脊椎动物免疫应答的复杂性才能被充分认识。这种研究不仅对弄清基本的进化,而且对弄清与人类健康和疾病有关的更为直接的问题肯定有广泛的意义。在这些研究工作和其它的研究工作中,Metchnikoff的遗产是无处不在的。
〔刘义思/译;郭凯声/校〕
请 登录 发表评论