用于治疗的胶囊包裹细胞
Michael J. Lysaght,Patrick Aebischer
一种新出现的治疗疾病的方法是将活细胞与塑料薄膜相结合以保护细胞不受免疫攻击的伤害。
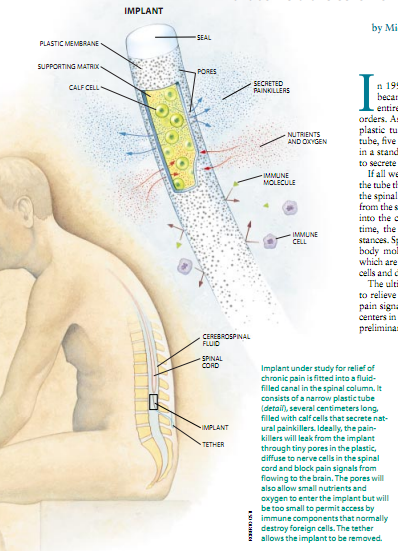
在1994年,一个遭受剧烈疼痛的男性患者成了第一批接受治疗人类疾病的一种全新方法试验的自愿参加者之一。当他静止不动地躺着时,一个外科医生将一个小的塑料管插进他的脊椎这一个5厘米长,像标准回形针的金属丝那样细的密封管含有能够分泌止痛药鸡尾酒剂的犊牛细胞。
如果一切顺利,分泌物将会通过微小的孔从管中渗并扩散到脊髓中去。同时,来自周围的脑脊髓液的营养物质与氧将会进入胶囊中以供养细胞。而且,这种管会挡住大的物质进入,特别是它将防止免疫系统的细胞与抗体分子(它们两者都比较大)与牛的细胞接触并将它们当作外来异物加破坏。
这一特殊方法的最终目的是通过阻止疼痛信号通过脊髓流到脑里的检测中心而减轻不适。但是,1991年的研究是初步的:它的目的是观察了解植入的细胞能否成活与能否在12个月中释放它们的止痛药。结果证明确实如此。在后来几个患者中取得的成功,证明目前正在进行的用直接评估控制疼痛的作用的一个主要试验是值得做的。
但是这些结果也有更广泛的意义。它们使人们在广泛的动物试验的基础上所产生的乐观主义情绪不断增加。这些将活的细胞与保护性合成薄膜结合起来的试验可能有助于矫正一系列的人的失调。
5年后这一使人感到兴奋的方法——它有多种名称,如胶旋包囊细胞疗法、免疫隔离疗法或生物杂种疗法——似乎被完全证明是正确的。一个生物杂种肝维持系统如同疼痛移植体一样,已经进入了涉及到好几十个病人与许多中心的有对照组的人体试验,用于各种其它疾病的免疫隔离疗法正在小规模的人体试验中或在对较大的动物的研究中被评价。这些疾病包括破坏性神经变性失调(如像帕金森病与亨廷顿舞蹈病)、血友病、贫血与生长迟缓。对黄斑变性(视觉缺失症的常见病)与其它眼病的治疗也正在啮齿动物中开始接受评价。
建议的大多数用法包括将胶囊包裹的细胞植入身体内选择的部位中,但是仍有一些方法(如像治疗肝病的方法)将细胞与膜结合到一个类似于肾透析机的床侧装置中。

免疫隔离疗法因为它能克服植入的游离细胞的缺点而引起我们与其他研究人员的兴趣这些包裹在薄膜中的细胞就像游离细胞一样,有可能补充已经损坏或丧失的细胞的关键性的功能它们也能够提供如像止痛剂这样的“额外的东西”它们甚至于能够为基因治疗创造条件,分泌由分子生物学家引进细胞的基因编码的蛋白质。
但是,游离细胞很可能被免疫系统所攻击,除非它们来自受体本身或它们的双生子。因此,患者通常需要抑制免疫的药物通过用机械方法阻止免疫攻击,移植细胞周围的塑料薄膜使患者不再需要这些药物;这些药物使患者易受感染并可能患某些癌症(淋巴瘤)与肾病。
由塑料薄膜提供的免疫保护作用也使来自动物的细胞可能被移植到人中。未被胶囊包裹的动物细胞不是一个可行的选择方案。因为现有的抑制免疫的药物不能充分保护对杂交种移植物(异种移植物)的排斥。使用动物细胞将有助于补偿众所周知的人类供体到胞的短缺,最后,如果有必要,可以很容易地修补被移植在塑料壳体中的细胞。
一个令人鼓舞的建议
现在为了治疗而用胶囊包裹细胞的研究在很大程度上得益于William L. Chick在本世纪70年代中叶提出来的想法。当时他在波士顿的Joslin研究实验室工作,就像那时与现在的许多科学家一样,他把注意力放在医治依赖于胰岛素的I型糖尿病上,这种病通常发生在青少年中。当胰腺停止制造腋岛素时,这种病就会发生。胰岛素是一种激素正常情况下释放的数量可以协控制血液中的葡萄糖(一种蔗糖)浓度。每天注射胰岛可以挽救生命,但是它们不能模仿胰腺释放胰岛素的天然模式。因此,一些组织时常暴露于太多的葡萄糖中。经过几年,像这样的过量能够导致糖尿病并发症,如像视觉缺失与肾病。
Click认为,移植用胶囊包裹的胰岛——含有分泌胰岛素成份的成群的细胞——可以恢复释放胰岛素的合适方式而不需要服用免疫抑制剂。而且使用取自猪身上的胰岛(那时注射的胰岛素的主要来源)将确保细胞中有丰富的输送管。
在70年代中期与后对啮齿动物的研究表明,他的推理是正确的遗憾的是,某些技术障碍迄今还使免疫隔离疗法在治疗糖尿病上不能一展身手。Chick去年逝世了,没有看到他的梦想得以实现。然而,他的开拓性的想法导致了其它方面(包括装置设计在内)给人印象深刻的进展。
创造性的结构
胶囊包裹系统现在有许多形式。但是,全都包括相同的基本成份(它们一般能够分泌有用的产物),作细胞的衬垫并在其它方面保证它们的存活与功能的基质,与多少有孔的膜;生物医学工程师们现在知道,如果在移植物中的细胞离开血管或其它营养来源的距离超过500微米(1微米为l米的百万之一)——约等于自动铅笔中石墨的直径,它们起的作用就会很差或者死亡。
血管型(即血液通过型)设计方案是首批获得测试的装置(为矫正啮齿动物中的糖尿病),这些装置使患者的循环血液转向流入一个塑料管内,然后又回到循环系统分泌细胞被放在一个密闭的小室内、小室围绕着一段稍微有孔的管道、就像一个炸面饼圈环绕若它的孔一样,当血液流过这部分管道时能够吸收治疗细胞分泌的物质并向这些细胞提供氧气与营养物。如果有胰岛在小室内,它们将使释放的胰岛素与血中的葡萄糖浓度相一致。对于其它用途则可以选择恒定速率放产物的细胞。
能够以可移植的形式生产这种血液流过装置,但是它们大概在床侧设备中用处最大,因为植入者需要进行侵害性的血管外科手术和长期服用血液冲淡剂(防止血液凝块在管道中形成)而且,如果一个植入的管破裂,就会产生内出血。
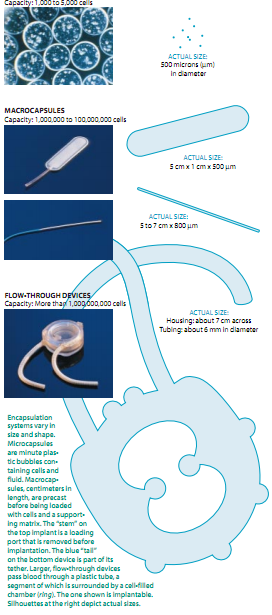
在寻找一种伤害性较小的方法时,研究人员在70年代末期引进了“微胶囊包裹系统”为了制造微胶囊,工作人员将一个胰岛或几干个单个细胞放进一滴含有稍微充电的聚合物的水溶液中,然后他们将水滴浸在带有相反电荷的聚合物溶液中。该聚合物发生反应形成一个环绕充满细胞与液体的小液滴(直径约为500微米)的覆盖层微胶囊容易生产从而可以加快试验,但是用于人的医疗则有明显的缺陷它们是十分容易损坏的一旦放入,如果它们有不良影响,要找到与拿出它们也许很困难,这是一个明显的问题。而且,医治一种疾病所需要的量可能太大,以致不能很方便地将其放入一个希望的植入位置上。
用于人类疗法的最实用的形式似乎是预制的大胶囊,最初它们是空的,然后装入基质与所有需要治疗的细胞。一些大胶囊呈圆盘状,它的尺寸大约有美国的1角银币或价值25分的辅币那么大。另一些的尺寸与形状则和衬衫衣领的撑条差不多。但是,打算用于人类的大胶囊通常都具有几厘米长直径介于500和1000微米间的密封或毛细管的形状。
大胶囊远比微胶囊小滴更耐久和牢实,它们含有内部的加强部分,可以在植入前测试其密封的完整性并被设计成可再次放人体内它们也可以简单方便地收回。它们受到的主要限制是它们可以容纳的细胞数:一个管最多到大约5百万个,一个圆盘或平板最多到5千万或l亿个,这些数字对许多用途都够了,但不是对全体用途而言。将封壳扩大往往使它们弯曲,从而加速其破裂。此外,弯曲区的边缘促使纤维变性,导致局部组织的向内生长纤维变形,可以阻止从胶囊包裹细胞运进运出的过程。

支路装置及微胶囊与大股囊的制造者所需要的薄膜孔的尺寸能够让高达50000道尔顿(分子重量单位)的分子扩散。孔的尺寸一般小得足以阻止免疫细胞与大部分免疫分子侵入,但是又大得足以让营养物与氧气流入和植入细胞分泌的蛋白质流出。但是,实际的薄膜的微孔尺寸往往分布在一定范围上,因此一些大的免疫系统分子将不可避免地穿过薄膜,进入植入物。幸运的是这种现象不会损害大部分植入物。
重新重视设计者细胞
直到本世纪80年代后期为止,大多数生物杂种装置都依靠原始胞,即那些直接取自于供体组织的细胞:原始细胞对于以小动物为对象的研究来说是方便的,但要获得对于大动物(包括人类)或对于众多的受体所需要的较大的数量的细胞则可能很成问题。此外,因为每一个供体都有其自己的历史,保证原始细胞的安全性可能是一个棘手的任务。所以,在90年代初期,一些研究小组开始转向研究细胞系。
这些细胞系由不朽的或不断分裂的细胞组成。这些细胞在培育中容易增殖,而不会失去执行特殊功能(如像分泌有用物质)的能力。许多原始细胞在培养液中上增殖很差或有其它的缺点。因此,为了制造一个细胞系,研究人员就必须改变原来的细胞。但是一旦被建立起来,细胞系就能够为移植提供源源不断的均一细胞。
用于胶囊包裹疗法的胞系的潜在用途在我们及其同事于1991年开始进行的动物试验中就十分清楚了。人们知道来自啮齿动物肾上腺瘤(嗜铬细胞瘤)的已建立好的PC-IZ系,能分泌高含量的多巴胺,它是帕金森病患者所缺乏的一种信号分子。为了了解含有这些细胞的植入物是否植得作为帕金森病的疗法来研究,我们将含有这些细胞的小管放进各种动物的脑中,它们产生多巴胺的细胞已通过化学方法加以破坏,以致产生类帕金森病症状。在包括非人类的灵长目动物在内的许多受试对象中,这一措施大大地改善了症状。
显然这些细胞没有不受控制地增殖与刺破腔囊它们取代了业已死亡的细胞,但是没有使其数量超过植入物的运载容量,这些研究也使人们不再担心;如果不死的细胞逃逸出来,它们会不可避免地引起恶性肿瘤。长生不死是一个细胞通向癌症的道路上的一步。但是,细胞为了成为真正恶性的,必须获得侵入邻近组织的能力,形成它们自己的血液供应与扩散到远距离部位上。肿瘤的形成在不死细胞的同种移植物中是一个潜在的问题,但是种间移植物则证明是不邢么令人忧虑的:在灵长类脑中的未被包裹的鼠PC-12细胞不形成肿瘤。实际上它们甚至不能存活:免疫系统很快破坏了它们。
没有在帕金森病患者中进行PC12的后继研究,也许是因为其它有希望的疗法占据了优先位置。但这些研究确实显示在免疫隔离疗法中推广应用细胞系的可行性。
用细胞系所取得的成功也打开了通向利用遗传上改变细胞之门,因为正在分裂的细胞最容易加以改变以接纳引入的基因并产生编码蛋白质,换言之,免疫隔离技术突然为实现基因疗法提供了一条新的途径:分子生物学家们为了产生在医疗上有用的蛋白质,将基因插入能够制造蛋白质的细胞系中,然后这些细胞就会被结合到塑料薄膜覆盖的植入物中。
基因治疗方案往往从患者中除去一些细胞,插入选择的基因,让改变了的细胞能够增殖,然后让最后所得到的收集品回到体内,以便希望制造出所需数量的蛋白质。而装有用遗传方法改变了的细胞的胶囊的产量可以在植入到患者前被测量。以后如果需要,胶囊可以很容易地被取出。
一个没有解决的问题是胶囊包裹疗法所利用的细胞系是否应该是从动物或人类衍生出的直接取自供体的原始细胞几乎肯定需要来自动物,因为人的供体组织严重短缺一些研究人员更喜欢用来自动物的细胞系,因为从一个植入物中逃出的细胞对于受体来说完全是外来的,因而会受到最快的免疫破坏。为了向受体提供人的治疗蛋白质,细胞设计者们可以很容易地为得到这些蛋白质将动物细胞装上人的基因。其他研究人员偏爱来自人的细胞系部分是因为人的细胞系往往在胶囊内表现较好。它们也避开了动物病原物将被传到人类的危险。为了更安全起见,如果人的细胞逃脱,可以对其进行遗传工程处理以诱发快速的免疫识别。
读者也许注意到,遗传上改变了的或没有改变的胶囊包裹的细胞基本上时常起治疗蛋白质的传送工具的作用。但是能够通过注入传送蛋白质。那么,为什么需要细胞移植呢?
当注射不能在最需要它的地方提供足够的蛋白质,如像在肿瘤中或在血脑屏障(一种阻碍血携带的物质到达脑细胞与脊髓的自然滤器)后面时,胶囊包裹的细胞疗法可能是很有用的:当一种治疗蛋白质太不稳定以致不能配制为一种药物,或者当模拟蛋白质运送的自然模式是很重要的(正像糖尿病的情况一样)时,胶囊包裹的细胞将同样是有价值的。
人的研究
用遗传方法操纵的细胞系在未来的生物杂种装置中可能起主要作用,但是长期以来一直在研究的涉及原始细胞的应用,已经进展到最有决定性意义的临床试验,由我们两位和许多同事开发的一个例子是在本文开始时描述的治疗慢性头疼。我们从高度受控环境下培养的犊牛的肾上腺中获得了作为疼痛植入物的细胞某些肾上腺组分——嗜铬细胞——自然释放一组止痛药。小心纯化大约3万个这种细胞后,我们将它们固定到一根两端密封的中空的纤维内,纤维则被连到一根系绳上并通过一个侵害性最低的程序植入脊柱内。
当我们在外科上的协作者在90年代中期证明,这样的植入物能够在患者身上起几个月的作用时,他们注意到了疼痛可能受到控制的迹象。几个患者报告了他们不舒服的感觉与吗啡用量显著减小。但是这些实验没有包括一个接受安慰剂(比方说,一个空胶囊)的对照组,所以我们不能肯定我们的试验是否是真正有反应的。大规模的临床试验现正在进行中,它包括100多个患者,并且特别设计成能够确定疼痛缓解的程度。这项实验是由林肯研究组的细胞治疗项目的Moses B. Goddard领导的。
不管结果如何,现有的数据证明,动物器官中的免疫隔离细胞能够在供试对象的中央神经系统中生活几个月,这些供试对象没有服用免疫抑制药物。可是没有胶囊包裹时,使过分地投入免疫抑制剂,任何从动物移植到人的器官都没有存活。
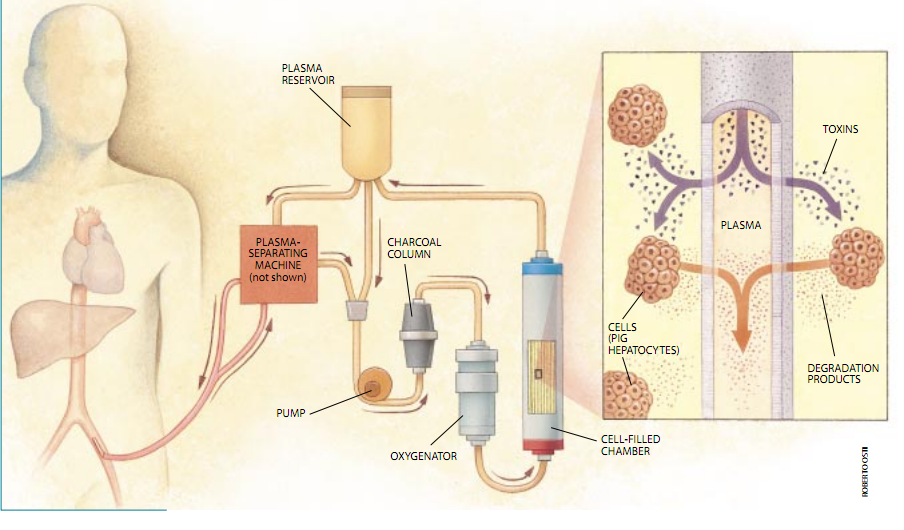
免疫隔离疗法中的第二个开发得很好的应用——肝支持装置——也依靠直接取自于动物的细胞在一个健康的肝中,称为肝细胞的细胞吸收毒素并将其分解为无毒的形式;当肝受到损害时,这样的毒素就能够积累到致死的水平。肝的移植物可以挽救患者,但是许多人在等待得到与他们的组织类型相匹配的供体器官的过程中死去了。正在研究中的生物杂种肝系统目的在于使患者能够活到找到供体。
这种“桥接于移植物”疗法使用一个床侧血管装世。来自患者的血被抽吸到一个密闭小室,在小室内一段半透水的运送血液的管被猪肝细胞的悬浮液所包围。这些肝细胞从流动的血液中吸收毒素并降解它们,结果是当它完成其循环时,比较健康的血液到人体内。与植入几毫克细胞并希望连续几个月或几年起作用的止痛移植物相比,一个肝装置可容纳20至200克纯化的肝细胞(约为一块汉堡包的肉的重量)并且一次只需要6至24小时。
在一项包括将近40个患有晚期肝损害患者的初始研究中,测试的设备正像预期的那样起作用。在1998年报导的发现为现正在美国与欧洲开始的大型对照试验铺平了道路。成功的可能性是相当高的。并且研究人员有理由相信在由于过量吸收醋氨酚引起的急性肝损害这样的特殊情况下,肝可再生,不需要移植。但是乐观情绪必然会被过去的经验所减弱。通往肝维持系统的途径是用人为干涉铺就的,它在初始试验中工作得很好,但是在大型试验中则大为逊色。
对于疼痛与肝的两种应用,科学家们必须注意下问题:来自未知的动物病毒的基因可能藏在取得的细胞内,并且这些基因可能在移植物受体中引起病毒与危险的传染病(严格的筛选方法可确保不传递已经知道的病原物)。幸运的是,塑料薄膜会对动物病毒的传播提供一个不可轻视的屏障,到目前为止还没有任何一个患者从供体细胞中得到了那怕是一种良性的传染病。即使这样,研究人员对这一问题既不是骄做自大也没有固步自封,而是继续密切地注意它。
虽然进展较小,但是应用基因疗法的人类试验也已经开始了。两个小型试验把中央神经系统失调作为目标,用遗传方法改变的胶囊包裹的细胞肌萎缩性脊髓侧索硬化(ALS)。ALS是一种控制肌肉的脊椎神经衰退为标志的神经退化症,它导致了棒球传奇人物Lou Gehrig的死亡。在1996年,6个患者接受了含有一个细胞系(从年幼的大田鼠肾细胞衍生而来的)的植入物,该细胞系接受了为睫衍生的神经营养因子(CNTF)A的蛋白质编码的基因。之所以选择这个基因,是因为在动物与人中的其它研究表明,这一因子可以延迟那些通常在ALS患者中死亡的神经元的衰退。这一方案很像是用于治疗慢性疼痛的方案:一个装有细胞的管子被移植到脊柱中。
该研究检查了是否在整个3个月的试验期间这些细胞都是存活的,并且,释放可能达到治疗数量的CNTF。这些细胞很好地起了作用,但是治疗似乎没有延迟病情的发展,虽然试验的受试对象太少与时间太短以致在记分上不是特别有价值的。然而,该试验表明如果找到了治疗ALS的适当基因或基因混合物,胶囊包裹的细胞就会起将它们释放到中央神经系统的一个良好工具的作用。
含有同一细胞系的移植物现正在患有亨廷顿舞蹈病的患者中被评估,这种病逐渐地杀死某些脑细胞。但是这次,这些胶囊已经被放进称为脑室的脑中充满液体的空间。正在巴黎进行这一基因治疗方案,并且才刚刚开始。一些评价用于实现基因治疗的免疫隔离法的动物试验也已经开始。有几个在本文前面的表中列出。
对糖尿病的特殊挑战
如果免疫隔离研究在许多地区进展很好,为什么在试验20多年后还没有一个人使胰岛细胞胶囊包裹的方法得以完善,用它来治疗糖尿病呢?
在1977年后,当Chek及其同事治疗了啮齿动物中的糖尿症时,在世界上至少有12个实验室重复了这一成就,其中包括针对啮齿动物的各种糖尿病型范围广泛的各种型式移植物。但是以胰岛为基础的免疫隔离疗法在如像狗,猴子与人类这样较大的物种中表现不好,最具建设性的结果来自单个病例。而且,严密的检查表明,报告取得成功的许多这类结果,都是仅仅借助于免疫抑制剂或注入一些数量的胰岛素而获得的。
许多困难源于大动物与人类需要的数量极大的胰岛:70万个左右,它们容纳着将近20亿个产生胰岛索的“B”细胞,这一数量比迄今成功地被胶囊包裹在临床移植物内的细胞数量多将近1000倍,只用大约500个胰岛就可治疗鼠的糖尿病,这些胰岛一般是技术人员用手工从供体胰腺中提取的。但是用手摘取70万个胰岛是办不到的,并且半自动技术不能够持续不断地分离所需要数量的健康胰岛。而且在天然的胰腺中,每个胰岛都有其自已的血液供应,在移植胶囊内严峻的环境中胰岛将受到损害。由于这些原因与其它原囡,我们同意得出下结论的人的意见:基于胶囊包襄胰岛的移植的半人工胰腺对于可预见的将来仍是一个达不到的目标。
但是,有一个新的建议正好可以打破僵局。至少有三个研究小组正在用各种各样的方法来开发根据同那些激发健康的胰腺分泌胰岛素的信号一样复杂的信号释放胰岛素的细胞系。这项计划能创造能比天然的B细胞产生更多的胰岛素(所以将需要较少的细胞),并且能在植入物的营养物贫乏和氧气枯竭的环境中存活的细胞。5年前也许认为创造这样的细胞是不可能的,但是最近在细胞与分子生物学中的进展已经是势不可挡的了。
我们希望看到从现在起的5年内(也许还要早得多)在大动物中试验对葡萄糖容易起反应的与分泌胰岛索的细胞系。我们期待着试验后这些细胞系将很快进展到临床应用阶段。一些专家认为这种预测太保守了;另一些专家则提出,要花更长的时间才能达到这一目标。但是每一个人都同意,人造胰腺或杂种类型必将继续列为21世纪医学的最优先考虑的课题之一。当这一工作继续进行时免疫隔离疗法的新用途也将会出现。的确,我们期望在今后的20年中,胶囊包裹的细胞疗法将会在治疗某些最难治疗的最使人衰弱的人类疾病方面从研究阶段走向起关键性作用的阶段。
【朱平/译;郭凯声/校】
请 登录 发表评论