1962 年,意大利帕维亚遗传学研究所的一位研究人员在无意中调高了果蝇(fruit fly)培养箱的温度。当年轻的遗传学家费鲁乔·里托萨(Ferruccio Ritossa)观察因高温而“休克”的果蝇细胞时,他惊讶地发现,染色体上某些区域竟变得蓬松了。这是个明显的信号:相应区域的基因被激活,开始合成蛋白质。于是,科学家把这类染色体区域叫做热休克基因座(heat shock loci)。
最初发现热休克现象时,科学家认为它只存在于果蝇体内,但15年后的另一个发现推翻了这一观点:在哺乳动物和其他生命体内,受到高温袭击的细胞也会激活一些基因,合成某类蛋白质。从此,“热休克蛋白”(heat shock protein, HSP)名声大噪,科学界也认识到,它对生命的存在有着极其重要的意义——这不仅反映在细胞水平上,还反映在生物体甚至整个种群水平上。
热休克蛋白是生物体内最古老的分子之一,它能经历漫长的进化过程而留存至今,本身就说明它对生物体必不可少。研究表明,热休克蛋白能促进生物进化:在恶劣环境中(不仅是高温),它能帮助每个细胞维持正常的生理活动。过去10年间,科学家发现,在人这样的高等生物中,热休克蛋白还发挥着其他功能,如帮助人体抵抗癌症、参与免疫应答等。在新药和疫苗的开发中,热休克蛋白也极具价值。
热休克蛋白为什么具有药物开发潜力?先来看看它发挥主要功能的方式。正常情况下,热休克蛋白都是作为其他蛋白的“伴侣”而存在,就像人类社会中的监护人一样。它主要从两个方面发挥作用:一是阻止影响细胞健康的蛋白间相互作用,二是促进利于健康的相互作用。这样一来,不同蛋白间就形成了稳定而有效的联系机制。
多能“分子伴侣”
细胞中,蛋白间的相互作用大多是“一一对应”的关系,就像一把钥匙只能打开与之匹配的锁。以受体为例,只有合适的分子与它结合,才能引起相应的细胞活动;如果这个分子与其他受体结合,或者其他分子与这个受体结合,都不能产生类似效果。但热休克蛋白不同,它能与很多蛋白分子结合,发挥多种生理功能:帮助氨基酸链折叠成正确的三维形状,清除受损而无法正确折叠的氨基酸链,护送蛋白分子寻找目标分子以免受到其他分子的干扰等。
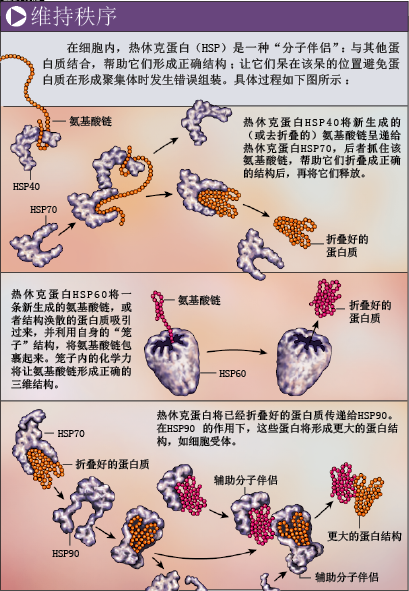
通过几个具体例子,我们就会知道热休克蛋白的功能对于生命有多么重要,也能了解它们如何作用于目标蛋白。一种蛋白质能否正常发挥功能,不仅取决于它能否在适当的时间到达适当的细胞部位,还要看它是否拥有正常的三维结构。新合成的氨基酸链会在各种外力的作用下折叠成正确的结构。氨基酸与水分子的相互作用,就是外力之一:疏水性氨基酸排斥水分子,因此它们一般隐藏于蛋白质内部;亲水性氨基酸则倾向于排列在蛋白质外部。不过,仅靠这种机制并不能保证氨基酸链形成正确结构,HSP60之类的热休克蛋白的参与就显得十分必要(参见第65页框图)。
目前,我们对HSP60的认识,主要来自于美国耶鲁大学亚瑟·L·霍里奇(Arthur L.Horwich)的研究。HSP60由多个单元组成,形状很像笼子。“笼子”有一个高度疏水的开口,对未折叠完成的蛋白质的疏水氨基酸具有很强的吸引力。但当疏水氨基酸进入“笼子”,接触到的却是HSP60的亲水氨基酸,于是被捕获的“半成品”蛋白质不得不改变结构,避免疏水和亲水氨基酸相遇。
在蛋白质拥有正确结构之前,上述过程可能多次发生。鉴于这样的作用,HSP60被看作是一种“折叠酶”(foldase)。与之对应的,是“去折叠酶”(unfoldase)HSP100——它的结构呈环状,也由多个单元组成,与HSP70共同作用时,能分解受损或多余的蛋白,甚至可以让一个完全折叠的蛋白质重新回到氨基酸链的状态。
实际上,大多数热休克蛋白的结构与笼状相去甚远,也不会将捕获的蛋白包裹起来,而是通过另一种方式捕捉目标蛋白。HSP70就是个典型例子,它会直接与目标蛋白上的一小段氨基酸结合。在HSP70的结构上,有一个结合短小氨基酸链的“裂口”,当它与能量分子ATP(三磷酸腺苷)结合时,裂口就会打开;没有ATP存在时,一个类似盖子的结构就会紧紧压住氨基酸链,把整个目标蛋白固定在裂口处。由于能够“抓住”多种氨基酸链,HSP70在很多基本细胞过程中都发挥着“伴侣”作用:帮助新生氨基酸链折叠成特定结构,促进蛋白质复合体的装配,防止蛋白质在高温下“散架”等。
在正常环境中,细胞中也有热休克蛋白存在,但只有在极端条件下,它对于生命的价值才能完全展现。面对高温、缺氧、脱水或饥饿时,一些关键蛋白会被分解,细胞即使努力合成新的蛋白质,也很难摆脱困境。此时,热休克蛋白不仅会保护对于基本生理过程不可或缺的蛋白,还会分解受损蛋白,回收合成蛋白的“原材料”,让细胞内的生理生化过程得以平稳运行。因此,当细胞受到很大的环境压力时,它的第一反应就是合成更多的热休克蛋白——这正是里托萨在46年前观察到的现象。
热休克蛋白被发现以来,它的上述功能一直是科学研究的焦点。但在20世纪80年代初,科学家又发现,对于高等生物的生存,这个古老蛋白的另一项功能同样至关重要。
破解谜题
20世纪80年代初,在印度海得拉巴细胞与分子生物学研究中心攻读硕士学位时,我对一个40年未解的生物学谜题产生了浓厚的兴趣。那时,科学家已经证明,小鼠可以对肿瘤组织产生免疫反应,就像人类的免疫系统抵抗细菌等外来病原体一样。细菌引起免疫反应的原因是它们是外来者,但是,小鼠体内的肿瘤是由它们自己的细胞组成的,为什么肿瘤细胞也能引起免疫反应?为了解开这个谜题,我开始分离肿瘤组织特有的抗原。
在攻读硕士研究生和博士后研究期间,我分离出一种名为gp96的蛋白质,它的确可以引发抗肿瘤免疫反应。令人惊讶的是,这种蛋白质竟是HSP90家族的成员(一些热休克蛋白的结构或功能仅有细微差别,因此叫做一个“家族”),在正常组织和肿瘤中都有它的身影。两年后,美国国立卫生研究院的斯蒂芬·J·乌尔里希(Stephen J. Ullirch)和同事也观察到了类似现象。进一步研究发现,不论来源于肿瘤还是正常组织,gp96的氨基酸序列都完全相同,换句话说,gp96并不是肿瘤细胞特有的。又一个问题出现了:既然gp96不是肿瘤特有的,为什么能诱发抗肿瘤免疫反应呢?
1990年,我们找到了问题的答案。在美国西奈山医学院,我和鹈殿平一郎(Heiichiro Udono,当时在我的实验室做博士后研究)从肿瘤中分离出了另一种热休克蛋白HSP70。经过检测,我们发现这种蛋白也能诱发抗肿瘤免疫反应。但出乎意料的是,当我们利用ATP亲和层析(一种蛋白质纯化设备,利用HSP与ATP结合的特性,让HSP与杂质分开),尽可能去除HSP70中的杂质时,HSP70诱发抗肿瘤免疫反应的能力竟然消失了。
我们立即意识到,与ATP接触会使HSP70丢失某种物质。后来的分析表明,丢失的物质是一些氨基酸链。几个研究小组的发现证实了我们的推测:当HSP70与ATP结合时,它的结构会发生改变,释放所有与它结合的氨基酸链。事实上,研究人员都很清楚,在通常情况下,HSP60、HSP70和HSP90家族的成员都携带着细胞产生的短小氨基酸链,而来自肿瘤组织或被病毒感染的细胞的HSP70和HSP90,几乎都携带了癌细胞和病原体产生的氨基酸链。因此,这些氨基酸链就代表了肿瘤或被感染细胞的特征抗原。
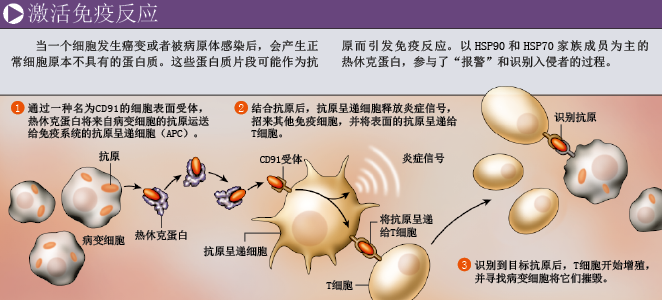
由于具有结合细胞特征抗原的能力,热休克蛋白在最基本的免疫反应过程中发挥着重要作用:帮助免疫系统识别癌变和被病毒感染的细胞。在细胞内,抗原一般会被降解成短小的氨基酸链,并与HSP60、HSP70和HSP90家族的成员结合。经过一系列复杂过程,这些氨基酸链会被传递给一种免疫蛋白——主要组织相容性复合体Ⅰ(major histocompatibiligy, MHCI),最后由MHCI把代表着特征抗原的氨基酸链呈递到细胞表面。T淋巴细胞只要识别到MHCI与氨基酸链的复合物,就会杀死任何携带有患病标志的细胞(参见第66页框图)。
当我们利用化学手段,使热休克蛋白失去活性,MHCI就不再与氨基酸链结合,T淋巴细胞也无法识别MHCI分子。1994年,我和同事提出假说:热休克蛋白与氨基酸链结合是一个必要步骤,否则MHCI就无法将氨基酸链呈递到细胞表面。我们的假说在随后的研究中得到了证实。
正是结合抗原氨基酸链的特性,让热休克蛋白能引发针对肿瘤或病原体的免疫反应。此外,通过与不同类型的抗原呈递细胞(antigen-presenting cell)发生相互作用,“热休克蛋白-氨基酸链”复合体也能帮助T细胞识别抗原。
发出警报
作为免疫系统的哨兵,抗原呈递细胞存在于机体的所有组织中。每遇到一种抗原物质,它就会及时“采样”,呈递给T细胞,由T细胞追踪、杀死癌变或被感染的细胞。
后来的研究证明,抗原呈递细胞表面存在一种受体,能识别结合了氨基酸链的热休克蛋白。率先发现这类受体的是罗伯特·J·宾德(Robert J. Binder),当时他还是我的一位研究生,现任教于美国匹兹堡大学。当抗原呈递细胞遇到“热休克蛋白-氨基酸链”复合体时,就会通过受体吞掉复合体,然后将氨基酸链呈递给T细胞。紧接着,T细胞开始增殖,并攻击癌细胞或者病原体。这种机制可以解释,为什么来源于癌细胞的热休克蛋白可以引起抗癌免疫反应,而从正常组织中分离出来的热休克蛋白却不具备这样的能力。
除了向免疫系统报告“入侵者”的特征,热休克蛋白似乎还有发出警报的功能。我和美国康涅狄格大学医学院的斯雷亚希·巴苏(Sreyashi Basu)的研究都表明,只要触到HSP70或HSP90家族的成员,抗原呈递细胞就会发生一系列变化,比如发出信号,引起炎症反应(炎症反应正是高强度免疫防御的一部分)。尽管热休克蛋白通常在细胞内部发挥功能,但科学家注意到,当哺乳动物的细胞受到较大的环境压力,少数热休克蛋白就会钻出细胞,或者出现在细胞表面。由于热休克蛋白很容易激活抗原呈递细胞,它的这种异常表现很可能是警告免疫系统:危险即将到来。
每位病人的肿瘤内一般都存在特异性抗原,因此,从肿瘤中分离出的“热休克蛋白-氨基酸链”复合体可以用作抗肿瘤疫苗。我已经在开展这方面的研究工作:从癌症患者体内提取“热休克蛋白-氨基酸链”复合体,经过纯化后,作为疫苗重新注入患者体内。这类疫苗会刺激患者的免疫系统,攻击携带有特异抗原的癌细胞。在美国和欧洲,疫苗的有效性已经通过早期临床试验的检验,进一步试验正在更大的范围内进行(包括美国、欧洲、澳大利亚和俄罗斯),试验对象是黑色素瘤和肾癌患者。最新结果表明,注射了足够剂量的疫苗后,黑色素瘤患者的寿命明显长于接受传统疗法(如化疗)的患者。在肾癌患者中,疫苗将无肿瘤复发时间延长了一年半。
俄罗斯政府已批准这类癌症疫苗进入临床应用。近期,我们还会向欧洲提交上市申请材料。在美国的上市时间会长一些,因为我们要对一些病人进行长期随访,以获得更多的观察数据。上述制备疫苗的技术似乎还能治疗严重的传染性疾病,如生殖器疱疹(genital herpes)、肺结核(tuberculosis)等,相关研究正在进行。
广泛的作用
制备疫苗并非利用热休克蛋白治疗疾病的唯一方式。美国华盛顿大学的苏珊妮·L·卢瑟福(Suzanne L. Rutherford)和马萨诸塞州剑桥市怀特海德生物医学研究所的苏珊·L·林德奎斯特(Susan L. Lindquist)的研究表明,热休克蛋白能以极高的工作效率,缓解极端条件对细胞造成的损伤。在实验中,当果蝇HSP90蛋白的活性被抑制时,一些遗传突变就会发挥作用,这就表明HSP90对有害突变具有抑制作用。卢瑟福和林德奎斯特认为,生物体内原本存在大量遗传突变,只是因为热休克蛋白的抑制作用,这些突变才未能发挥作用,但这也促进了遗传突变的累积。一旦热休克蛋白的抑制作用减弱,遗传突变的作用就会表现出来,并接受“自然选择”的洗礼。从这个角度来说,累积遗传突变,促进生物进化,也是热休克蛋白的功能之一。
林德奎斯特还提出了更多的证据,证明热休克蛋白的确促进了生物性状的快速进化。真菌进化出耐药性就与热休克蛋白有关,因此,抑制这种蛋白活性的药物有望成为新一代抗生素。另外,热休克蛋白可以抑制遗传突变,但有些可以限制肿瘤生长的突变也被抑制了。HSP90影响着细胞内的信号传导途径,它丧失功能后,癌细胞对外界环境更为敏感,也更容易被化疗杀死。目前,专门针对HSP90的抑制剂已和化疗药物一起,用于抗癌临床试验。
测试“热休克蛋白-氨基酸链”复合体在肿瘤免疫疗法中的功效时,我和康涅狄格大学健康中心的拉吉夫·昌达沃卡(Rajiv Chandawarkar)发现,如果用极高剂量的热休克蛋白来引发免疫反应,不但不能引发强烈的免疫反应,还会抑制免疫反应!在小鼠实验中,我们观察到,高剂量的热休克蛋白可以缓解Ⅰ型糖尿病和脑膜炎的病情(两种疾病均属于自身免疫疾病)。经过长时间研究,以色列雷霍沃特市魏兹曼科学研究院的艾朗·R·科恩(Irun R.Cohen)证明,热休克蛋白HSP60是一种自身抗原,会引发自身免疫反应,攻击胰岛素生成细胞。他们在临床试验中发现,抑制HSP60 的活性能在一定程度上缓解Ⅰ型糖尿病,相关疗法的人体实验已经开展。
拥有多种功能的热休克蛋白已成为治疗多种疾病的目标分子,但它在人体内广泛存在的特性,却是一柄双刃剑:改变热休克蛋白含量的药物,也可能伤害到正常组织。然而,在药物研发史上,科学家在控制关键蛋白质活性的同时,又消除了毒副作用的例子并不少见——我们相信,热休克蛋白不会成为例外。
自从生命诞生,这些古老的蛋白质分子就存在于生物体内,并在生命的延续中扮演必不可少的角色:在适当的时候促进蛋白质合成,或降解受损蛋白;在恶劣的环境中,保护脆弱的蛋白分子免遭破坏;抑制遗传突变引起的生理变化,以免出现毁灭性后果。现在,即便知道热休克蛋白还参与了免疫反应,我们也不能就此认为,已经完全了解了热休克蛋白。随着我们对生命有了更深的认识,这类古老的蛋白分子或许会给我们更多的惊喜。
请 登录 发表评论