科学家发现HIV是艾滋病的病原体之后不久,时任美国卫生及公共事务部部长的玛格丽特·赫克勒(Margaret Heckler)自豪地告诉兴奋的记者,这一发现将有助于研发预防艾滋病的疫苗:“我们希望在两年内开发出一种疫苗,进入临床试验。”赫克勒发出这番豪言壮语的时间,是1984年。
尽管政府官员犯错并不罕见,但这样的情况很少在科学界出现。很不幸,此后的事实证明,赫克勒犯了个大错。尽管距发现HIV已有25年,但我们仍未找到有效的疫苗。2007年,美国默克公司研制出一种候选疫苗,但该疫苗不仅不能正常发挥作用,反而可能对人体有害,正在进行的临床试验被迫终止。2008年夏季,另一种背负无数人希望的疫苗也被束之高阁,临床试验甚至还未开始就被取消,因为科学家实在找不到理由,让自己相信这种疫苗会比默克公司的更好。
过去25年,为了研制艾滋病疫苗,我们拼尽全力。然而,回过头来仔细看看以往的研究过程,一切似乎都很混乱。我们意识到,如果没有一种传统方法能够研制出对抗HIV的疫苗,我们就需要一些创新——要么是找出一些现在连想都没有想到的不寻常的创造性方法,要么是对HIV本身有一些全新认识,找出它们的致命弱点。看来,我们必须重回“起点”。不过,这并不意味着过去25年的研究没有任何价值。实际上,每次失败都能反映HIV的抵抗策略,为我们提供新的研究思路。带着从一次次失败中得到的经验教训,科学家将向HIV发起又一次进攻,揭开疫苗研究中的一些未解之谜。
狡猾的HIV
要知道如何研制HIV疫苗,首先得了解疫苗怎样发挥功能。
目前,世界上有数种生产疫苗的方法。但不管方法如何,疫苗的有效性都取决于人体自身的天然免疫反应。制药厂商生产的流感疫苗,其实就是灭活的流感病毒(即杀死病毒,使它们失去致病性)。将灭活病毒注射到手臂后,皮肤深层的免疫细胞就会识别外来病毒蛋白,并在几周时间内,使机体产生针对此类病毒的小分子抗体。在流感季节,如果同类病毒再次进入人体,抗体就会与病毒结合,“中和”病毒,阻止它们感染宿主细胞。
1962年,美国科学家阿尔伯特·沙宾(Albert Sabin)通过降低或去除脊髓灰质炎病毒(polioviruses)的致病性,成功研制出预防小儿麻痹症的疫苗。由于未被灭活,低毒脊髓灰质炎病毒仍能在一定程度上感染健康细胞,因此这种疫苗不仅能诱导机体产生抗体,而且还会刺激T淋巴细胞(T lymphocyte),引发细胞免疫反应(cellular immune response)。如果接种疫苗的人受到脊髓灰质炎病毒感染,T细胞将迅速作出反应,消灭任何被病毒感染且成功躲避抗体攻击的宿主细胞。
上述两个例子,就是疫苗的基本作用原理。过去50年里,疫苗已成为抵御传染性疾病的中流砥柱。然而,这种诱导抗体和细胞免疫反应的经典方法,却对HIV束手无策。从本质上说,所有疫苗都模仿天然感染的模式,使免疫系统产生“记忆”效应,以便在真正受到感染时能积极迅速地应对。但是,HIV似乎总能逃避免疫攻击,或使天然免疫系统失效。
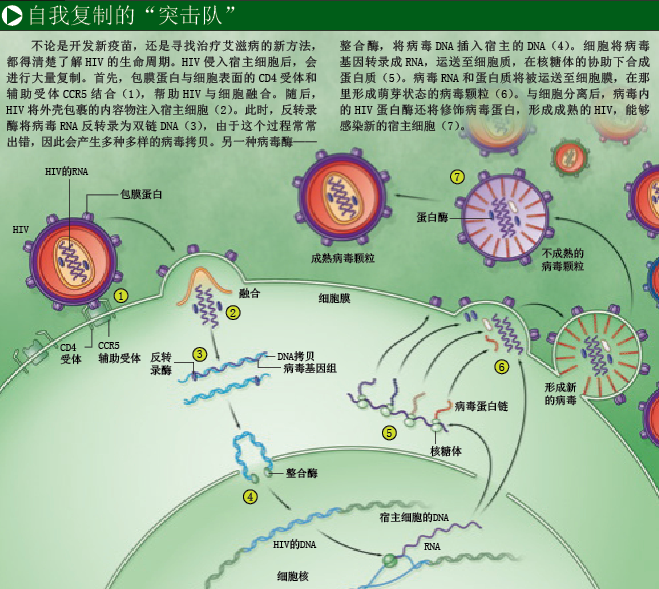
HIV第一次感染新的宿主时,会在宿主细胞中复制,产生新病毒侵入更多的细胞(见右图)。由于病毒复制非常迅速,有的人在被感染一个月后,每毫升血浆内就可检测到1亿个HIV病毒颗粒。通常,作为免疫防御的第一道防线,天然免疫系统不具备特异性(即不会只针对某一种病原体),构成这道防线的细胞会在人体内不断巡逻,发现并抵御入侵者。其中一些细胞只要遇到被病毒感染的细胞,就会将它们摧毁;但大多数人的天然免疫还来不及发挥作用,就被大量复制的HIV制服了(参见本期第18页《HIV如何击溃免疫系统》)。当然,天然免疫细胞也会吞噬一些病毒蛋白,呈递给特异性更高的免疫细胞,引发更强烈的免疫反应。
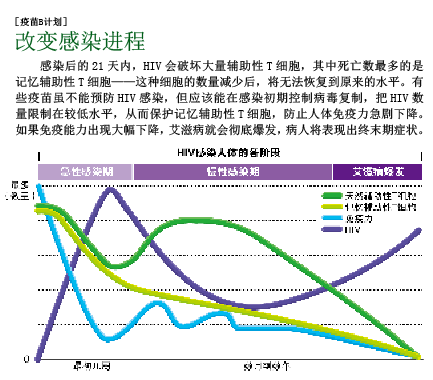
特异性免疫细胞就包括前面提到的T细胞,它有两个重要类型:“辅助性”T细胞和“杀伤性”T细胞。辅助性T细胞的主要作用是发出警报,引发细胞免疫反应并指挥免疫系统的攻击行为。抗原呈递细胞利用一种名叫MHC(主要组织相容性复合物)的分子,向辅助性和杀伤性T细胞呈递抗原片段;T细胞则通过自身受体,识别抗原与MHC组成的复合物。一旦杀伤性T细胞对入侵者有了“印象”,并接收到辅助性T细胞传来的化学信号,就会增殖并追杀入侵者。杀伤性T细胞的杀伤效力大概会持续3周,人体内大部分感染病毒的细胞都会被摧毁,病毒总数将明显减少。不过,由于整个杀伤过程启动较晚,且力度不够,艾滋病将进入慢性感染阶段。
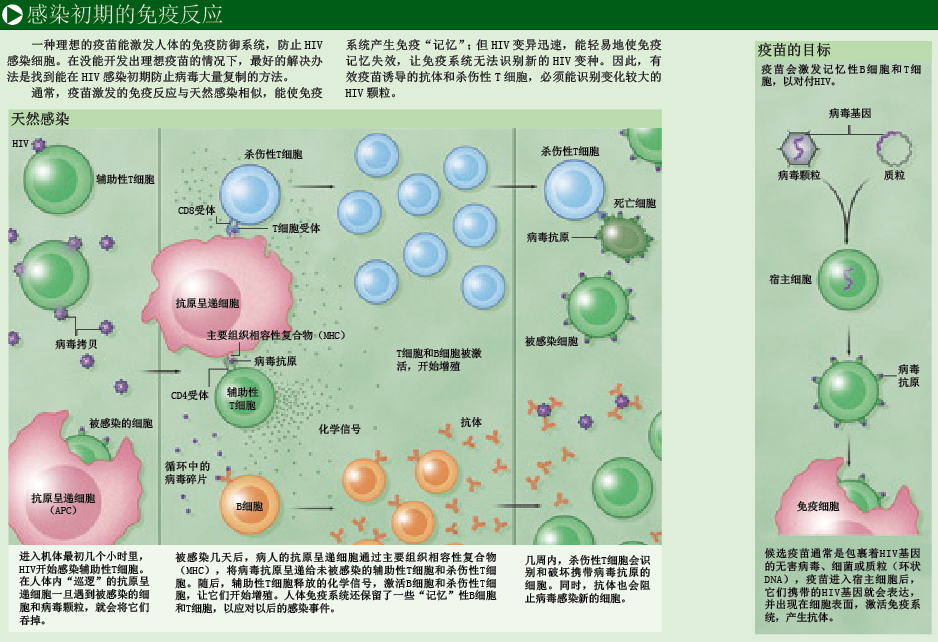
在对抗病原体的战役中,辅助性T细胞可能是最重要的指挥官,因为它能让其他免疫细胞在合适的地方发挥杀伤作用。不幸的是,战役刚一开始,HIV就将辅助性T细胞作为攻击目标,在它们“体内”不断复制,最终杀死“免疫指挥官”。尤其是在HIV进入记忆辅助性T细胞后,将给免疫系统造成毁灭性打击——记忆辅助性T细胞的作用,是记住免疫系统曾遇到过哪些病原体。在人体受到感染的最初几周,大量记忆辅助性T细胞死于HIV的攻击,整个免疫系统的指挥和控制系统瘫痪,永远也无法完全恢复。
与此同时,HIV很好地躲过了杀伤性T细胞的攻击。进入细胞后,HIV的遗传物质RNA反转录为DNA时很容易出错(细胞以DNA为模板合成RNA叫做转录,反过来的过程叫做反转录),经常产生突变,这些突变在HIV的复制过程中不断积累。此外,如果两种病毒感染同一细胞,它们还可以互换遗传物质(重组),产生新的变种。
随着病毒多样性增加,具有原始病毒记忆的免疫细胞便无法识别新型病毒蛋白。这样一来,杀伤性T细胞就只能摧毁具有可识别抗原的细胞,而对携带突变病毒蛋白的细胞“视而不见”。由于同样的原因,人体感染HIV 3~4周后,对于免疫系统产生的抗体来说,很多病毒颗粒都无法识别了。
免疫防御系统无法识别变异HIV,这可能是让科学家最为头痛的问题,因为这意味着疫苗诱导机体产生的抗体也同样不能识别HIV变种。即使一种疫苗能诱发强烈的免疫记忆效应,很好地预防某种HIV感染,但对于后来进入人体或产生突变的病毒,也不能产生任何预防效果。
HIV变异究竟给疫苗研发带来了多大困难?以下事实将告诉你答案。每年,科学家都要改进流感疫苗,因为流感病毒在世界范围内传播时会不断进化,外壳蛋白稍微改变,就足以使一年前的抗体无法识别和预防它们。HIV的变异更为迅速,一个人感染6年后,他体内的HIV表面蛋白多样性,可能要比全世界一年内所有人类流感病毒的多样性还要高。因此,要成功预防艾滋病,科学家研制的疫苗不能只针对某一种HIV,而要针对数万种病毒。
转变方向
阻止HIV肆虐的最好办法,是研制能完全预防感染的疫苗,提供“消除性免疫”(sterilizing immunity)。不过,要实现这一目标,这种疫苗至少要能诱导机体产生可识别所有HIV、并阻止它们进入细胞的中和抗体(neutralizing antibody)(这种抗体的作用是与血液里的病毒颗粒结合,阻止病毒感染细胞,破坏病毒颗粒,相当于把病毒“中和”掉了)。
科学家发现,HIV必须与细胞表面的CD4受体和辅助受体CCR5结合,才能进入辅助性T细胞,因此“阻止HIV与这些受体结合”成了疫苗研究的一个主要目标。研究中,科学家注意到一种特殊的糖蛋白:它们位于HIV的外壳上,必须先与CD4受体和CCR5受体发生联系,HIV才能进入宿主细胞。可惜的是,这种糖蛋白是HIV包膜(envelope)的主要成分,而在HIV的所有组成部件中,包膜蛋白最容易发生变异。
AIDSVAX是首批进入人体试验阶段的艾滋病疫苗,它能诱导机体产生包膜抗体。相关人体试验从1998年开始,为期5年。然而在众多科学家看来,这是一个失败的产品——它并不能阻止HIV进入 CD4 + T细胞(带有CD4受体),因此不能帮助人们抵御HIV感染。
迄今为止,还没有一种进入人体试验阶段的艾滋病疫苗,可以诱导出足够强大的中和抗体,能够阻止所有HIV进入细胞。诱导出“全能中和抗体”似乎是艾滋病疫苗研究无法完成的任务,因此科学家开始研制一种虽不能预防感染,却能降低发病率和HIV传染性的疫苗。
这种疫苗的作用方式是激发杀伤性T细胞,清除感染细胞,使病毒数量保持在较低水平,防止病毒数量在感染初期猛增。在急性感染期抑制HIV的复制,不仅可以保护辅助性T细胞,还可以降低病毒传播的风险。经过观察,科学家发现在感染初期,病毒经过大量复制后,艾滋病人体内的HIV数量大约为每毫升血浆30,000个,传染性很高;但如果把病毒数量减少到每毫升血浆1,700个,病人把HIV传染给他人的几率就大幅降低。从这个意义上来说,在能诱导消除性免疫的疫苗出现之前,研制出将病人体内的HIV数量减少到每毫升血浆1,700个以下的疫苗,或许是最好的选择。
上述想法得到了很多研究的支持[包括HIV和SIV(猴免疫缺陷病毒)的相关研究],科学家也发现,对于控制HIV数量,杀伤性T细胞确实非常重要。不管是人类还是猴子,都存在一些罕见病例:在既没疫苗也没药物的情况下,一些人和猴子的机体本身就能控制免疫缺陷病毒的复制。这些人(猴子)编码MHC分子的基因大多发生过特殊变异,变异后的MHC分子会诱使T 细胞对外源抗原作出反应。
这些发现为研制T细胞诱导型疫苗提供了合理的证据。最近,此类疫苗中的一种已进入试验阶段,研究人员对它抱有很大的希望。研制这种疫苗的默克公司为艾滋病疫苗研究投入了大量资金,试验了很多诱导杀伤性T细胞的方法。最终,该公司用5型腺病毒(adenovirus type 5,缩写为Ad5,一种普通感冒病毒)作为载体,携带3种HIV基因进入人体细胞——研究人员希望,含HIV基因的细胞能合成病毒蛋白,让免疫系统误认为机体感染了HIV,并作出保护性反应。这3种HIV基因分别编码Gag、Pol和Nef蛋白——这些蛋白相对保守,即便HIV发生变异,它们也不会产生太大的变化。
不幸的是,研究人员寄予厚望的疫苗试验再次失败。平均来看,自愿者注射疫苗后只激发了较弱的T细胞反应——只有10%~20%的HIV感染者,免疫系统能够控制病毒复制。此外,病人的免疫系统只能对病毒蛋白的3个位点作出特异性反应。相比之下,能够控制病毒复制的HIV感染者仅对Gag这一种蛋白,通常就有3~6种特异性反应。
默克公司的疫苗无法抑制HIV复制,问题可能出在Ad5载体身上,也可能出在它所携带的HIV基因身上,又或者两者都有问题。很多人(不只是艾滋病人)都感染过Ad5这种常见的感冒病毒,在注射疫苗前可能就产生了针对该病毒的抗体。因此,在相应抗体的作用下,Ad5载体的数量受到严格限制,很难感染足够多的目标细胞,疫苗效果大打折扣。同样,在疫苗引发免疫反应的初期,占据主导地位的很可能是针对Ad5的杀伤性T细胞,而不是HIV杀伤性T细胞。最后,研究人员选择的3种HIV基因可能还不足以控制病毒。
Ad5疫苗只能产生少量HIV蛋白,与此不同的是,活的减毒SIV疫苗几乎能产生所有病毒蛋白(除了部分Nef蛋白)。这种活体病毒类似于脊髓灰质炎疫苗,也可以在猴子体内复制。虽然它的致病性比天然SIV低很多,但足以保护猴子不受各种SIV的感染——包括那些与疫苗病毒明显不同的SIV。甚至当研究人员用发生过明显变异的SIV攻击猴子的免疫系统时,活体病毒疫苗仍能提供有效保护。活体病毒疫苗这种强大的保护能力,让科学家对活体HIV疫苗产生了浓厚兴趣。不过研究表明,在猴子体内,减毒活体SIV疫苗能自我恢复,最终产生功能完整的SIV病毒,感染并杀死猴子。这类疫苗还可能与其他入侵病毒重组,产生新的致命性病毒。出于安全考虑,活体减毒HIV不可能作为人体疫苗使用。
疫苗何时现身?
对于艾滋病疫苗研究者而言,“默克疫苗”的失败无疑是一次沉重打击,我们开始怀疑能否研制出有效艾滋病疫苗,并对现在的候选疫苗进行了反思。目前,在泰国进行的一项艾滋病疫苗人体试验,是唯一一项正在进行的大型艾滋病疫苗试验,这个试验将于今年底结束。在此后数年,科学家将不会再开展此类试验。今年上半年,美国国立卫生研究院曾研制出一种DNA质粒疫苗,相关大型人体试验原本定于今年秋季开始,但在7月,美国国家过敏和传染病研究所主任安东尼·S·福奇(Anthony S. Fauci)取消了试验,因为他认为还没足够的证据表明该疫苗可以进入人体试验阶段。
福奇同时还宣布,美国国家过敏和传染病研究所将调整研究经费的分配比例:原来准备用于艾滋病疫苗研究的经费将投入与HIV相关的基础研究,以弄清这种狡猾病毒在人体内的各种行为,为疫苗和疗法研究提供新的思路。要研制新一代改进型候选疫苗,科学家首先得解决一系列重要问题。
HIV的多样性仍是疫苗诱导抗体或杀伤性T细胞反应的最大障碍,而在感染初期,抗体或杀伤性T细胞却是人体抵御感染的主力军。由于每个感染者体内的病毒都可能发生基因突变和重组,因此一种疫苗所要对抗的HIV,与制造这种疫苗所用的病毒相比,至少有10%以上的差别。举例来说,根据编码HIV包膜蛋白的env基因的变异情况,科学家将HIV划分成不同的几个大类(称为M、N和O型),然后进一步分为更多的亚型(即进化分支)。通过分析包膜蛋白的氨基酸序列,科学家发现在HIV的不同进化分支间,差异竟高达35%;即使是同一个进化分支内的HIV,包膜蛋白的氨基酸序列差异也能达到20%。
出于这个原因,很多科学家在设计艾滋病疫苗时,已不再使用包膜蛋白来诱导细胞免疫反应,而是用更保守的Pol和Gag蛋白。然而,即使这些蛋白只会发生很小的变化,仍可能严重影响疫苗的免疫效果:只要有一个氨基酸发生变化,疫苗诱导抗体或杀伤性T细胞的效力就会遭到削弱甚至消失。因此,弄清楚如何诱导出对大部分HIV都有效的中和抗体,仍是艾滋病疫苗研究领域最重要的目标。
在天然感染中,HIV会在宿主体内激发杀伤性T细胞,与此有关的一个问题是:我们研制的疫苗应该激发所有杀伤性T细胞,还是应该只针对某些细胞?杀伤性T细胞会针对HIV的不同部位作出反应,而具体针对哪个部位,则取决于这些部位上病毒蛋白的氨基酸序列——很多时候,一些病毒区域诱发免疫反应的频率要比其他区域高得多。另外,不同的杀伤性T细胞功能也有不同,有些T细胞明显能更为有效地控制HIV复制。最近,科学家在实验室里,首次从大量细胞免疫反应中,发现了能真正控制HIV复制的反应。如果我们能证实,在天然感染初期这些反应也能有效控制HIV复制,那么研究艾滋病疫苗的思路或将发生重大转变:激发相关杀伤性T细胞,提高它们对HIV的反应频率。
世界上有少数人(猴子)对HIV(SIV)具有天然抵抗力,就好像他们曾注射过艾滋病疫苗,提前激活了相关杀伤性T细胞。弄清楚他们的免疫系统如何控制HIV的复制,将有助于我们研制疫苗。这些人感染HIV后,免疫系统对病毒的抑制发生在急性感染期 (即感染HIV后的2~4周)即将结束时,因此研究这个过渡阶段或许能找到一些控制HIV复制的线索。我们已经知道,这些人中有一些发生过遗传变异,导致杀伤性T细胞数量增加、功能增强,或者细胞表面的受体发生改变,让HIV难以结合CCR5 辅助受体。目前,科学家正在对上述“特殊人群”进行遗传学、免疫学及病毒学分析,希望能找到阻止病毒复制的线索。任何一项新发现,都可能促进疫苗研究。
进一步研究活体减毒SIV疫苗也很有价值,因为这些疫苗能在相当长的时间内,帮助猴子抵御高致病性SIV,哪怕入侵病毒与疫苗病毒存在显著差异。虽然由于安全问题,减毒HIV疫苗不会应用于人类,但了解减毒病毒为何能如此有效,也许会让科学家产生新的想法。
我们采用的协作研究模式也将让疫苗研究受益。目前,不同的研究小组已经结合成一个大团体,共同解决研究中遇到的难题,美国比尔&梅琳达·盖茨基金会、国际艾滋病疫苗行动组织和美国国家卫生研究院也为研究提供了充足的经费。全球科学家团结起来,共同研究,将比以前拥有更多的机会研制出有效的艾滋病疫苗。
虽然失败多次,但我们决不会放弃疫苗研究。HIV发现之初,或许谁都没想到这种病毒会如此顽固,能够抵抗传统的疫苗技术。不过科学家也有很坚强的毅力,总有一天,我们会找到一种对付HIV的方法。
请 登录 发表评论