虽然与癌症、艾滋病、败血症、类风湿并列全球五大绝症,但渐冻症的名气要比其他四种“逊色”不少,而它拗口的学名——肌萎性脊髓侧索硬化症(amyotrophic lateral sclerosis,简称ALS)更是鲜为人知。不过,在美国,肌萎性脊髓侧索硬化症有一个家喻户晓的别名:卢·格里格病。上世纪30年代,纽约扬基棒球队的卢·格里格(Lou Gehrig)是美国最优秀的棒球运动员之一, 1939年,他不幸患上了一种进行性神经性肌肉萎缩症——从大脑到脊髓,再到全身肌肉,神经细胞相继病变甚至死亡。医生竭尽全力,仍没能阻止病情恶化,格里格在两年后就去世了。这件事引起了很大的轰动,人们把格里格患的疾病叫做卢·格里格病(Lou Gehrig’s disease)。这种病的典型症状是,在疾病晚期,运动神经元全部死亡,大脑无法控制肌肉运动,病人完全瘫痪。
1869年,法国医生让-马丁·沙尔科(Jean-Martin Charcot)首次确诊了渐冻症。在当时的医生看来,这是一种非常罕见的疾病。但在今天,渐冻症早已不算罕见:美国和英国分别有30,000和5,000名患者,中国更是有6万左右。40~70岁的人是渐冻症的高危人群,其他年龄段的人患病率稍低一些。
不少声名显赫的人都有成为“渐冻人”的痛苦经历:英国著名演员戴维·尼文(David Niven)、俄罗斯作曲家德米特里·肖斯塔科维奇(Dmitri Shostakovich),而著名物理学家霍金至今仍被渐冻症困在轮椅上。科学家发现,渐冻症似乎“偏爱”一些特殊人群,比如意大利足球运动员、参加过海湾战争的士兵和关岛居民,原因却无人知晓。
格里格生前最后一次来到扬基队的体育场时,曾哀伤地说:“身患肌萎性脊髓侧索硬化症,是我一生中最大的不幸。”的确如此,几乎所有这类患者都会在发病后的3~5年里去世(霍金是个例外,这位剑桥大学的物理学家患渐冻症已有40年时间,尽管全身瘫痪,他依然为宇宙学和量子力学做出了不少贡献)。虽然至今仍没有有效的治疗方案问世,但过去几年,科学家基本上弄清楚了运动神经元死亡的原因,也许用不了多久,渐冻症就将从五大绝症的名单中消失。
灾难性疾病
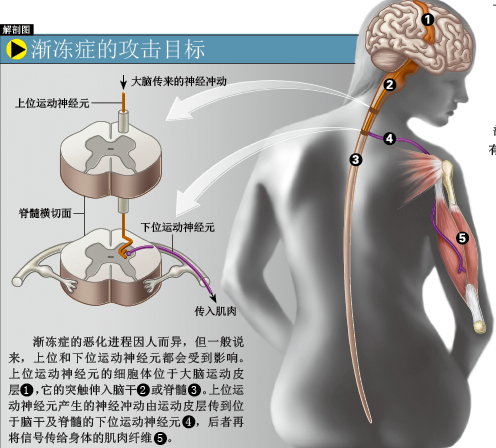
从英文名——Amyotrophic Lateral Sclerosis,就能知道渐冻症的主要症状:“Amyotrophic”是希腊语的合成词:“a”代表“负面、缺乏”的意思,“myo”意即肌肉,“trophic”是指营养,“Amyotrophic”的意思就是因为缺乏营养,肌肉萎缩,“Lateral”的本意是侧面、侧部,这里指代脊髓侧索,随着病情恶化,大量神经元死亡,该部位就会逐渐变硬(“Sclerosis”就是变硬的意思)。渐冻症最可怕的一面,并不是疾病本身,而是在病情恶化过程中,大脑功能不受丝毫影响,病人不得不清醒体验身体瘫痪的全过程。
渐冻症主要有两种类型,最常见的是偶发性渐冻症。这类疾病的发生没有规律可言,任何地方的任何人都可能成为受害者;另一种就是家族性渐冻症,这类疾病有明显的遗传性。不过在所有渐冻症患者中,家族性渐冻症患者只占5%~10%。发病初期,症状因人而异,但主要有以下几种:拿不稳东西、经常摔倒、四肢易疲劳、说话困难和肌肉痉挛。随着时间推移,病人的日常活动会受到严重影响:行走困难,连穿衣服也需要家人协助。当全身肌肉都开始硬化,连一些最基本的生存行为——吞咽、咀嚼、呼吸,病人都无法完成,只能依靠人工设备延续生命。
渐冻症只会损害运动神经元,病人的视觉、触觉、听觉、味觉和嗅觉都不受影响。奇怪的是,支配眼肌和膀胱肌的运动神经元受到的影响似乎也很小。霍金至今还能支配眼部肌肉,有一段时间,他靠眉毛来和外界交流(助手指向卡片上的单词,霍金扬眉确认。他的右手还有两根手指能动,现在他利用手柄控制语音合成器来发声)。迄今为止,美国食品及药品管理局(FDA)仅批准过一种治疗渐冻症的药物——利鲁唑(riluzole),它的主要机理是抑制人体释放对运动神经元有害的物质,延长病人几个月的生命。
是什么导致了渐冻症?科学家给出了多种备选答案:感染性物质、免疫缺陷、遗传、有毒物质、机体化学物质失衡和营养不良等。虽然这些因素可以导致渐冻症,但它们并非主要致病原因,不具代表性。渐冻症的真正病因像谜一样困扰着科学家,直到1993年,才找到了突破口。一位美国遗传学家和临床医生协会发现,有一个基因与一种遗传性渐冻症密切相关,患这种渐冻症的病人约占所有渐冻症病人的2%。这个基因能编码超氧化物歧化酶(superoxide dismutase 1,SOD1),保护细胞免受自由基(free radical,机体正常代谢过程产生的高能分子)的攻击。
随后,科学家又发现了100多种能导致渐冻症的SOD1突变基因,但还没来及高兴,另一个难题接踵而至:SOD1分布广泛,它们肯定发生了非常特殊的改变,才会针对性地破坏神经系统中某一类细胞,但突变究竟使SOD1发生了哪些改变?最初,科学家认为突变SOD1致病,是因为它们丧失了对抗自由基的能力。现在却有证据表明,突变基因编码的SOD1还具有破坏功能。科学家将SOD1突变基因“插入”实验动物的基因组,建立了渐冻症的动物模型。有了动物模型,就可以仔细观察整个发病过程,大大促进了对渐冻症的研究。一些与渐冻症无关,但会对运动神经元造成损伤的基因也被用于建立动物模型。利用这些动物模型,科学家就可以一一验证有关渐冻症成因的假说。
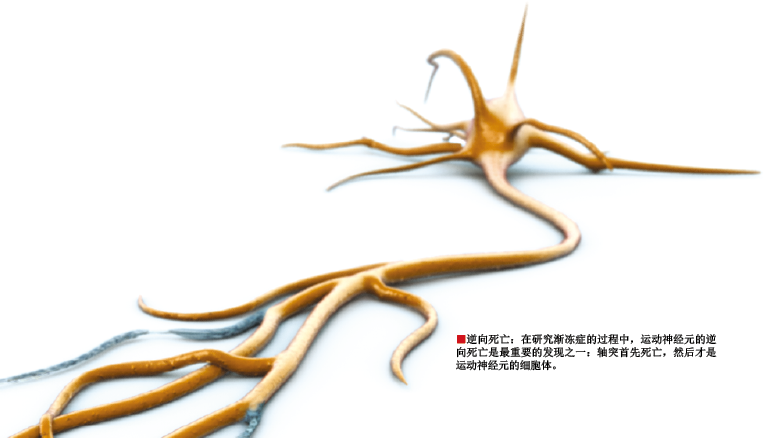
我们开始认识到,运动神经元的死亡机制不同于其他细胞。从运动神经元伸出的主要分支——轴突(axon)通常很长,高个子的运动神经元轴突可长达1米(见下图)。轴突末端又有几个分支,分支的顶端像钉耙的齿一样牢牢“钉”在肌肉上。神经与肌肉的连接处叫做突触(synapse),通过在突触间隙释放神经递质(信号分子),神经可以刺激肌肉收缩。
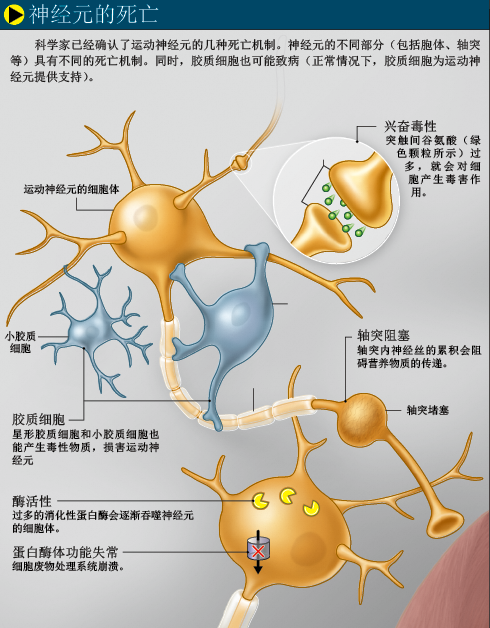
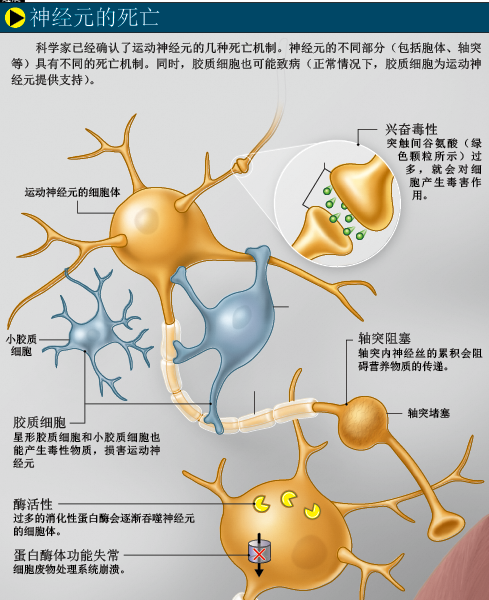
多年来,科学家一直认为运动神经元的各个部分会同时死亡,但实际上,细胞的不同部分有不同的死亡机制。因为含有细胞核,神经元的细胞体通常为程序性死亡(就像启动了一个自杀程序):细胞先把自己分解成碎片,再把碎片装进一个膜囊,这些膜囊最后会被巨噬细胞等免疫细胞清除。轴突则有另一种死亡机制——从突触开始死亡。如果神经元从轴突末端开始死亡,称为“逆向死亡”;如果神经细胞先死亡,则叫做“顺向死亡”。越来越多的证据显示,运动神经元的死亡方式是“逆向死亡”,因此,科学家开始寻找不仅能保护运动神经元(细胞体),还能保护轴突的药物。
神经元的死因
在渐冻症病人体内,某些运动神经元更容易受到疾病侵害,对于其中的原因,科学家才刚刚有所了解。瑞士巴塞尔弗里德里希·米歇尔研究所(Friedrich Miescher Institute)的比科·卡罗尼(Pico Caroni)和同事,就在研究这一问题。他们利用遗传学方法,在小鼠的部分运动神经元的轴突上加入了荧光标记。与四肢肌肉相连的神经元分三种类型:第一类支配快缩易疲劳(fast-twitch and fast-fatigable,FF)肌纤维,这类肌纤维主要负责四肢的快速、高耗能运动;第二类支配快缩耐疲劳(fast-twitch and fatigue-resistant,FR)肌纤维,FR肌纤维主要位于四肢的小肌群中;第三种支配慢缩(slow-twitch,S)肌纤维,S肌纤维通常处于收缩状态,比如位于躯干中用以维持姿势的肌群。
卡罗尼和同事检测小鼠体内的荧光标记时发现,支配FF纤维的神经元最先死亡。到了疾病中期,支配FR纤维的神经元开始死亡,而支配S纤维的神经元坚持到渐冻症晚期才死亡。这种变性模式和渐冻症病人各期症状非常吻合,说明“渐冻症动物”和病人具有相似性。
哈佛大学的乔舒亚·萨内斯(Joshua Sanes)和杰夫·利希特曼(Jeff Lichtman)做过一个类似的荧光标记实验,但他们利用了先进的实时成像技术观察SOD1突变小鼠。萨内斯和利希特曼惊奇地发现,在即将死亡的运动神经元周围,另一种原本沉寂的神经元却有复苏的迹象。他们推测,在同一“运动传导通路”中,存在两种神经元,“死亡者”与肌肉的连接消失,“补偿者”长出轴突分支与肌肉建立新的连接。如果能找到“补偿神经元”复苏的原因,也许就能治疗渐冻症。
研究显示,要延长“渐冻症动物”的寿命,必须同时保护运动神经元的细胞体和轴突才有效,如果只保护细胞体就毫无效果。这些研究再次证明,运动神经元的不同部分具有不同的死亡机制。轴突中,含量最丰富的蛋白是神经丝(neurofilament),作用是维持轴突的刚性机构。神经丝越多,轴突直径越大,对渐冻症的抵抗能力越弱。加拿大魁北克拉瓦尔大学(Laval University)的让-皮埃尔·朱利安(Jean-Pierre Julien)认为,如果轴突中的神经丝太多,就会阻碍营养物质从细胞体流向突触,而物质流动受阻,就相当于卡住了运动神经元的“咽喉”,让神经元走向死亡。大约1%的渐冻症病例,就是源于编码神经丝的基因发生突变。
因为结构上的不对称,运动神经元的细胞体必须向轴突和突触输送大量的能量,才能维持二者的“生命”。很多重要的细胞成分必须先由细胞体产生,再向轴突末梢传递,比如“能量工厂”线粒体;反过来,某些关键物质(如生长因子,即可以刺激细胞增殖和分化的蛋白)必须从轴突末梢运回细胞体。神经元内的这些运输过程都需要分子发动机(molecular motor)的参与,在此过程中,任何环节出错都会导致运动神经元死亡。有些研究小组已经证明,分子发动机的突变可以杀死运动神经元。
直到不久前,科学家还认为,运动神经元的死亡只是“自我行为”,但最新证据显示,胶质细胞也可能与运动神经元的死亡有关(正常情况下,胶质细胞为运动神经元提供养分,同时起到支撑作用)。如果一种SOD1突变基因只在运动神经元或胶质细胞中表达,实验小鼠就不会患上渐冻症。而且,加利福尼亚大学圣迭戈分校(the University of California,San Diego)的唐·克利夫兰(Don Cleveland)还发现,健康胶质细胞能保护受损运动神经元,而受损胶质细胞则会诱使运动神经元发生病变。由此看来,渐冻症很可能是运动神经元和胶质细胞共同作用的结果。
治疗渐冻症
研究人员已经找到一些可以保护运动神经元轴突的分子,纤毛神经营养因子(ciliary neurotrophic factor)就是其中之一,它对运动神经元和感觉神经元的存活都很重要。还有一些分子可以防止细胞体自我分解,但不能保护轴突,比如胶质细胞源神经营养因子(glial cell–derived neurotrophic factor)。
为了寻找能保护轴突物质,华盛顿大学的杰弗里·米尔布兰特(Jeffrey Milbrandt)领导的小组,对一种突变小鼠展开了研究——在这种小鼠的DNA序列中,有一个特殊的融合基因,让小鼠天然具有轴突保护机制。融合基因编码的蛋白分子有两个关键部分,一个是细胞废物处理系统的关键“成员”,另一个则是负责合成烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD,很多代谢反应所必需的小分子)的酶。突变小鼠的神经元受损后,轴突死亡进程比正常小鼠缓慢得多。
研究了在实验室培养的运动神经元后,米尔布兰特的小组发现,发生在上述小鼠体内的突变,使NAD合成酶的活性增强,轴突也得到某种机制的保护。进一步的研究显示,高活性、高浓度的NAD可以激活细胞内的某些生化途径,延长蛔虫和果蝇的寿命(参见《环球科学》2006年第4期《长寿基因挑战寿命极限》一文)。除了NAD,其他一些小分子也有类似功能,比如红葡萄皮中的白藜芦醇(resveratrol)。一些药物公司已经开始研制可以激活NAD途径的药物,用于对抗渐冻症等神经退化性疾病。
比利时鲁汶天主教大学的彼得·卡梅利特(Peter Carmeliet)领导的研究小组提出了另一套方案。在一次试验中,该小组培育了一种天生缺乏血管内皮生长因子(vascular endothelial growth factor,VEGF)的转基因小鼠,研究人员意外发现,这种小鼠患上了运动神经元损伤性疾病。
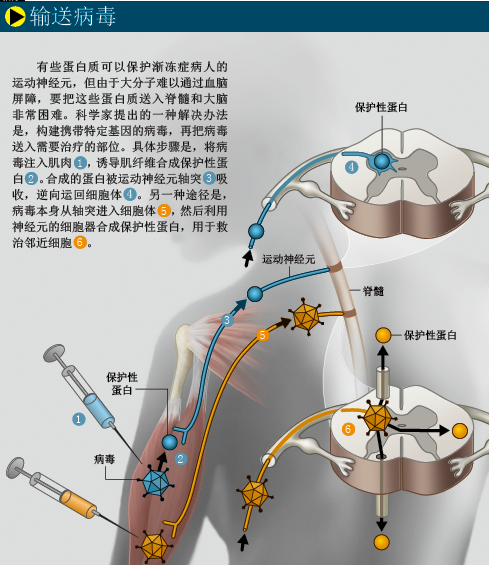
卡梅利特立即想到,如果给神经元输送VEGF,是否会延长小鼠运动神经元的存活时间?不过,给大脑和脊髓输送治疗性蛋白并非易事,因为蛋白质类大分子很难通过中枢神经系统的血管壁(参见《环球科学》2006年第11期《给大脑喂药》一文)。英国牛津生物医药公司(Oxford Biomedica)的米蒙·阿祖兹(Mimoun Azzouz)和尼古拉斯·马扎拉基斯(Nicholas Mazarakis),应用基因疗法解决了这一难题:首先构建一种能合成VEGF的病毒载体,再将病毒注射到小鼠的各个肌肉组织,当运动神经元末梢捕捉到病毒后,就会将它们运送到位于脊髓中的细胞体。随后,病毒开始合成VEGF,延缓或阻止渐冻症的发作。
卡梅利特利用微量泵给药技术,将VEGF直接泵入小鼠的脑脊液中,同样减缓了运动神经元的死亡进程,说明直接施加生长因子也可以保护神经系统。卡梅利特的研究小组还发现,渐冻症病人血液中的VEGF浓度明显偏低。因此,卡梅利特与瑞典制药公司NeuroNova合作,开发基于VEGF的临床治疗方案。
另一种具有神经保护作用的蛋白质叫做胰岛素样生长因子-1(insulinlike growth factor 1,IGF-1)。在培养的细胞和动物模型上,IGF-1都能有效保护运动神经元。美国索尔克生物研究院(the Salk Institute for Biological Studies)的弗雷德·盖奇(Fred Gage)和同事构建了能合成IGF-1的病毒,注入渐冻症小鼠的肌肉中。病毒从肌肉中的运动神经元末梢转移到细胞体后,就开始合成IGF-1。结果,IGF-1可能通过作用于运动神经元及其周围细胞,将小鼠的寿命延长了30%。为了将这种方法用于治疗渐冻症病人,研究人员正在为临床实验做前期准备。
过去几年,在治疗渐冻症方面,科学家有不少重要发现,比如定期锻炼身体能促进新神经元的生长、改善学习能力、提高神经系统中生长因子的浓度。动物实验显示,锻炼身体能增强神经元对损伤和疾病的“抵抗力”。盖奇和合作者发现,定期把渐冻症小鼠放到滚轴上训练,可以让小鼠的寿命延长120~150天。研究人员猜测,锻炼可以增加IGF-1的合成量,提升小鼠的运动反应能力,甚至能保持受损神经元的活力。后来,盖奇在训练小鼠的同时,又施以IGF-1疗法,接受了联合疗法后,小鼠的寿命平均延长了210天。
干细胞领域的突破性进展,为治疗渐冻症等神经疾病开辟了新途径。起初,科学家的想法是,利用干细胞代替神经退化性疾病中的受损神经元。然而,在过去几年的研究中,科学家发现植入神经系统的干细胞并未发挥替代作用,反而以另一种方式保护受损神经元——像生物泵一样将重要神经因子运送给受损神经元。令人惊讶的是,植入的干细胞还会自动迁移到受损神经元处。很明显,受损组织发出了分子信号,引导干细胞向受损部位迁移。由于神经元和胶质细胞都与运动神经元疾病有关,因而植入的干细胞应该能分化为多种细胞,而不只是分化为运动神经元。
RNA干扰技术(RNA interference,RNAi)的出现,也让神经退化性疾病患者看到了希望。小片段的RNA与某些信使RNA(mRNA,携带基因信息的移动载体,合成蛋白质的模板)结合后,能阻止mRNA合成相应蛋白。科学家可以构建能合成短小RNA片段的病毒,让它去感染目标神经元,从而阻止神经元合成毒性蛋白。我们与牛津医药公司的研究人员已经证明,这种方法可以关闭SOD1突变基因,控制渐冻症小鼠的病情。
有一种家族性渐冻症就是由SOD1突变基因引起的,RNA干扰实验成功后,研究人员和医生对这种疗法充满了期待。医生可以将合成的RNA片段直接注入患者的脑脊液,让它们与神经元及胶质细胞中的mRNA结合,使之无法指导SOD1的合成。如果这种方法可以奏效,其他由基因突变导致的神经退行性疾病也可以用这种方法治疗。
将上述任何一种新方法用于临床治疗都需要一个过程。以基因疗法为例,医生们如果想利用病毒在人体内合成生长因子或RNA片段,首先要确保病毒的安全性(通过病毒给人体转入基因会产生复杂的效应)。为了获得较好的疗效,医生还要统计患者有多少肌肉需要注射病毒。最理想的情况是,研究人员设计出蛋白质和RNAi的联合疗法,产生单一疗法无法达到的疗效。非盈利组织ALS协会已经引入了一种药物联合疗法:塞来昔布(celecoxib,一种抗炎药,能控制过于活跃的胶质细胞引起的细胞损伤)与肌氨酸(creatine,一种氨基酸),两者都是小分子,极易到达中枢神经系统的运动神经元。实验证明,它们的确可以延长动物的寿命。
当然,最好能找到预防渐冻症的方法,而不是患病后再去治疗,这就要求人们拥有健康的生活方式。研究人员发现,定期锻炼身体能在一定程度上预防神经退行性疾病,现在他们又开始研究饮食习惯对预防疾病的作用。一旦科学家找到最有效的、能防治渐冻症的运动和食物,我们也许就能在它侵袭神经系统前将它消灭。
请 登录 发表评论