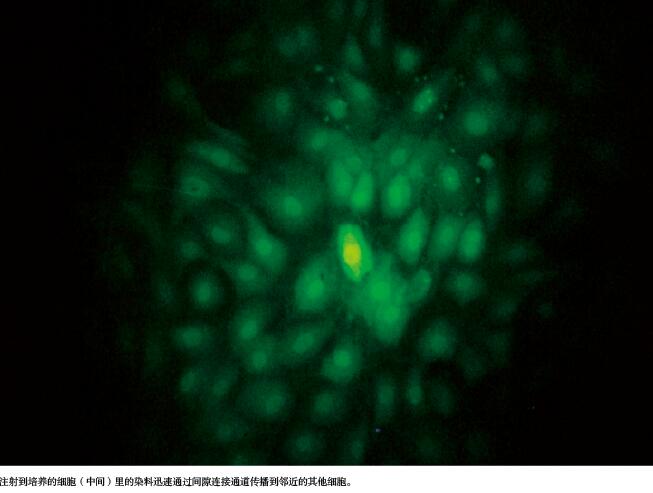
上世纪60年代,研究者们发现了这种令人印象深刻的细胞间通信连接。当他们把荧光染料分子注射进紧密堆积的细胞群正中的一个细胞后,通过显微镜,可以观察到荧光信号从正中那个细胞迅速扩散到周围的细胞,有时候会让附近数百个细胞都熠熠生光。之前有研究表明,离子可以在邻近细胞间传递电信号。但考虑到在细胞间扩散的荧光染料分子更大、种类更多,无疑证实了细胞上存在通道,可以让大量分子在相邻细胞间传递。
如今生物学家们知道这类通道随处可见。它们在所有动物(包括人类)的组织里都存在,具有种类繁多的功能。这些通道被称为间隙连接(gap junction),它们帮助心肌细胞同步搏动,在分娩过程中收缩子宫。间隙连接能调节眼睛以适应不同光强。它们甚至还参与了胚胎发育时的器官形成。
过去20年里,科学家们发现,如果间隙连接的组装或活性有缺陷,就会导致一系列人类疾病,包括听力丧失、白内障、皮肤病、神经系统疾病、心脏病以及某些癌症。影响在内耳中组成间隙连接的某个蛋白质的单个突变,会导致失聪。这类失聪占遗传性耳聋患者的40%。研究者不断发现和间隙连接相关的新疾病——包括某种儿童癫痫在内的一些疾病是在过去几年中刚发现的。
现在,这方面的研究取得了让人兴奋的进展,让我们可以深入了解间隙连接的构建方式,并揭示间隙连接组装和活性的缺陷是如何引发疾病的。这些发现会为因细胞无法共享“内部”信息而导致的疾病提供新的治疗方法。
构建细胞间的桥梁
在进行早期的注射染料扩散实验时,研究者并没有立即将此现象和医疗联系起来。20世纪60年代和70年代,他们专注于进一步寻找这种神秘的邻近细胞间通信的证据,并更多地了解细胞通信的性质。在间隙连接被确认和命名之前,生理学家就已经发现,多种器官和有机体中都存在这种分子信息的分享机制,包括乌贼胚胎、放电的鱼类和各种哺乳动物的细胞。他们证实,在相邻细胞的细胞膜发生紧密接触的位置,分子可以直接从一个细胞移动到另一个细胞。
20世纪60年代后期,科学家开始着眼于研究通道的形状和形成方式。早期的显微镜研究显示,在相邻细胞的细胞膜上,各有一块大而扁平的斑块结构,紧密地贴在一起。在这些连接处,细胞间的间隙非常狭小,仅有几个纳米宽,因此这些结构被称作间隙连接。尽管研究者们之后又发现这个狭小的间隙并不是空的,而是填满了连接两个细胞的通道,间隙连接这个名称依然被保留下来。
为了研究这些扁平的细胞膜斑块结构在(染料扩散实验和电流传导实验中观察到的)“细胞连通”中所起的作用,本文的作者之一(约翰逊)开始研究间隙连接是如何组装的。约翰逊和明尼苏达大学的同事们合作,把来自肝脏肿瘤的培养细胞轻柔地分开,然后再把它们重新混合在一起。几分钟后,细胞膜上的扁平斑块结构开始出现,但只出现在两个细胞接触的地方。这个发现证实了以下假说:间隙连接的组装需要相邻细胞协作完成。随着相邻细胞膜上扁平斑块结构的扩张和成熟,细胞间通过的电流也随之增加。这些结果表明间隙连接有助于交换离子。
约翰逊和他的团队剥离这层紧邻细胞间的细胞膜去看个究竟,他们发现扁平斑块内聚集了很多体积较大的颗粒。后来,科学家发现这些颗粒是构成间隙连接的结构单位——通道。每个通道都由接合素蛋白(connexin)分子构成,这类蛋白质是在20世纪80年代后期被发现的。
6个接合素蛋白聚集在一起,可以形成面包圈形状的结构,称为半通道结构(hemichannel)。这种半通道结构可以伸出细胞膜,和相邻细胞的半通道结构相互作用。一旦半通道互相匹配,其中的接合素蛋白发生相互作用,就能形成一个连续的中心孔道,这个孔道连通了一个细胞与另一个细胞的细胞质。事实上,这样的一个孔道就是一个单间隙连接通道,数百个或数千个这样的通道聚集在一起形成一个间隙连接。
对于细胞来说,建造这样庞大的通信线路是一项大规模的工程。单单一个间隙连接就可能包含10 000个通道。而每个间隙连接通道又由两个半通道构成,因此每个间隙连接可能包含120 000个接合素蛋白。仅心脏就含有数十亿个细胞,而每个细胞又分别与多个相邻的细胞通过间隙连接沟通。组装如此巨大的结构可以说是分子工程上的奇迹。
更了不起的是,间隙连接并非永久性的结构,甚至存在时间不长,它们被不断地拆卸和重建。有证据显示,在心肌细胞的一个间隙连接里,接合素蛋白每两小时就会被替换一半。在一天的时间里,人类心脏中所有的间隙连接都会被全部拆毁然后被新组装的通道取代。
考虑到这些惊人结构的复杂性,必须有一套系统能确保建造工程平稳地进行,以保障细胞间的通信不被打断。为了全面了解间隙连接的调节机制,本文的3位作者(我们都在研究间隙连接)决定将我们的专业知识结合起来。我们尤其想要探索的是,机体如何控制这些广泛存在的通信通道的组装和拆卸过程。
从Cx43开始
在1991年,我们三人都参加了在加利福尼亚州太平洋丛林镇的阿西洛玛(Asilomar)会议中心举办的间隙连接会议。会议期间,我们边喝咖啡边想出了我们的合作计划。兰普当时在约翰逊的实验室做博士后,在那里他开始关注间隙连接组装过程的调控机制。莱尔德是加州理工学院珍-保罗·雷维尔(Jean-Paul Revel)实验室的博士后,他成功制备了一套接合素蛋白的特异性抗体。这些抗体使我们得以仔细研究接合素蛋白,并探究这些分子的哪个区域在间隙连接的形成和活动中起重要作用。
莱尔德的抗体可以识别一个特定类型的接合素蛋白:Cx43。人类基因编码21种不同的接合素蛋白,每种类型的细胞都生产一套独有的接合素蛋白。皮肤细胞能生产多达9种不同的接合素蛋白。而Cx43是分布最广泛的结合素蛋白,在多个器官中存在,包括皮肤、心脏、大脑、肺和骨头。
Cx43和所有种类的接合素蛋白一样,由4个跨膜片段组成,这些片段将整个蛋白质锚定在细胞膜上。蛋白质的尾巴悬挂在细胞内部,包含多种元件,我们之后发现,这些部分参与了蛋白质的活性调节和通道及间隙连接的组装。蛋白质探出膜外又折回膜内,形成了两个环状结构,伸进了两个细胞间的空隙。莱尔德制备的一些抗体正好可以结合到这个位于细胞间的片段上。
由于环状结构伸出了细胞表面,有理由相信它们的作用是将两个接合素蛋白钩联在一起。为了验证这个假说,我们再次分离了培养细胞后将它们重新混合,但这次我们加入了莱尔德的抗体。这次间隙连接没有形成。我们没有观察到染料在细胞间的转移,也没有观察到间隙连接的扁平斑块结构形成。抗体结合在接合素蛋白的环状结构上,阻碍了细胞上的接合素蛋白与相邻细胞的接合素蛋白间的对接。
抗体的研究证实了接合素蛋白的胞外元件对间隙连接的构建十分重要。但想要实时观察结合素蛋白如何在活细胞中起作用,需要另一项不同的技术。
连接细胞的蛋白
1994年,我们3人在另一次会议上相聚,这次是在旧金山举行的美国细胞生物学学会年会。在一次深夜讨论中,我们谈到了听过的报告,我们对绿色荧光蛋白(GFP)产生了愈来愈浓厚的兴趣。(后来,发现这种非常有用的分子工具的科学家获得了诺贝尔奖。)大会上的一个演讲者阐述了她如何将这个荧光标记物连接到她感兴趣的蛋白质上,然后追踪这个蛋白质在活细胞中的运动轨迹。于是,我们想知道自己的研究小组是否也能利用GFP监控接合素蛋白的活动。
我们首先把GFP蛋白连接在接合素蛋白位于细胞质内的尾端。让我们高兴的是,这个方法有效果:被标记的接合素蛋白可以正确地插入细胞膜,然后组装成有功能的间隙连接,性质与未经修饰的接合素蛋白几乎一样。我们现在有了强有力的手段来观察接合素蛋白在细胞内部的行为——莱尔德在西安大略大学的新工作就此展开。
我们的第一个发现出乎意料。在给细胞加入接合素蛋白后,我们每10分钟为细胞拍一张照片,打算把这些静止的图片剪辑起来做成延时电影,突出展示接合素蛋白的移动。但接合素移动起来实在太迅速,我们无法分辨出哪个蛋白是哪个,也不知道它们去哪了。我们之后尝试每隔两分钟拍摄一次,但帧数依然不够。为了能观察单个标记蛋白分子在细胞内的转运,我们最终每隔几秒钟就拍摄一次图像。
我们得到的电影不仅可以让我们追踪接合素蛋白,同时也可以让我们追踪到半通道结构在细胞内部沿着微管分子轨道的转运过程。我们和其他研究者发现,较小间隙连接可以结合成更大的间隙连接——我们在电子显微镜下已经观察到了这种迹象。我们还证实较大的间隙连接也可以分裂成较小的间隙连接,细胞生长、移动、收缩和分裂的时候都会发生这种间隙连接的重建过程 。
我们的同事设计了更多的方法,用于标记接合素蛋白。我们发现,间隙连接通过在其外围增加半通道结构而扩展——因此间隙连接的中心部位代表了斑块中最“老”的部分。这些较“老”的组分随着间隙连接的老化会被替换掉,这个现象解释了间隙连接如何在结合素蛋白不断流失的情况下维持自己,新产生的通道向内聚集,代替了“老”通道。
也许我们从活细胞观察实验中获得的最让人惊讶的发现是:细胞也可以大量回收间隙连接,在这个时候,某个细胞有可能把它和邻近细胞之间的结合素蛋白都吞下去,而不是各分一半。其他研究者根据早期的电镜观察结果也提出了这种机制。这种激进的策略可以把两个细胞贡献的连接组分一下都吸收掉,当两个细胞不再需要交流信息时,就可以通过这种方法迅速关闭它们之间的通信联系。分娩后的子宫就会大规模地消除间隙连接,关闭之前用于协调宫缩的通信网络。
细胞连接的动态变化
当我们知道间隙连接在不断更新之后,接下来我们着手探究细胞如何监管这项庞大的分子重塑工程。早期研究结果指出,一类名为激酶(kinase)的蛋白质是接合素蛋白的调节因子。激酶可以通过给目标蛋白质加上磷酸基团的简单步骤,改变目标蛋白质的活性和在细胞中的位置。
我们面对的挑战是,了解激酶是否调控接合素蛋白,如果是的话,这种磷酸化的目的何在。1994年兰普在西雅图的弗莱德·哈金森癌症研究中心(Fred Hutchinson Cancer Research Center)成立了实验室,然后开始领导这一系列研究。兰普和他的研究小组将Cx43蛋白质分解成数段,每次检查一小段。他们发现Cx43在生命周期中,尾部有15个位点发生了磷酸化。这让我们破译了一些控制Cx43形成间隙连接的调控密码。当特定的激酶对蛋白尾部的特定部位施加作用,使其发生磷酸化修饰,就会促进含有Cx43的间隙连接的组装,另一些特定激酶在蛋白尾部其他部位的作用则抑制了间隙连接的形成、活性或规模。
对间隙连接的调控密码的深入理解,让我们有可能检测人体组织样本,从而厘清磷酸化状态的变化如何改变间隙连接在受伤或疾病后的组装方式和功能。我们和其他研究小组开始着手研究当人患病或受伤时,间隙连接通信有何变化,比如心脏病发作后的心肌细胞试图从缺氧状态中恢复,以及皮肤细胞被动员起来促使伤口或抓痕愈合时。兰普的研究团队发现,在这两种情况下,Cx43尾部的某个特定位点磷酸化程度增加了。这个磷酸化可以阻碍Cx43与另外一个蛋白质的相互作用——这个蛋白质限制了新的接合素蛋白插入间隙连接的能力(这个研究由其他研究小组完成)——从而暂时扩大了这些机体组织中间隙连接的面积。间隙连接的扩大有助于信息交流的增加,这在损伤发生后的第一时间内非常重要,因为可以帮助保护心脏的功能,以及促进皮肤细胞向开放性创口的迁移帮助创口愈合。
当我们了解了磷酸化如何影响接合素蛋白的组装和功能,以及间隙连接间的通信会如何发生改变以应对损伤和疾病后,就可以开发一些新的药物,促进或抑制相关蛋白激酶的活性。不过,使用这样的药物要十分谨慎,因为在疾病的某个阶段增加间隙连接,可能会在后期产生有害的结果。例如,受到损伤后间隙连接会马上增加,但之后它们就被迅速降解,从而促进伤口充分愈合。糖尿病患者因为会持续过量地制造Cx43,所以伤口愈合的速度会减慢。当眼角膜受损时,接合素蛋白更容易引起发炎和留疤,而不是让伤口愈合。在这些状况下,限制伤口周围细胞内Cx43的产生或抑制其功能,有助于让伤口不留疤痕地快速愈合,已经有几家生物技术公司寻求根据这个方案设计疗法。
不过,为了充分利用我们关于间隙连接的生物学知识,从而设计出更有效的疗法,研究者需要更深入地理解不同生理状态下的不同机体组织中,接合素蛋白如何聚集在一起——以及在疾病状态下这些蛋白的聚集和活性出现了什么差错。对接合素蛋白基因致病突变的研究已经开始为我们提供有用的线索。
通信异常会导致疾病
上世纪90年代中期,研究者第一次找到了接合素蛋白与疾病有关的可靠遗传学证据。编码Cx32的基因发生突变会导致一种神经系统疾病:夏克-马里-图斯氏症(Charcot-Marie-Tooth disease,一种进行性神经性腓骨肌萎缩症)。在病患体内,用以隔离神经的髓鞘组织中的间隙连接不复存在,导致髓鞘降解并最终引发神经退行。接下来会引起肌肉(特别是四肢的肌肉)的萎缩和衰弱。
在发现接合素蛋白基因的突变会导致严重的生理缺陷后,研究者和临床医生对间隙连接领域的兴趣被引爆了,他们决定要找到这些疾病的遗传基础。其他研究找到了新的接合素基因突变,迄今为止,共有14种疾病被认为是由间隙连接的接合素蛋白缺陷造成。
这些疾病最引人注目的地方是,它们彼此之间很不相同。除了神经退行性疾病夏克-马里-图斯氏症之外,接合素基因的突变会引起听力丧失、癫痫、心脏病、皮肤病、白内障以及各种胚胎发育过程中的疾病。不出意料,不同接合素基因的突变会导致不同的疾病。但出乎我们意料的是,接合素蛋白的突变对不同组织和器官的影响并不完全相同。如果某种特定的接合素蛋白突变同时在两个器官出现,可能会对一个器官产生损害,而对另一个无害。
多个研究小组正在努力搞清楚这种现象。有一种解释是,在某一特定组织中,其他正常的接合素蛋白对有缺陷的变异蛋白可以起到补偿作用,从而允许间隙连接将通信功能维持在适当的水平。某些组织可能具有这样的补偿机制,但另一些则没有。另一种解释是,某个特定的接合素蛋白在一种组织中起某个作用而在其他的组织中承担了不同的功能,这取决于组织中还有哪些其他类型的结合素蛋白。不同的接合素蛋白家族成员还可以彼此混合,产生杂交通道以促使不同的分子信号通过——这些分子信号对某些组织来说比其他组织更重要。
而某些接合素蛋白的缺陷会累及多种组织。以我们研究的一种疾病为例,这种疾病名为眼齿趾发育不良(oculodentodigital dysplasia,ODDD)。这种由Cx43基因突变触发的疾病有多种症状,包括小眼睛、发育不完全的牙齿、头面部的骨骼畸形以及手指或脚趾间的粘连。除此之外,有些患者会出现一种皮肤病——在手掌和脚底生出增厚的、干燥易脱落的茧。有些人群患病后症状会更严重,最近关于接合素蛋白生命周期的研究,为这种现象的原因提供了一些线索。
在ODDD病人中发现了70多种Cx43基因的突变,我们开始着手研究这些突变对蛋白质本身的影响——以及突变会如何影响间隙连接的结构。莱尔德和他的同事发现,多种Cx43基因突变都会让接合素蛋白虽然能到达细胞膜,但无法形成有功能的间隙连接。荧光染料无法通过这些连接从一个细胞流向另一个细胞,表明这些间隙连接通道要么组装方式不正确,要么不能让分子信号通过。无论哪种情况,这些突变削弱了细胞间的通信。
其他ODDD的突变让接合素蛋白完全无法到达细胞膜。带有这些突变的病人一般来说病情更加严重,包括皮肤疾病和其他症状。这一发现表明,接合素蛋白构成的半通道结构除了参与构建间隙连接外还另有功能,一旦这个功能无法完成(如接合素蛋白无法到达细胞膜),会导致更严重的问题。例如,有些半通道结构也许并没有配对形成完整的通道,而是维持未配对状态,让细胞向周围环境释放信号分子或从中摄取分子。这些分子也许和通常通过间隙连接通道的分子并不相同。已有实验证明了这些半通道结构的活性,这为我们提供了新的角度,帮助我们对于理解接合素蛋白在细胞通信中的功能。对突变体半通道的进一步研究可以帮助我们找到新的目标——包括尚未确认的通过未配对半通道结构交流的分子——以治疗ODDD病症及其他接合素蛋白相关疾病。
核心问题
研究突变会如何影响间隙连接的结构和行为,还可以让我们设计出高度针对性的治疗方案,以抵消基因突变带来的不利影响,同时避免引发严重的副作用。举例来说,如果知道某个特定突变可以影响一个间隙连接的组装,但并不影响接合素蛋白到细胞表面的转运,就可以设计一种药物用来恢复接合素蛋白形成功能性通道的能力。这些针对性的治疗方案可以在不用完全替换突变的结合素蛋白的情况下,重新建立细胞间的通信。而如果要整个替换掉接合素蛋白,需要使用基因治疗,这种技术有风险且仍在试验阶段。
致病性接合素蛋白基因突变的发现,除了可以为治疗提供帮助,也为实验人员提供了一系列新的研究手段,用于间隙连接的基础生物学研究。例如,我们仍然没有充分了解是哪些分子通过间隙连接在不同细胞间移动。我们知道心肌细胞中,穿梭于间隙连接的离子携带电信号,从一个细胞导入另一个细胞。但我们还不清楚在耳朵的听觉处理、皮肤的创口愈合等过程中,是哪些分子在细胞间穿梭传递信号。通过观察在不同组织细胞间接合素蛋白通道的行为,以及通道组装和活性的改变会如何导致疾病,我们最终可以回答关于这种细胞间直接通信方式的核心问题:一个细胞跟另一个细胞究竟悄悄说了些什么?这些神秘的分子究竟如何控制复杂生命(包括我们自己)的组装和运作?
请 登录 发表评论