大多数细菌都是我们的亲密伙伴。当你感到孤单时,不要忘了在你身上和体内,其实生活着数以万亿计的细菌,数量是人体细胞的10倍。在成千上万种已知细菌中,大约只有100种是破坏和平共存规则、让我们生病的坏家伙。
这些病菌给我们制造了一大堆麻烦。感染性疾病是全球第二大致死因素,而细菌性感染就是典型代表:结核杆菌每年夺走近200万人的生命,臭名昭著的鼠疫耶尔森氏杆菌(Yersinia pestis)是导致黑死病(bubonic plague)的元凶,曾使14世纪的欧洲人口锐减1/3。过去100年间,科学家利用抗生素征服了不少病菌,但也有一些病菌找到了抵抗抗生素的方法。在这场“军备竞赛”中,人类已经处于下风,部分原因是我们对“敌人”的了解还不够。
历史上,为了研究细菌的致病机理,微生物学家通常先在营养丰富的培养基中“饲养”细菌,再分离细菌的表面分子,或从培养基中提取细菌的分泌物,最后检验这些物质对人体细胞或动物有何影响。这些研究虽然弄清楚了各种细菌毒素的特性,但在探索致病机制时,科学家大多忽略了病菌与宿主间的相互作用。过去20年里,越来越多的研究发现,病菌在培养基和宿主中的表现有着极大的差异。
为了入侵各种器官和组织,并在人体中生存繁殖,每种病菌都身怀绝技,它们劫持细胞,控制细胞的通讯系统,迫使细胞为自己服务。多数病菌会利用特殊工具,向细胞注射蛋白质,改变细胞机器的运行程序,达到控制细胞的目的。少数病菌则采用另一种策略:除去人体内的有益菌,占领人体内环境。当科学家阐明病菌入侵人体、骗过免疫系统的攻击策略,了解它们所使用的“尖端武器”后,我们没有浪费任何时间,立即开始研发新的治疗方案,利用病菌自身的武器来对付它们。
瓦解人体防线
释放毒素只是病菌的致病方式之一。感染性疾病的某些症状是由病菌生存策略直接导致的。很多病菌都会导致发烧、腹泻等一系列相似症状,我们似乎可以认为,它们的致病方式也很相似。虽然这些微生物确实都会作用于细胞器上的某些基本元件(如构成细胞内部骨架的特定蛋白),但它们的进攻方式却惊人的复杂多变。
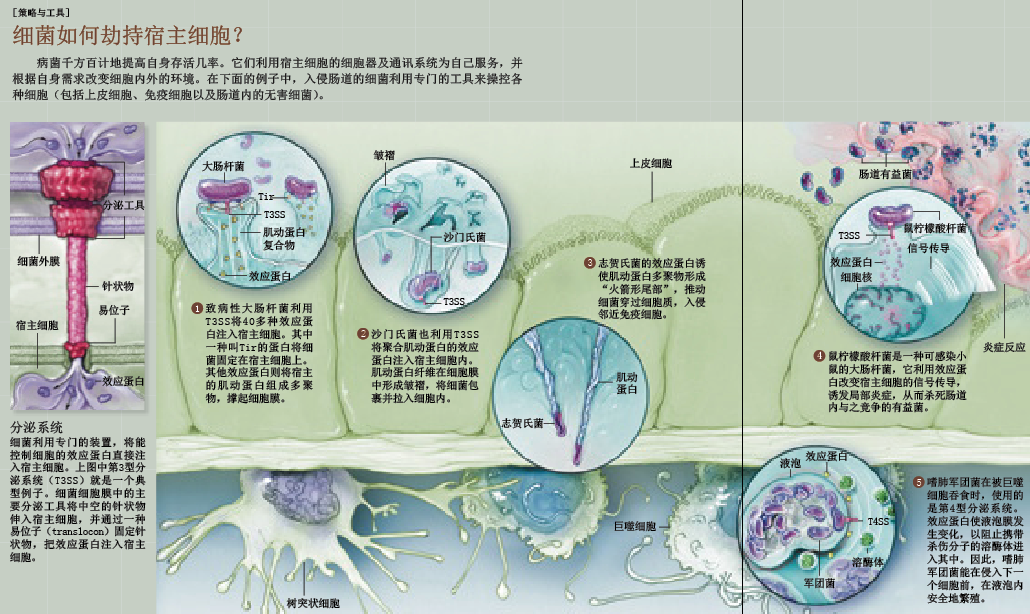
任何病菌发起攻击的第一步,都是设法附着在宿主细胞上。肠出血性大肠杆菌O157是一种致病性大肠杆菌,它能以极为特殊的方式把自己锁定在宿主细胞上。通常,人们感染这种病菌是因为食用了变质食品。它们一旦进入胃肠道,就会附着在肠壁上,分泌一种能引起出血性腹泻的毒素。科学家一度认为,大肠杆菌O157与其他黏附病菌一样,会与宿主肠道细胞表面原本就有的受体分子结合。但最近越来越多的研究显示,这种致病性大肠杆菌会合成自己专属的受体分子,并通过一种特殊工具——第3型分泌系统(type 3 secretion system,简称T3SS,按发现的先后顺序命名),把自己送进宿主细胞。
T3SS将一种名为Tir的分子及其他40多种效应蛋白(effector protein)一起注入宿主细胞,然后又把细菌自身的一种表面分子锚定在Tir分子上。这只是大肠杆菌O157为控制细胞采取的第一步措施,Tir与其他效应蛋白还会使宿主细胞的内部骨架出现异常。肌动蛋白(actin)是一种重要的细胞骨架结构单元,它与细菌蛋白发生反应后,开始形成多聚物,从细胞内部向外推压细胞膜,直至形成一种垫状结构(pedestal)。此时,大肠杆菌仍在细胞外,牢牢地固定在垫状结构上,而它注入细胞的效应蛋白和毒素则在细胞内部大肆作恶。目前,我们现在还不清楚那些垫状结构的确切功能,但研究人员已经证实,这些结构对于病菌的致病能力至关重要。
幽门螺旋杆菌(Helicobacter pylori)是另一种潜在的致命病菌,它们附着到胃部的上皮细胞上之后,就开始改变周围环境,使之更利于自身生存。它们会释放尿素酶(urease),局部中和能杀灭大部分细菌的高强度胃酸。虽然并非所有幽门螺旋杆菌都会导致疾病,但那些致病菌株可以导致胃溃疡甚至胃癌,这使幽门螺旋杆菌成为唯一已知能导致癌症的细菌。这些致病菌株利用第4型分泌系统,将CagA效应蛋白注入宿主细胞。虽然我们还不清楚CagA蛋白的具体功能,但最近的研究显示,它能诱使胃上皮细胞产生更多的受体蛋白,为幽门螺旋杆菌提供附着点。在一定程度上,这种效应蛋白还能直接改变胃部细胞内的信号传导,使胃部细胞变长,更为分散,最终死亡,从而导致胃溃疡。
大肠杆菌O157和幽门螺旋杆菌不必进入细胞就能致病,但大肠杆菌的近亲、每年致使全球10多亿人腹泻的沙门氏菌(Salmonella)则需要穿过细胞膜。为了生存和繁殖,沙门氏菌必须进入和穿过肠道内壁的上皮细胞。首先,沙门氏菌利用T3SS的一种变体——沙门氏菌致病岛1(Salmonell pathogenicity island 1,SPI-1)将效应蛋白注入上皮细胞,在一定程度上改变肌动蛋白的聚合反应,使细胞膜产生类似于大肠杆菌垫状结构的皱褶(ruffle)。随后,这些皱褶结构向上伸出,将附着在细胞膜外层的细菌包裹起来,把细菌“吞”入细胞内。实际上,仅凭SPI-1注入的分子,就能引起这类感染的特征症状——腹泻,但沙门氏菌并没有就此罢休。
巨噬细胞、嗜中性粒细胞、树突状细胞等先天免疫系统的细胞一般会吞噬并消灭所有入侵者。吞噬细菌后,这些吞噬细胞将细菌隔离在液泡(即吞噬泡)中,由杀伤分子进入液泡将细菌消灭。但沙门氏菌却能通过上皮细胞,穿越肠道内壁,直面守候在那里的免疫细胞。一旦被吞噬到液泡内,沙门氏菌就启用第二种T3SS —— SPI-2 ,释放效应蛋白,改变液泡的膜结构,阻止杀伤分子的进入,使液泡从“处决室”变成“避难所”,并在里面繁殖。
对于伤寒症(typhoid fever)的“元凶”伤寒沙门氏菌(Salmonella typhi),SPI-2系统是它们成功致病的关键。在SPI-2系统的作用下,伤寒沙门氏菌能在吞噬细胞内存活,而吞噬细胞又可以通过血液和淋巴系统抵达全身各处,因此这些病菌也能到达远离肠道的组织(如肝脏和脾脏),并在其中繁殖。
能在宿主细胞内长期存活,是很多导致严重疾病(包括结核病和军团病)的病菌的普遍特征。嗜肺军团菌(Legionella pneumophila)就是一个令人特别感兴趣的例子。它利用T4SS向吞噬细胞注入至少80种效应蛋白。虽然目前只弄清其中一小部分蛋白的功能,但我们知道,至少一部分蛋白的作用是把吞噬泡变成细菌的避难所。
军团菌的行为模式,还让我们有机会了解细菌分泌系统的可能起源:细菌进化出分泌系统,明显不是为了让人类生病,而是为了保护自己免受土壤中单细胞生物的攻击。当军团菌被土壤阿米巴(amoeba)吞食后,通常会借助T4SS存活下来。值得注意的是,阿米巴的很多生物机制都与人类的巨噬细胞相似。甚至“军团菌”这个名称的由来,也与阿米巴相关。1976年,在美国退伍军人协会于费城举行的一个会议上,携带了军团菌的阿米巴随风进入会议所在酒店的空调管道,通过管道进入会议室,被与会者吸入肺部。肺泡中的巨噬细胞与阿米巴一样,吞噬了入侵肺部的军团菌。结果,共有34人死于呼吸道疾病,军团病由此得名。
操控免疫细胞
病菌能在原本要消灭自己的免疫细胞中“安家”,证明它们的“工具箱”中装有功能多样的工具,可以调用免疫细胞中的细胞器。人体免疫细胞与人体外“细菌猎食者”之间的相似性,或许也可以解释细菌其他生存策略的起源。为了避开宿主防御系统,细菌采用了非常精妙的机制,甚至利用免疫细胞来协助自身生存。
鼠疫耶尔森氏菌是一种来源于老鼠的病菌,通过跳蚤叮咬,它们能直接进入人类血液。当血液循环中的巨噬细胞试图吞噬并消灭鼠疫耶尔森氏菌时,这些病菌会利用T3SS将至少4种效应蛋白注入巨噬细胞,使之瘫痪。然后,黏附在巨噬细胞表面的鼠疫耶尔森氏菌随前者一起进入淋巴结,开始在这里繁殖,导致疼痛性肿块(即腹股沟淋巴结炎,bubo)的产生,这就是淋巴腺鼠疫(俗称黑死病)的由来。
很多病菌进化出的分泌/注入系统,能选择性地改变细胞信号传导和免疫反应。痢疾志贺氏菌(Shigella dysenteriae)是痢疾的病原体,从它们身上,我们可以看到单种病菌在感染过程中能够采取的一系列策略。虽然在遗传上与无害的大肠杆菌非常相似,但痢疾志贺氏菌具有T3SS,能将25~30种效应蛋白注入宿主细胞,使自己像沙门氏菌那样进入细胞。此后,痢疾志贺氏菌便会借助细胞骨架机器,通过宿主细胞进入邻近细胞,完全避免与细胞外的免疫细胞及抗体分子碰面。
虽然还没有把痢疾志贺氏菌的其他免疫逃避机制彻底弄清楚,但我们已经知道,它们的一些效应蛋白会直接作用于宿主细胞内部的信号传导系统,阻截感染细胞发出的求救信号。不过,并非宿主细胞发出的所有信号都能被阻截。痢疾志贺氏菌也会发出一些信号,把树突状细胞(dendritic cell)吸引到感染区域,趁机进入这些吞噬细胞,将它们当作特洛伊木马,随它们穿过肠道内壁——这个过程会破坏肠道内壁,引起严重腹泻(痢疾的特征症状)。
遭到细菌“戏弄”的,不只是先天性免疫系统,有些细菌还学会了如何躲避“获得性”免疫系统。该系统由T细胞和分泌抗体的B细胞组成,它们在先天免疫细胞的“培训”下,能通过表面特征(即抗原)识别病原体。作为应对,病菌会不断改变表面蛋白,逃避抗体的追踪,或分泌酶类,降解抗体,以破解这种防御机制。以痢疾志贺氏菌为代表的几种病菌,甚至可以阻止吞噬细胞向获得性免疫系统的细胞呈递抗原,直接阻止抗体的产生。沙门氏菌还能触发一系列细胞信号,在吞噬细胞与获得性免疫系统发生相互作用之前,诱使前者“自杀”。
排挤有益菌
病菌要在人体中生存,仅靠操控细胞信号传导和躲避免疫防御是远远不够的,它们还得战胜人体内数量庞大的有益菌。长期以来,有益菌一直为科学界忽略,直到最近微生物学家和免疫学家才意识到它们的重要性。人体所有能接触到外界环境的器官表面,包括胃肠道壁在内,都被数量惊人的共生细菌覆盖。每1克大肠内容物中,就含有大约600亿个细菌,相当于全球人口数量的10倍。
对于病菌而言,消除“竞争对手”最简单的方法就是引发腹泻,至少暂时把“竞争对手”排挤出体外。我和同事已经证实,小鼠的一种致病性大肠杆菌 —— 鼠柠檬酸杆菌(Citrobacter rodentium)会“故意”引发肠炎,让先天性免疫细胞来杀灭某一特定类型的正常肠道微生物。没有竞争对手争夺养料,病菌能以惊人的速度繁殖,成为肠道中的优势菌群。这种情况一直会持续下去,直到它们引起获得性免疫系统的“警觉”,开始把矛头指向它们。最终,免疫细胞会除掉这些病菌,正常的微生物群又重新分布到肠道中,恢复到以前的数量和比例。
与此相似,在小鼠体内,沙门氏菌也会根据宿主微生物群的组成改变自身行为。这种病菌会使小鼠患上类似伤寒的全身性疾病,但如果事先施以高剂量抗生素,提前改变小鼠的正常微生物群,沙门氏菌就只会引起肠道疾病。来自肠道细菌的竞争似乎会迫使沙门氏菌入侵身体其他部位,导致全身性疾病,但当肠道微生物群发生改变后,它们就会满足于呆在肠道中。
宿主体内,细菌(包括病菌和有益菌)之间的相互作用,为病原菌获得和交换“武器”提供了机会。实际上,很多病菌都是有益菌获得新基因后进化而来的。从这个意义上讲,肠道可以看作一个庞大的微生物基因互联网,细菌可以共享编码“毒力因子”(virulence factor,提供病菌致病力的工具或手段,如分泌系统或效应蛋白)的基因。
如果获得新的致病性基因岛(patho-genicity island),细菌会具有更大的生存优势,能在新宿主体内繁殖或变得更具攻击性。致命的大肠杆菌O157首次出现于20世纪70年代末,它本是一种有益大肠杆菌,在获得编码新型T3SS的致病性基因岛和编码志贺氏菌毒素的基因后才变成致病菌株。这两种“新武器”的共同作用可导致严重腹泻及肾脏疾病。

开发新药
长期以来,用抗生素直接杀灭病菌是我们对付这些致病元凶的传统方法,而注入系统和其他有助于病菌在宿主体内生存繁殖的工具的发现,或许可以催生治疗病菌感染的新方法。我们研究小组就利用对细菌分泌系统的了解,研制了一种新型疫苗来抵抗大肠杆菌O157的感染。
这种疫苗含有病原性T3SS和多种效应蛋白的部分片段。机体接种疫苗后,获得性免疫系统就能立即识别并“中和”这些病原蛋白,避免自己被病菌利用。实际上,这种疫苗的注射对象并非人类,而是牛。半数家牛的肠道内都有大肠杆菌O157,它们对牛是无害的,但牛的排泄物会污染人类的食物和水源,这就是大肠杆菌O157经常通过被污染的肉类或其他农产品致病的原因。如果从源头消灭大肠杆菌O157,就可以不给它们任何感染人类的机会。目前,加拿大已经开始使用这种疫苗,美国也在审批当中。
很多研究人员都在寻找消灭病原体的创新方法。一旦了解某种病菌的致病因子,我们就可以开发一种疗法,抑制相关基因的表达,将病菌变成无害菌。一个与此相关的方法是,制造一种药物,阻止病菌黏附到人体细胞表面,让它们在宿主中没有落脚点。对付致病性大肠杆菌的抗黏附素(antiadhesin)已完成了人体有效性试验,其他类似药物也处于研制初期。
干扰细菌之间的通讯,也是一个令人兴奋的抗感染方案。大肠杆菌这类细菌会根据肠道中正常微生物群及宿主细胞发出的化学信号来判断自身所处位置,而这正是它们决定是否攻击人体细胞的重要参考信息。另一种病菌绿脓杆菌(Pseudimonas aeruginosa)会在肺部形成菌落(即生物膜,biofilm),丹麦哥本哈根大学的研究人员最近证实,这种生物膜的组分会发出信号,警示免疫细胞的靠近,诱导其他细菌分泌能杀死免疫细胞的多肽。
针对细菌致病因子的疗法的一大优点是,这些因子通常不是细菌在人体外生存的必需分子。与传统抗生素相比,这种新疗法只是阻断病菌间的通讯,或扰乱其他致病机制,将病菌变成无害细菌,而不像抗生素那样直接杀灭病菌,这就大大降低了它们产生耐药性的可能性。
一个更为间接的抗菌方法是,改变病菌所处环境,使之无法生存。目前,很多研究人员都热衷于改变宿主的微生物群,让它们与病菌竞争。人们通常认为,摄入益生菌(probiotics,如乳酸杆菌等无害细菌)和益生原(prebiotics,即促进有益菌生长的糖类)可以预防疾病,而且很多人已经在使用酸奶这样的物质来增加体内共生菌的种群数量。但这类抗病策略还没有经过严格测试,无法确定哪种有益菌对人体最有益处,也没有任何人发现哪种细菌能有效治疗已发生的感染。
不过,科学家当前更深入研究的是如何提高人体免疫细胞的抗菌能力。很多免疫增强剂都已广泛用作疫苗佐剂,而且不会产生任何毒副作用。一些生物技术公司开发的用于增强或调节天然免疫反应的新药,也已处于研究初期或早期临床试验阶段。我们不仅可以用这些药物增强其他疗法的效果,还可以用它们来预防甚至治疗主动性感染(active infection)。
在研发这类新药的过程中,最大的难题或许是如何区分有益和有害的炎症反应,因为这类反应的正常作用是召集必要的免疫细胞抵抗入侵病菌,但发炎过度会伤害宿主。不过,目前收集到的证据显示,这个难题有望得到解决。我们与加拿大不列颠哥伦比亚大学的罗伯特·汉考克(Robert Hancock)合作,深入研究了宿主防御性多肽(host defense peptide)。这是一类由先天性免疫细胞为抵抗病菌而分泌的蛋白小分子,它们中的一部分能直接穿过病菌的细胞壁和细胞膜,将这些入侵者杀死,其余的则可作为信号分子,召集免疫细胞前来支援。我们发现的宿主防御性多肽叫做IDR-1,属于信号分子,能促使树突状细胞发出化学信号召集巨噬细胞来对付病菌,却不会诱使树突状细胞释放肿瘤坏死因子α(tumor necrosis factor-alpha)等能引发过度炎症的物质。在动物试验中,IDR-1在消炎的同时,还能加强感染部位的抗感染免疫反应。
既然细菌能操控人类免疫细胞的信号传导,我们也能“以其人之道还治其人之身”。过去20多年里,对于病菌如何致病,科学家获得的相关知识急剧增加,细菌那复杂的致病机理已越来越明了。病菌能随着宿主进化,熟练而精巧地变更“武器装备”,但这不是它们的专利,我们也能不断调整应对策略 。对细菌入侵宿主、躲避免疫追杀机制的研究,还有助于增进我们对于免疫及病理过程的了解。随着对宿主-病原体-正常微生物群间相互作用的了解不断增多,科学家可以设计出新的方案来预防和治疗病菌感染——不过,这些新方法离实际应用还有不小的距离。
请 登录 发表评论