吸血虫疫苗
撰文 帕特里克·斯凯利(Patrick Skelly)
翻译 余路新 李林 高冬梅
审校 汪世平
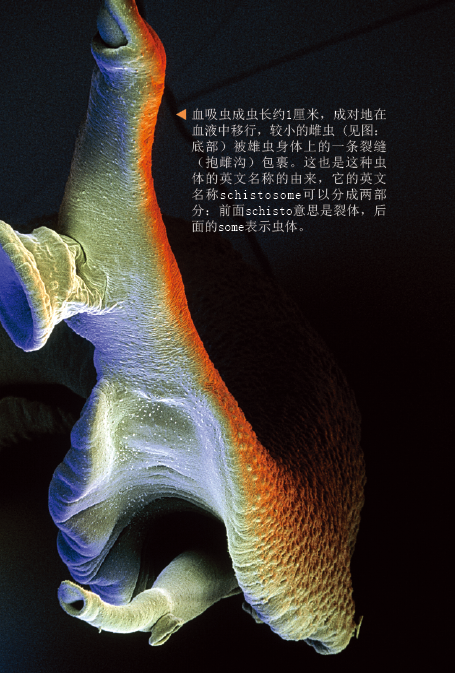
传说吸血鬼没有影子,镜子里也映不出它们的身影——在现代版传说中,照片、影片和视频都无法拍到他们的影像。吸血鬼只是虚构的,而血吸虫却是真实存在的,并有着与吸血鬼相似的行为。作为传染性寄生虫,血吸虫寄生于人体中,并吸食人的血液。世界卫生组织依据致死病人数、慢性伤残人数以及该病造成的社会和经济损失,将血吸虫病列为寄生虫病的第二位,仅次于疟疾。血吸虫悄然感染人类,不会引起明显症状。通过镜头,我们可以捕捉观察到这种生物,但是免疫系统却无法察觉它们的入侵。
有关血吸虫逃避机体免疫的机制,研究人员已进行了多年的研究,并尝试了多种疫苗,希望能够建立一个快速防御机制,使免疫系统迅速扑向并消灭这些寄生虫,从而预防或清除体内已存在的感染。为了在全球范围内清除这种疾病,疫苗是至关重要和必不可少的。但迄今为止,各种试验结果并不理想。不过,包括我在内的一些研究人员感觉,我们已经向成功迈出了第一步:基因组工程学已绘制出血吸虫基因序列的草图,科学家也在发展不同的新方法去探索血吸虫分子层面的秘密。这些研究成果可能增强机体抗血吸虫的免疫能力,并促进疫苗的研究。
掠夺体内营养
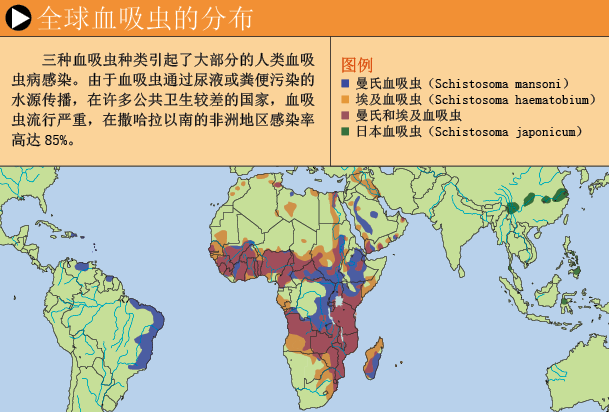
疫苗能有效阻止大量人群感染。全世界约有2亿血吸虫病人,主要生活在热带和亚热带地区,也就是说,血吸虫在大约2亿人的血液里安了家。对于儿童,持续感染血吸虫会导致发育迟缓,引发认知障碍。患者常伴有贫血,并引起消化道、膀胱、脾脏、肝脏等疾病,轻则导致出血性腹泻,重则引发肠出血与肾衰竭,直接危及生命。血吸虫病还能明显降低病人的工作能力,不但破坏病人健康,也影响整个地区的社会经济发展。
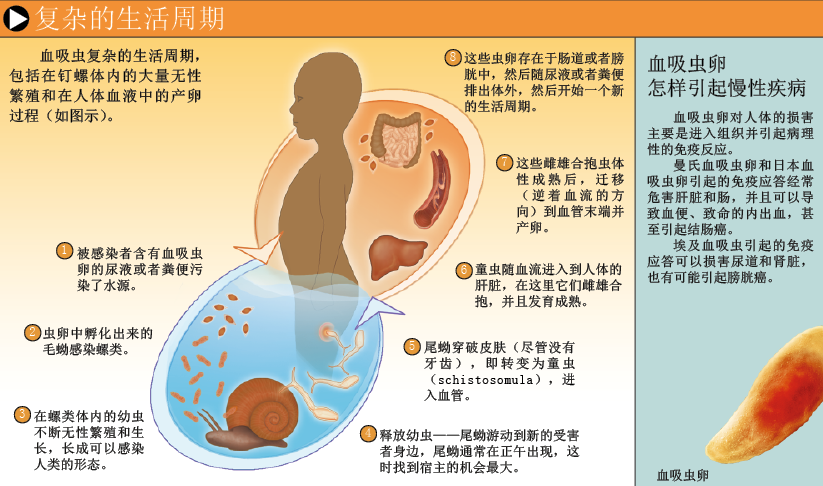
人们因接触水中的血吸虫尾蚴(cercaria,未发育成熟的血吸虫幼体)而感染,即使没有牙齿,尾蚴也能轻易地钻进皮肤并进入血管,在体内发育为成虫。雌雄配对合抱后,雌虫就开始产卵。
血吸虫卵使情况变得更为严重。不同种类的血吸虫每天产卵数量不同,从几十到数千不等,沉积于不同的器官。虫卵会无限制地分泌毒素,甚至达到致死水平。虽然免疫系统不能清除成虫,但能阻止虫卵的致命毒素发生作用,不过要付出惨重代价:该过程促使疤痕组织形成,从而导致器官病理损害。此外,免疫反应还明显有助于虫卵突破血管,使肠壁组织中的虫卵随坏死的组织脱落到肠腔,随粪便排出体外,开始另一个生活周期。埃及血吸虫的虫卵还可以进入膀胱,通过尿液排出体外。在水中,虫卵孵化出毛蚴而感染某些螺类,在螺体内进行无性繁殖,发育成尾蚴,再次感染人体(有关血吸虫生活史方面更详细的内容见第53页图表)。
一些国家通过改进环境卫生和有效控制螺类,较好地控制了血吸虫病。但在许多贫穷的血吸虫病流行地区,连清洁的用水都是“奢侈品”,人群受感染的威胁依然很大。20世纪70年代研究出的一种安全抗血吸虫药物——吡喹酮(praziquantel),副作用少,价格便宜,而且治疗一次就能有效清除血吸虫感染。不过,血吸虫感染复发频繁,人们担心血吸虫会对这种药物产生耐受性。已经出现了一些血吸虫病案例,需要提高药物使用量才能清除这些蠕虫——这或许是耐受性出现的一个征兆。
由于考虑到药物耐受性问题,而且预防始终是最佳治疗手段,医务工作者迫切需要能够对抗血吸虫病的疫苗——如果这样一种有效实用的疫苗能够研制成功的话。通常,疫苗是由死去或灭活的病原体或病原体产生的独特分子(主要是蛋白质)制成的,这些成分能诱导机体产生类似感染一样的免疫反应。免疫系统产生的免疫细胞能够识别疫苗中特定的分子,其中一些细胞能保持对该病原体的免疫识别能力,作为抗原细胞“埋伏”在机体内。当该病原体再次入侵机体时,它们就能快速识别,并引起机体的一系列免疫反应,防止疾病产生。
研究人员并没有预料到,研制这种疫苗会如此困难。这种蠕虫的生命周期说明,该寄生虫应该是一个容易受我们的免疫系统攻击的目标。但事实证明,研制这种疫苗绝不是一件轻松的任务。
游动在体内的敌人
最初,研究人员认为血吸虫容易被机体免疫系统攻击的一个原因是:虫体相对较大,在机体内不易躲藏。人们第一眼看到血吸虫成虫时,常常会感到惊讶。生物工作者对我们人体内存在的细菌和病毒等微生物已经习以为常,它们往往隐藏在细胞内逃避免疫攻击,或者通过快速繁殖超过免疫细胞的吞噬速度:在免疫机制发挥作用的过程中,一个细菌或病毒就可以繁殖数百万甚至数十亿个个体。
血吸虫却与上述微生物完全不同:它们足够大,肉眼可见。一个成虫长约1厘米,从感染之初就一直存在于人体中,几年甚至几十年后,虫体数量都不会有所增长,除非受到了新的感染。
进化为血吸虫选择了一个特别不利的宿主。血液显然不是寄生虫理想的栖息场所。虽然血液富有营养,但也是机体各种免疫反应的主战场。不过不知道什么原因,血吸虫却能避开机体的免疫反应。
除了虫体较大、不增殖的特点外,血吸虫的其他一些特征也表明,在适当的条件下加以诱导,机体免疫系统就会对它们进行识别和应答。机体对血吸虫卵的强免疫反应便是明证。此外,构成血吸虫身体的这些分子自身并没有躲避免疫的能力。英国约克大学的R·艾伦·威尔逊(R. Alan Wilson)及其同事和其他研究血吸虫疫苗的课题小组证实,血吸虫能被高剂量辐射所伤,而动物实验证明,在动物体内死去的血吸虫虫体能引起很强的免疫反应。实际上,这种死虫体就可以看成一种疫苗,能够保护动物免受活血吸虫的再次感染。不幸的是,用同样的方法制备死虫体,对人类进行免疫是行不通的。
不过,上述动物试验让我们看到了希望,可以以虫体的单个特殊分子或挑选出来的一些分子复合物为基础,来大量制备便宜的血吸虫疫苗。理想的血吸虫疫苗对三种常见的人体血吸虫种(曼氏血吸虫、埃及血吸虫以及日本血吸虫)均能起作用。不过目前,科学家们主要集中研究的仅为单一种类的血吸虫疫苗,成功之后才会进一步开发能横扫三种血吸虫的疫苗。
迄今为止,很多种血吸虫分子均可作为血吸虫疫苗的候选分子,但还没发现某一单个分子能引起很强的免疫作用。1987年,法国里尔市巴斯德研究所在埃及血吸虫的一个蛋白质内发现的谷胱甘肽S-转移酶(glutathione S-transferase,Sm28GST),就被证明是有明显免疫作用的一种候选疫苗分子,但目前仍处于Ⅲ期临床试验阶段,这是疫苗大范围生产发放之前的最后一个试验阶段。人们也在寻找更多新的疫苗候选分子。
血吸虫的策略
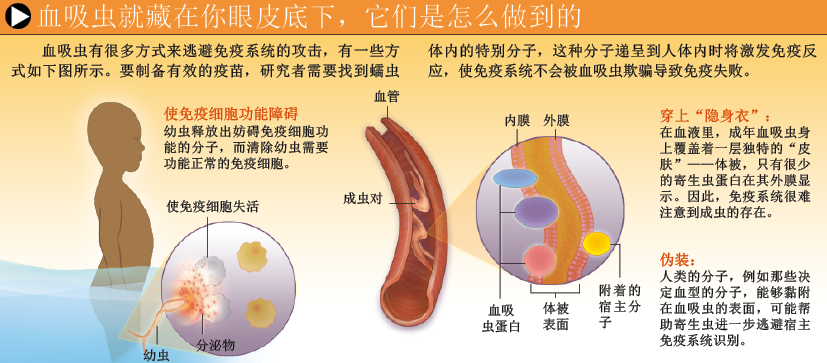
想要成功克服各种困难,开发新的疫苗,了解血吸虫的免疫逃避机制就非常重要。血吸虫有多种方式去应对机体的免疫防御。血吸虫表面覆盖了一系列分子,能够抑制免疫系统,或让免疫系统“变瞎”。美国伊利诺伊大学的卡利亚纳孙达拉姆·拉马斯瓦米(Kalyanasundaram Ramaswamy)和他的同事们发现:至少在试管中,一些血吸虫分子能够抑制免疫细胞的分裂,或诱导免疫细胞死亡。
另外,一些新发现的血吸虫基因与人类免疫细胞内处于活跃状态的某些基因十分相似。其他一些基因编码的受体,或称停泊位点(docking site),与人体内结合细胞因子(Cytokine,能调节免疫细胞活性)和激素(较长距离的细胞间信息传递)等小分子的人类受体密切相关。显然,血吸虫为了在人体内生存下去,它们会抑制信号分子的传递,以阻止机体对感染作出反应。据推测,血吸虫还能利用它们的受体,监测细胞间的微小反应,并在机体产生免疫反应之前,采取相应的逃避措施。
血吸虫还拥有一件“隐身衣”:一层被称为“体被”(tegument)的特殊表皮。大部分寄生虫都覆盖了一层脂膜,除了这层脂膜,血吸虫还通过突变,产生了第二层外膜,增强了自身的“隐藏能力”。当血吸虫在血液中迁移时,体被提供了足够的保护作用。但对科学家来说,血吸虫的体被是非常模糊和脆弱的,这种脆弱性也增加了科学家研究体被生物学特征的难度——例如哪些蛋白位于体被内,其中是否有些突出于体表。而体被内有什么蛋白,正是疫苗设计者所关心的问题,因为几乎所有有效的疫苗均为病原体表面的蛋白或者分子。
据我们所知,在血吸虫体表,不仅有它自身的物质,还包含从血液中获取的人体分子,如血型分子(它们构成了我们所熟知的A、B血型系统)。一种有争议性的观点认为:血吸虫从人体获得的分子,可作为伪装物覆盖于虫体表面,从而让它免受机体的免疫攻击。
人类的策略
几十年来,为了研制出有效的疫苗,撕破血吸虫的“隐身衣”,研究人员一直在用分子生物学等经典方法,分离鉴定血吸虫的每一个蛋白和基因,并仔细研究它们的功能,但这一过程耗时甚长。现在,一些新技术的出现,将加速血吸虫疫苗的研发进度。
如果能了解血吸虫体内的所有蛋白,我们就能发现并破坏血吸虫逃避免疫攻击的生理机制。因此,研究人员迫切希望能破解血吸虫的基因组——编码血吸虫所有蛋白的基因序列。
但科学家要实现这个目标,还存在很大的困难。一方面,血吸虫的基因组很大——超过30亿对核苷酸;另一方面,在科学家研究的寄生虫中,血吸虫的基因是最多的(与间日疟原虫相比,血吸虫的基因至少是前者的10倍)。而且,在血吸虫的整个基因组中,至少有一半的DNA都是“冗余”的,也就是说,它们不编码蛋白质,严重干扰了科学家对基因的分析工作。
然而,由菲利普·T·洛韦尔德(Philip T. Loverde)带领的国际合作组织,最近在美国西南部成立了生物药物研究所,并完成了曼氏血吸虫的基因组测序工作,供所有科学家研究分析。同时,位于上海的中国人类基因组研究中心,已在日本血吸虫的基因组中,找到了绝大部分活性基因。
测定血吸虫所有基因序列,就能让科学家在全部基因的背景下,分析每个基因的功能。例如,我们已经知道,寄生虫的一些蛋白不止一个“版本”,均可用于诱发免疫应答。但某些蛋白质不会引发免疫应答,血吸虫则用这样的蛋白质来执行某些日常生理功能,因此,即便人体的免疫功能是正常的,血吸虫仍能逃脱免疫攻击。通过分析基因组,科学家能鉴定出哪些蛋白会引发免疫应答,并利用这些蛋白研制疫苗,使血吸虫无法逃避免疫攻击。
澳大利亚昆士兰州医学研究院的亚历克斯·劳克斯(Alex Loukas)及其同事,用另外一种方法利用了全基因组序列。他们用特定的蛋白包被全基因组序列,这些由特定基因编码的蛋白,是位于血吸虫体被表面的四次跨膜蛋白(tetraspanin,一类四次穿过细胞膜的蛋白),它由很长的含脂氨基酸组成,可以跨越外膜的油性表面,让两个“蛋白环”暴露于外膜表面。最近,劳克斯小组报道了两种这类蛋白(TSP-1和TSP-2)的研究情况。把它们注射到小鼠体内内,劳克斯发现,小鼠体内的血吸虫及虫卵数量都有减少,尤以TSP-2效果最好,成虫及虫卵数量减少了一半以上。研究小组还发现一些极个别的例子:在对血吸虫具有天然抵抗能力的人的血清中,竟然存在抗TSP-2的抗体。相反,慢性感染者体内则没有这些抗体。结果说明,TSP-2是一种少见的对血吸虫有天然免疫力的成分,该蛋白在疫苗引发的保护性免疫中也可能起着重要作用。
人们可能会怀疑,既然血吸虫本身都不会引发免疫反应,使用疫苗又是否能起到作用呢?劳克斯的研究也解决了这个问题。他的研究证明,在小鼠体内,如果以合适的方式,把这种分子传递到机体的免疫系统,一般都能引发强烈的保护性免疫反应。
在测定血吸虫基因组序列的同时,研究者们还致力于探索寄生虫产生的蛋白的功能。这些信息能够帮助我们确定,哪一种蛋白最适合用于疫苗研究。例如,血吸虫的某些分子可能有助于它们在人体内生存或产卵,若以这些分子作为免疫反应的靶标分子,理论上可对寄生虫产生致死性作用或能减少虫卵的产量。
制备功能卡
我和美国塔夫斯大学康明斯兽医学院的查尔斯·休梅克(Charles Shoemaker)认为,把蛋白分子作为疫苗成分,极具前景。这些蛋白与虫体吸收营养的方式有关。血吸虫寄生在宿主血管中,不仅用口攫取血液,还直接用表皮大量吸取宿主血液中的营养,所以,它们的表皮上需要能吸收营养的蛋白质。显而易见,为了达成这一目标,这些蛋白质必须直接接触宿主的血液。作为潜在的疫苗靶分子,这些虫体表皮蛋白分子很引人注目,因为针对它们的免疫应答,能引起免疫系统对寄生虫的毁灭性攻击(因为这些蛋白质是在它们身体表面),并阻碍它们从血液中吸取养分。
研究人员对蛋白功能的关注,同时也增加了用寄生虫分泌的蛋白来制备疫苗的可能性。这种观点初看起来似乎不明智,对这些分子的直接免疫反应,会使疫苗完全失去攻击目标,因为这些分子会从虫体内游离出来。但是,如果免疫系统的组分结合在这些分子上,并通过这种方法抑制寄生虫的分泌功能,这种疫苗就可能降低虫体的存活或致病力。我们的下一个研究将一次屏蔽一个分泌基因,以鉴定出哪些分子对于血吸虫更重要,寻找疫苗的最佳候选者。
直到最近,传统的基因敲除工具对血吸虫都没有效果。但是,我的实验室和威斯康星大学的蒂姆·芳野(Tim Yoshino)从2006年诺贝尔奖获得者、斯坦福大学的安德鲁·Z·菲雷(Andrew Z. Fire)和马萨诸塞医学院的克雷格·C·梅洛(Craig C. Mello)的著作中借鉴经验,发明了一种屏蔽特定血吸虫基因的成熟方法,这种方法使用了RNA干扰技术。这种方法很快就将派上用场,用以屏蔽分泌蛋白的基因和其他异常的血吸虫蛋白,以探测它们的功能。
随后,疫苗研究者将会用其他方法来为这些蛋白定位,并确定它们是在血吸虫生命周期的哪个阶段产生的。值得注意的是,美国乔治·华盛顿大学的保罗·布林德利(Paul Brindley)、德国杜塞尔多夫大学的克里斯托夫·格雷韦尔丁(Christoph Grevelding)和美国宾夕法尼亚大学的爱德华·皮尔斯(Edward Pearce),正在开发一种蠕虫遗传工程学的研究方法,将特殊标记选择性地添加到一种寄生虫蛋白上。这些标记能让科学家更容易地追踪靶蛋白的产生和定位。该技术的其他优点是,能够用于确定哪些蛋白通常位于外膜并从表面突出。一些研究小组采用了其他策略,比如英国剑桥大学卡尔·霍夫曼(Karl Hoffman)领导的实验小组发明了一种DNA 微矩阵的装置(DNA microarrays,通常叫做基因芯片),该装置能够显示血吸虫各发育阶段,是哪些基因组合在表达。
这些研究血吸虫的新方法,除了能给疫苗研制带来一些益处外,还有其他好处。例如,知道了血吸虫完整的基因组成,将有助于精确定位血吸虫特有的、对存活至关重要的蛋白,并可能发现对这些蛋白起作用而杀死寄生虫、又不损伤患者的药物。不过,制备有效疫苗或药物的技术仍处于研究阶段,科学家能否成功取决于他们的智慧、知识、运气,还与政府投入的资金有关。但让人高兴的是,血吸虫研究者们已经向新的研究领域前进,这些领域仅仅在几年前,还是一片空白。
请 登录 发表评论