基因开关调控物种进化
撰文 肖恩·B·卡罗尔(Sean.B.Carroll)
本杰明·普吕多姆(Benjamin.Prud'homme)
尼古拉斯·贡普勒(Nicolas.Gompel)
翻译 冯志华

乍一看,这像是个动物园——有大象、犰狳、海豚、刺猬、树獭、负鼠、恒河猴、猩猩、黑猩猩及大猩猩各一只,一群或大或小的蝙蝠,几只地鼠外加几条鱼。这些都是我们耳熟能详的动物,但是由这群动物组成的“动物园”,与我们熟知的动物园绝无半点相似之处:这里既没有笼子也没有小摊小贩——事实上,甚至连动物都没有。这只是一个“虚拟”动物园,关在动物园里的仅仅是这些动物的DNA序列——数以亿万计的核苷酸组成的每一个物种的遗传密码。
这个新型分子动物园的参观者中,最兴奋的莫过于进化生物学家了,因为这里存满了有关进化的记录,这些记录非常详尽。数十年来,科学家一直想了解如此丰富的物种多样性是怎样产生的。半个世纪前,我们就了解到,一些机体特征(如肤色和脑容量)改变的根本原因在于DNA的改变。然而,到目前为止,要在海量的DNA序列面前,精确测定哪一段序列的改变赋予了这些动物独一无二的特征,似乎是不可能完成的任务。
为什么苍蝇、鱼类及雀类看起来如此不同,而人类和黑猩猩之间也相去甚远?生物学家们正在破解DNA密码,试图找到产生这些不同的发育指令究竟定位在何处。这一探索让我们看待问题的角度发生了转变。在过去40多年里,研究者们把主要的精力放在了基因上,正是这些核苷酸序列编码了组成蛋白质的氨基酸链。出乎我们意料的是,相关的研究发现,物种表面的差异非常具有欺骗性:外形迥然不同的动物却有非常相似的基因序列。沿循进化的踪迹,科学家在DNA中负责基因“开关”的序列里发现了蹊跷之处:这部分序列并不编码任何蛋白,却肩负着调控基因在何时何处表达的重任。这些“开关”的改变对于解剖学水平上的进化至关重要,同时也为我们透彻理解动物王国形形色色的外观如何进化而来,提供了新颖的洞见。
解剖学和基因编码的矛盾
很长一段时间里,科学家曾非常肯定地认为,动物间解剖学上的差异明确地反映了它们基因组的不同。但当我们对一些哺乳动物(如小鼠、大鼠、犬、人类及黑猩猩)的基因组进行比较时,却发现惊人的相似性。在长达一亿年的进化历程中,每种动物的基因数目(总共约有20,000个基因)以及许多基因在基因组上的相对位置均得以完好保持。这并不是说这些动物的基因数目及位置完全相同,但乍看之下,这些基因组中没有什么明显的东西能让你区分出小鼠、犬或人类。将小鼠和人类的基因组进行比对时,生物学家鉴定出,99%的人类基因在小鼠中都存在相应副本。
换言之,我们人类并不像先前假定的那样,比我们身边的宠物、家鼠、家畜甚至河豚(puffer fish)有着更多的基因。或许这挺让人失望,但我们必须要接受这一事实。
生物学家在细节上审视动物的单个基因时,发现物种间依然具有很高的相似性。同一基因序列的任意两个版本及编码的蛋白质,通常具有一定程度的相似性,这种相似程度可简单反映这两个来源于同一祖先的物种在进化的路途上分道扬镳的相对时间。在考虑与机体构造及身体形态相关的基因时,这些编码序列(coding sequence)在进化历程中的保存情况令人尤为迷惑。
从受精卵到成体的发育过程中,仅有一小部分基因(不到10%)与动物的机体构造和身体形态相关,其余的则与各种器官和组织细胞的日常工作有关。动物间解剖学水平上的差异(机体组成的细胞数量、体积、外观、颜色的差异),在某种程度上必定涉及一些与机体构造相关的基因。实际上,基因与解剖特征发育有机联系的过程,在进化中扮演了关键角色。这方面的研究逐渐形成了一门学科——进化发育生物学(evo-devo)。在不同物种间,相对于其他类型的蛋白,机体构造相关蛋白在平均水平上更具有相似性。这一发现引起了一些从事该领域研究的专家(包括我们自己)的极大兴趣,因为这似乎呈现出一种悖论:一些有着天壤之别的动物——如小鼠和大象,它们的外形差异极大,但调控外形的蛋白质却非常相似。同样的现象还发生在人类及黑猩猩之间:大多数蛋白质的差异仅仅来源于一两个氨基酸,而蛋白质中包含了数百个氨基酸;还有 29%的人类蛋白在序列上与黑猩猩完全一致。我们如何解释进化在蛋白和解剖结构两个层面上的差异呢?在所有的基因组DNA中,一定在某处存在一些由进化所致的、有意义的差别。关键在于发现这些差别,而发现这些差别的诀窍则在于确定从何处入手。事实上,定位这些差别远比定位基因本身困难得多。
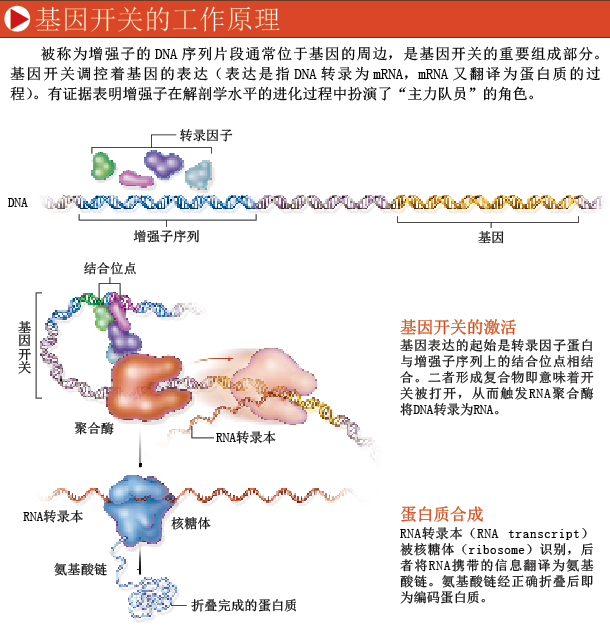
基因开关
在人类基因组中,编码蛋白质的部分仅占1.5%左右,这些基因就像DNA序列海洋中为数不多的信息孤岛。对于剩余的众多非编码DNA的功能,我们知之甚少,但其中一些在调控基因表达的过程中发挥了重要的作用。这些调控序列就是进化的关键所在。
基因表达是指DNA序列转录为信使RNA(messenger RNA,简称mRNA),再由mRNA指导蛋白质合成的过程。大多数基因的表达调控是在转录时进行的——细胞不会浪费能量来产生它们不需要的mRNA和蛋白质,因此许多基因仅在特定的器官、组织或细胞中表达。在指导基因何时何处表达方面,某些非编码DNA序列起着主要作用,它们是基因开关的组成部分,负责在正确的时间和地点打开或关闭机体内的基因。一些名为转录因子(transcription factor)的蛋白能够识别DNA上被称为增强子(enhancer)的特异序列并与之结合,它们是基因开关的另一组成部分。转录因子与增强子在细胞核内的结合,决定了这个细胞内基因开关的打开与关闭。
每个基因至少包含一个增强子。基因的编码区很容易鉴别出来,因为基因编码遵循的“语法”相当简单。但与基因不同,增强子无法仅仅通过DNA序列来识别,必须通过实验加以证实。通常增强子包含数百个碱基对(base pair),既可以定位于基因的任意一端,也可以定位在基因中间的非编码区里。有时增强子序列与基因本身甚至间隔数千个核苷酸。
对于我们的讨论来说,特别重要的一点是,一些基因存在许多独立的增强子。其中一部分基因尤其如此,这部分基因编码形成的蛋白质,构成了动物的解剖特征。在机体的不同部位及动物生命周期的不同阶段,每一个增强子均独立地调控基因的表达,一个基因的完整表达是多个独立控制的表达位点共同完成的。这些增强子可使同一个基因在不同的环境下多次被利用,极大扩展了单个基因的功能多样性。
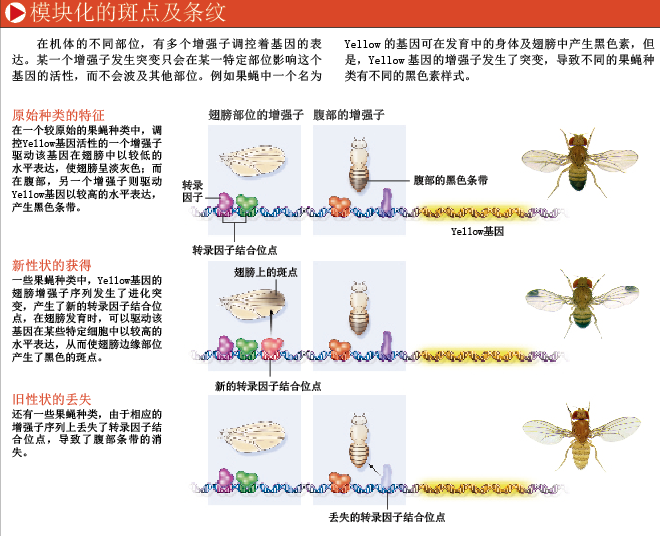
果蝇中一个负责调节机体颜色的基因就充分显示了基因调控系统的模块化逻辑(modular logic)。该基因被命名为Yellow(Yellow意为黄色,在某种程度上,这是个让人迷惑的命名:Yellow基因编码一种蛋白,可促进黑色素的形成,如果该基因发生突变而没有这种蛋白,果蝇则呈现出黄色)。Yellow基因有数个彼此分开的独立增强子,在果蝇机体的不同部位(如翅膀和腹部)发育时,该基因可被增强子激活。
由于Yellow基因在果蝇很多组织发育时都会发挥作用,因此,如果这一基因的突变导致蛋白功能改变或失活,对果蝇来说将是灾难性的。这些突变会影响整个机体的Yellow色素蛋白的功能。相反,如果突变仅仅发生在Yellow基因的一个增强子上,那么受波及的仅是这个增强子的功能以及受该增强子调控的Yellow基因表达,而在其他组织中,该蛋白的表达和功能则不受影响。
身体形态相关基因的模块化调控在进化上具有深远意义。理论上说,增强子发生突变,能够在不改变基因或蛋白本身的情况下,选择性地改变个体某一性状。在过去数年间,已经有直接的证据显示,采用这种方式产生的机体结构及模式的进化发生频率相当高。
基因开关的进化
了解一种生物学现象的最重要的策略之一就是,鉴定出这一现象的最简单实验模型。对于身体形态的进化,机体颜色模型就满足这一要求。机体颜色是动物身上最为显著的特征之一,在动物适应环境和彼此识别沟通中扮演了主要角色。在亲缘关系很近的果蝇当中,机体颜色的多样性进化迅速。果蝇是如何获得这些斑点和条纹的呢?分析这一问题可向我们展示,基因开关的进化为何能够导致解剖学水平的进化,以及这一过程是怎样发生的。
在一些果蝇种类中,雄性个体在翅膀边缘存在较为密集的黑色斑点,另一些种类却没有这些斑点。在同一种类中,一些雄性腹部还呈现出较深的黑色,该特征也是这一最著名果蝇种类——黑腹果蝇(drosophila melanogaster,melanogaster意为“黑色的腹部”)名称的由来,其他种类的雄性个体则缺少这些黑带。有斑点种类的雄性个体在向雌性求欢时,一边殷勤地跳舞,一边还会炫耀这些黑色的斑点。我们发现,在这些有斑点的果蝇种类中,翅膀边缘细胞中Yellow蛋白表达水平较高,这也是斑点产生的原因;在翅膀其他部位的细胞中,Yellow蛋白的表达水平则较低。而在无斑点的种类中,Yellow蛋白在所有翅膀细胞中的表达水平都较低,故而仅产生淡淡的一层黑色素。
为了弄清楚Yellow蛋白怎样做到只在某些种类身上表达而不在其他种类身上表达,我们通过搜索Yellow基因周围的DNA序列,检测了调控果蝇身体不同部位Yellow基因表达的增强子。在无斑点种类中,存在一种增强子,可以驱动Yellow蛋白在果蝇翅膀中以较低且均一的水平表达。该增强子的活性使果蝇翅膀呈现淡灰色。对有斑点种类的相应DNA片段进行分析时,我们发现,这一增强子同时驱动低水平模式和密集斑点模式两种基因表达。那么在有斑点种类的进化过程中究竟发生了些什么?原来,Yellow基因的增强子序列进化出了新的转录因子结合位点(binding site)。在不改变Yellow蛋白合成部位,亦不影响该蛋白在机体其他部位发挥功能的同时,这些突变创造了一种新的表达模式——翅膀上的斑点(见上部图表)。
腹部黑带的进化与前文述及的内容相似,但掉转了方向。当观察到一物种具有某种特性,而与其有亲缘关系的另一物种却缺失了这一特性时,我们会很自然地倾向于认为这种特征是前一物种在进化中获得的,但事实并非总是如此。某些特性的丢失虽是进化的次要方面,没有受到重视,但也是十分常见的现象。机体特性的丢失或许最能反映,为何增强子的进化更有可能是解剖学水平上的进化之路。
Yellow基因的一个增强子负责调控该基因在果蝇腹部的表达。在有黑带种类的雄性个体中,这一增强子驱动Yellow基因在果蝇后腹部的细胞中以较高水平进行表达,但有一些种类——如吉川氏果蝇(drosophila kikkawai)——在进化的过程中,丢失了腹部的色素沉着。在吉川氏果蝇中,一个小突变破坏了一些转录因子结合位点,因而增强子无法再驱动Yellow基因在果蝇后腹部以较高水平进行表达。
必须强调的是,Yellow基因在机体的其他部位仍有活性,它的生化功能依然完整无损。尽管通过突变使Yellow基因及蛋白本身失去活性,也会使腹部黑带消失,但这条进化之路无法通过自然选择的考验,因为在机体的其他部位,Yellow基因功能的失活有可能导致另外一些有害的后果。
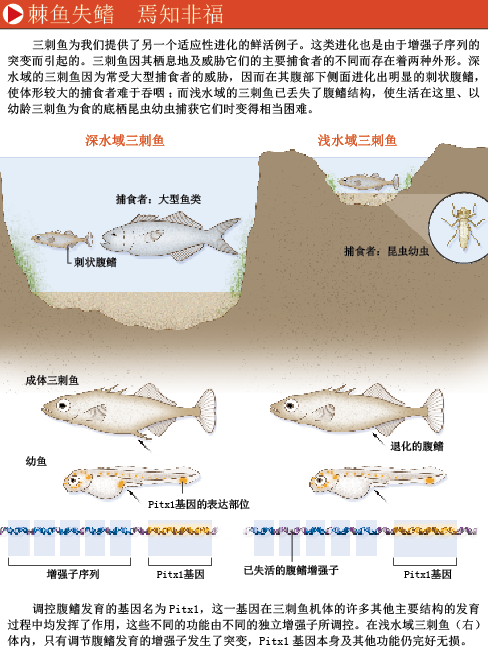
某些特征的丢失会使物种拥有或失去生存繁殖的优势,但是另一些特征的丢失则是适应性的结果,因为这促进了物种生活方式的改变。一些脊椎动物(如蛇、蜥蜴、鲸以及海牛)为了适应不同栖息地和运动方式,在进化过程中曾经多次丢失过它们的后肢(hind limb)。四足脊椎动物(four-legged vertebrate)的后肢在进化上的祖先是鱼类的腹鳍(pelvic fin)。在种属关系很近的鱼类之间,腹鳍的解剖学结构也进化出了许多分支。北美大陆的许多湖泊中,存在两种外形的三刺鱼(three-spined stickleback)。一种是开放水域外形(open-water form),具有完整的刺状腹鳍(pelvis);另一种是浅水域的底栖外形(shallow-water, bottom-dwelling form),具有高度退化的腹鳍及萎缩的突刺(spine)。在开放水域,较长的突刺有助于保护鱼类免遭较大捕食者的吞噬,但是在浅水域的湖底,这样的突刺则是碍事的东西,因为以幼龄三刺鱼为食的蜻蜓幼虫可以抓住突刺而将它捕获。
从上一个冰期开始,在此后短短一万年里,三刺鱼经过不断的重复进化,形成了腹鳍形态学上的差异。长突刺的海生棘鱼(oceanic stickleback)扩展到许多湖泊中定居繁殖,突刺及腹鳍退化的三刺鱼也历经数次独立的进化。由于这些鱼类具有很近的亲缘关系,并在实验室中进行了种间杂交(interbreed),遗传学家已经找到与三刺鱼腹鳍退化有关的基因。美国斯坦福大学的戴维·M·金斯利(David M. Kingsley)与加拿大不列颠哥伦比亚大学的多尔夫·施吕特(Dolph Schluter)及其同事共同研究显示,一些涉及腹鳍形成的基因表达水平的改变与腹鳍退化有关。与其他大多数机体构建基因相似,Pitx1基因在鱼类的发育过程中承担了多种任务。该基因的表达在鱼类的某些部位选择性失活,从而使腹鳍出芽并产生突刺。这一进化上的改变背后同样有增强子突变的身影。在不同类型的三刺鱼之间,Pitx1蛋白的编码区域并未发生任何改变。
Yellow、Pitx1及其他绝大多数机体构造和身体形态基因被认为是一些多效基因(pleiotropic genes),因为它们影响着物种多个性状的形成及外观。某个多效基因的编码序列发生突变会对由该基因调控的所有性状产生多方面的影响,这种过于剧烈的改变让物种不太可能通过自然选择的考验。以上谈及的斑点、条带以及骨骼的进化留给我们的关键提示是:调控序列的突变可以规避编码序列突变导致的多重负面作用,使机体的一些个别组成部分进行选择性调节。调控序列发生突变并不是唯一的进化模式,不过当一个基因有多种功能,需要选择性对其中一种功能进行改进时,就很可能采取这种方式。
相同的基因,无穷的变体
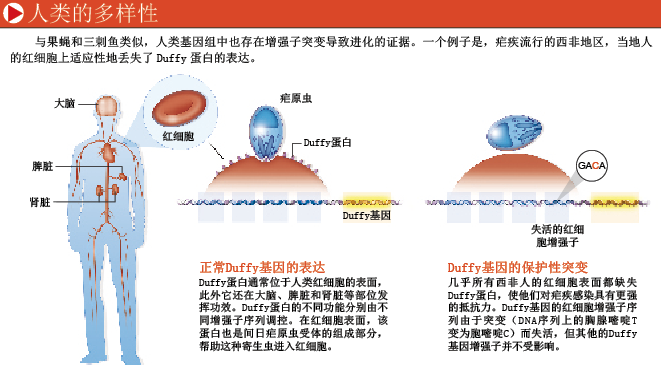
增强子的进化并不仅局限于影响机体外形的基因,也不是只在果蝇和三刺鱼等物种中发挥作用。调控序列发生进化性突变,从而影响基因表达,这样的例子在人类身上也屡见不鲜。
在人类进化的历史中,一个突出的例子是,在一些疟疾流行地区,选择性地使某一基因表达失活,可以使当地人对这种疟疾横行的环境产生适应性。除了人们熟知的A、B、O等血型,研究者还对一些稀有血型(minor blood types)进行了深入研究。其中一种稀有血型系统的特征是,红细胞表面存在一个名为Duffy的蛋白。导致人体患上疟疾的间日疟原虫(plasmodium vivax)需要通过一种受体(receptor)来感染人体红细胞,Duffy蛋白正是这种受体的组成部分。几乎所有西非地区居民的红细胞上,这种蛋白的表达都是缺失的,这使他们免遭疟疾感染。但与此同时,Duffy基因在机体的其他一些组织中(包括脾脏细胞、肾脏细胞及脑细胞中)却有表达。在非洲人的其他组织中,Duffy基因的表达得以保留,这丝毫不令人吃惊。因为在红细胞处不表达Duffy基因的个体,在Duffy基因的增强子处携带了一类突变。这类突变破坏了前体红细胞中一个可激活Duffy蛋白表达的转录因子的结合位点,但对机体其他组织中Duffy蛋白的产生并无影响。
美国杜克大学的格雷戈里·A·雷(Gregory A. Wray)与其合作者研究了人类其他方面的进化例子,这些生物学上的进化都是通过各种人类基因中增强子的突变产生的。对巨猿和人类共有的基因调控序列差异性的研究,是他们的研究中最让人感兴趣之处。该调控序列调节的是强啡肽原(Prodynorphin)基因,编码一组小分子阿片蛋白(opioid protein),主要产生于脑部,与感觉、行为及记忆相关。响应同样的刺激(stimuli)时,人类强啡肽原基因的表达水平远高于黑猩猩体内的同样基因。这是一个有力证据,表明人类中该基因的调控序列在自然选择的压力下发生了进化——也就是说,这种性状得以保留是因为它是有利的。
DNA调控序列发生的突变在人类进化过程中的作用毋庸置疑,此外调控的多变性还可能是个体间体格和健康差异的重要原因。由于科学家无法像对待果蝇和鱼类那样操作活人的DNA,因此目前发现的一些基因组分析新方法虽然令人欢欣鼓舞(见上方文本框),但在研究到底是哪些DNA调控序列发生突变使人类与其他物种产生差别时,仍然存在诸多困难。
有关DNA调控序列的进化研究仍处于蹒跚起步阶段。虚拟动物园中的各个基因组中,都有成百上千的基因开关等待我们进行深入发现和研究。现在生物学家已拥有了照亮未来研究方向的指路明灯:相对基因本身的突变而言,基因增强子的突变更有可能导致解剖学水平的进化,对于那些多效基因来说尤其如此。
这一现象还揭示,如此多样化的动物群体如何共享绝大多数机体构造和身体形态基因(该现象与科学家过去的预期恰好相反)。这些赋予动物不同外形的基因在何时及如何发挥作用,这个问题是目前的重要研究内容。是什么使人类形态不同于其他的类人猿,抑或为何大象与老鼠体形相差甚远?关于这一问题,对单独基因和蛋白进行研究并不能提供大多数的信息。相反,真正的答案隐藏在基因组内那些仍然有待探索的崭新领域之中。
请 登录 发表评论