遥控大脑
撰文 杰罗·米森伯克(Gero Miesenbock)
翻译 冯泽君
1937年,英国牛津大学的神经科学家查尔斯·斯科特·谢灵顿(Charles Scott Sherrington,1932年诺贝尔生理学或医学奖获得者)曾对大脑的工作原理做过经典描述。在他的想象中,神经元活动时会发光:人们入睡后,只有极少数神经元在发光;而在清醒状态下,大脑就像“在举行宇宙舞会的银河,上千万个光点在其中迅速穿梭,织成一张不断变换的光网,协调着大脑各区域间的联系”。
谢灵顿可能并未意识到,这一诗意十足的描述中,包含着一个非常重要的科学观点:让神经元发光,就可以直接观察大脑的运作机制。实际上,神经元如何产生意识与行为,一直是生物学界公认的大难题,因为科学家无法观察整个神经回路的运作。目前常用的研究方法,是用电极记录少数神经元的活动,得到的试验数据也仅是冰山一角,不能反映整个神经网络的活动情况。如果我们能“看到”神经元间如何联系,也许就能推测出神经回路如何形成、大脑如何工作。对于神经科学家而言,“直接观察神经元”颇具诱惑力,并开始尝试把谢灵顿的想象变成现实。
科学家的不断尝试,催生了一门新学科——光遗传学(optogenetics),即将基因工程与光学结合起来,研究特定类型的细胞。目前,科学家已将多种细胞的活动变得可视化,甚至还能用光遥控神经元。这些成果展示了光遗传学的光明前景:它不仅能让神经科学家用肉眼观看整个大脑的神经回路,还能帮助医生为病人治病。

合成神经染料
上世纪70年代,科学家开始尝试将谢灵顿的梦想变为现实。神经系统就像电脑,有电才能工作。神经元将信息编码成电信号[即动作电位(action potential),电压不到一节5号电池的1/10],这些信号会促使神经元释放神经递质(一种化学信号分子),激活或抑制回路中与自己相连的另一个神经元。为了能“看见”这些电信号,美国耶鲁大学的劳伦斯·B·科恩(Lawrence B. Cohen)测试了很多荧光染料对电压变化的敏感性(电压发生变化,染料就会变色)。最后,他找到了一些具有电压敏感性的染料,只要用这些染料给神经元着色,就能在显微镜下观察神经元的活动。
除了电压,神经元内离子浓度的变化也能使荧光染料的颜色发生改变。神经元产生动作电位时,膜上的钙离子通道会打开,让钙离子流入神经元内,促进神经递质的释放。1980年,美国加利福尼亚大学圣迭戈分校的钱永健(Roger Y. Tsien,2008年诺贝尔化学奖得主)开始合成对钙离子浓度敏感的染料,它的荧光强度会随钙离子浓度的变化而变化。在神经学领域,这类染料的合成具有重大意义,为研究单个神经元或小型神经元网络信息处理过程开辟了新的途径。
但合成荧光染料有个严重缺陷:神经组织中有多种神经元——据估计,小鼠大脑中含有数百种神经元,还有数不清的支持细胞(support cell,主要为神经元提供支持、供给营养、维持环境恒定),而神经系统处理信息的基础,正是不同神经元间的相互作用。因此,要了解一个完整神经回路怎么工作,就得将回路中的不同神经元区分开来,并监控每个神经元放电的时间。然而,科学家利用合成染料染色时,所有神经元都被染上同一种颜色,无法区分不同类型的神经元。

荧光蛋白
科学家意识到,利用基因工程方法可以解决合成染料无差别染色的问题——正是这一想法,催生了光遗传学这门新学科。人体内每个细胞都有一套相同的基因,但不是每个基因都会表达,细胞间的差别就是基因表达差异造成的。在合成神经递质多巴胺时,多巴胺能神经元(即释放多巴胺的神经元)需要一系列蛋白酶,因此在这类神经元中,编码相应蛋白酶的基因处于活跃状态,而在其他细胞中,虽然也存在相关基因,但不会表达。
从理论上来说,如果把控制多巴胺合成的基因开关和编码染料的基因连接起来,再通过基因工程方法转入动物体内,那么在不计其数的动物细胞中,就只有多巴胺能神经元可以制造染料。当科学家观察动物的大脑时,将看到多巴胺能神经元发出的荧光,从而将它们与其他神经元区别开来。更重要的是,科学家还可以在活体动物上进行观察。合成染料无法实现这一点,因为它不受基因开关的控制,不能在特定细胞中表达。因此,染料必须由基因编码——也就是说,染料必须是一种蛋白。
10年前,我和钱永健、加利福尼亚大学伯克利分校的埃布德·Y·伊萨科夫(Ehud Y. Isacoff)、现任职于耶鲁大学的詹姆斯·E·罗斯曼(James E. Rothma)分别带领各自的研究小组证实,基因编码的蛋白荧光染料的确可以反映神经元的活动。我们使用的染料基因都来自发光海洋生物,比如能合成绿色荧光蛋白的水母。在实验中,我们对染料基因进行了一些修饰,让它们的蛋白产物能检测并显示细胞内电压、钙离子浓度和神经递质释放情况的变化,因为这些细胞参数能反映细胞间信号传递状况。
实验取得初步成功后,我们又开始培育一些特殊的动物:在它们体内,只有特定神经元可以合成荧光蛋白。为了培育出这样的动物,我们试用了线虫(worm)、斑马鱼(zebra fish)、小鼠等多种动物,最后发现果蝇(fruit fly)最有可能成为理想的动物模型:果蝇大脑小巧、结构紧凑,在单一显微镜视野下,就能观察整个神经回路;改造果蝇基因的难度较低,因为在此之前,科学家已研究果蝇上百年,鉴定出很多可用于特定神经元的基因开关。正是在果蝇的大脑中,我和明娜·额(Minna Ng)、罗伯特·D·罗尔达(Robert D. Roorda)拍摄到了第一张神经信息在特定神经元间传递的照片。当时,我们都任职于美国纽约的纪念斯隆-凯特琳癌症中心(Memorial Sloan-Kettering Cancer Center in New York City)。凭借这些图片,我们发现了新的神经回路结构及其运作机理。去年,我们发现,果蝇的气味信息处理回路会给神经系统制造“背景噪音”,我们推测这是为了放大微弱的输入信息,提高果蝇对气味的敏感度,从而更有效地寻找食物。
荧光蛋白已成为研究神经元交流的强力工具,但在上世纪90年代,我们还面临一个难题:多数研究方法都不能直接观测神经活动。通常,科学家在目标脑区插上电极,再让受试者看图片、听声音或闻气味,以刺激大脑作出反应,最后用电极记录到的神经信号来构建信号通路。但在传递过程中,神经信息会不断地被重构,离信息输入处(眼睛、耳朵和鼻子)越远,越难分析记录到的反应代表什么信息。而且,上述研究方法不适用于感觉信息处理回路外的其他回路,比如运动、思想和情绪回路,因为感觉刺激不能直接激活这些回路。
光控神经元
如果可以不通过外界的感觉刺激而直接激活特定神经元,也许能解决这一问题。我们想到,能否开发一种既能监测神经元活动、又能激活特定神经元的“工具包”呢?
我和我指导的第一位博士后、现任职于霍华德·休斯医学研究中心的博里斯·V·泽梅尔曼(Boris V. Zemelman)开始解决这一难题。我们认为,如果能构建出由基因编码的光控蛋白启动元件,就可以克服电极记录法遇到的困难:在实验动物的大脑上,研究人员一般只能插上少量电极,能够监测或刺激的神经元很有限;普通电极难以锁定特定神经元,而且由于电极必须固定,研究人员无法记录活体动物大脑内的电信号。
如果我们能利用基因开关寻找特定神经元,并用光线控制这些细胞,就不必事先知道它们位于大脑中的哪些区域,即使它们的位置随动物的活动而改变,也不会影响我们的观测。
只要刺激含有蛋白启动元件的神经元能引起动物行为的改变,就说明这些神经元所在回路与行为的改变有关;与此同时,神经元被激活时会发出荧光,暴露它们在神经系统中的位置。设想一下,如果每个实验动物都有一类细胞含有蛋白启动元件和染料基因,通过多次重复实验,我们就能弄清楚神经活动与行为改变间的关系、神经信号的传递顺序,并鉴别出控制行为改变的神经回路的所有“成员”。但要实现这个设想,我们得构建一个能接受光能、并将光能转化为神经冲动的蛋白启动元件。
要寻找这样的蛋白,首先应从对光敏感并能将光信号转化为神经冲动的细胞着手,比如我们眼睛里的光感受细胞就含有光能“接收器”——视紫红质(rhodopsin)。这种物质吸收光能以后,将改变细胞膜上离子通道的闭合状态,从而影响离子流向,产生电信号。我们把编码视紫红质的基因(还有一些辅助视紫红质发挥功能的必需基因)转入了体外培养的神经元。利用这个“简单装置”,我们就能检测含有外源基因的神经元能否在光照下产生动作电位。2002年初,我们的实验成功了,第一个蛋白启动元件问世。
会飞的无头果蝇
最近,科学家还找到一些对光敏感的蛋白来合成蛋白启动元件,比如视网膜细胞中的黑视素(melanopsin),这种蛋白能让人体生物钟与地球自转周期同步。德国马普生物物理研究所的格奥尔格·内格尔(Georg Nagel)、美国斯坦福大学的卡尔·德塞罗斯(Karl Deisseroth)和凯斯西储大学的斯特凡·赫利策(Stefan Herlitze)发现的另一种光敏蛋白ChR2(channelrhodopsin-2,能帮助藻类植物确定游动方向),也很适合用作蛋白启动元件。我和伊萨科夫以及他的同事理查德·克雷默(Richard Kramer)、德克·特劳纳(Dirk Trauner)也合成了多种能被光敏化合物激活的蛋白启动元件。
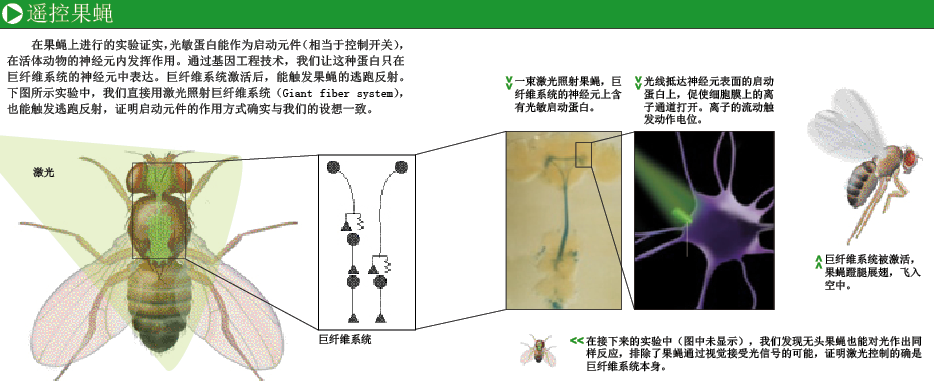
接下来的工作,就是验证上述蛋白启动元件能否用在活体动物上。我把这个任务交给我的研究生苏珊娜·Q·利马(Susana Q. Lima)。我们首先把果蝇大脑内的一个简单回路作为实验对象。这个回路仅由几百个神经元组成,与果蝇的逃跑反射有关——一旦感受到空气流动,果蝇立即振翅起飞。果蝇大脑内约有15万个神经元,而触发逃跑反射一系列动作的,仅是其中两个(即指令细胞)。这两个神经元会发出指令,激活次级神经回路中的细胞(动作模式发生细胞),指挥腿部和翅膀肌肉的运动。
我们发现,在指令细胞和动作模式发生细胞中,都存在一种特有的基因开关。于是,我们对两组果蝇进行了基因改造,其中一组的指令细胞会合成对光敏感的蛋白启动元件,而在另一组中,则是动作模式发生细胞产生启动元件。当我们用能穿透动物表皮,直抵神经系统的激光照射果蝇时,两组果蝇都飞了起来!这一结果证实,指令细胞和动作模式发生细胞都参与了逃跑反射,同时也证明蛋白启动元件起作用的方式与我们预想的一致。由于只有含有蛋白启动元件的细胞才能接收光刺激信号,因此我们不需要把激光对准特定细胞。这就好比我们向某地区15万户家庭发送无线电波,只有购置了接收器的家庭才知道电波内容,而其他人什么也不知道。
然而,这个实验还存在一个问题:启动逃跑反射的指令细胞也会接受视觉信号。当光线突然变暗时,果蝇收集到的视觉信号就会触发逃跑反射。在实际情况中,这可能代表逼近的掠食者投下的阴影。(这很容易理解,想想看,每当你试图拍打苍蝇的时候,它是不是总能很快察觉,拍拍翅膀飞走?)因此,我们担心激光也可能是通过视觉途径引起逃跑反射,而不是通过直接控制指令细胞或动作模式发生细胞来实现的。
为了排除这种可能,我们又进行了一个简单而残忍的实验:切去果蝇头部。没有头的果蝇还能存活一两天,躯干中的胸神经中枢类似于脊椎动物的脊髓,里面还保留着完整的动作模式发生回路。用激光照射这个回路,无头果蝇也飞了起来。尽管飞得跌跌撞撞,但有力地证明激光可以控制动作模式发生回路,因为无头果蝇没有其他方式来接受光线了。(无头果蝇笨拙的飞行,也生动说明莱特兄弟的发明之所以称得上伟大,是因为他们创造了受人控制的动力飞行装置,而不仅仅是简单的动力飞行装置。)
我们还培育了一种基因工程果蝇,在它们体内,只有能分泌多巴胺的神经元才具有对光敏感的蛋白启动元件。当我们用激光照射这些果蝇时,它们突然活跃起来,在巢穴附近不停乱蹿。曾有研究表明,多巴胺可以帮助动物预计可能得到的奖励或受到的惩罚,因此我们观察到的现象或许可以这样解释:在光的照射下,果蝇对收获和损失的预期发生变化,开始以不同的“心态”探索周围环境。

控制动物
我们把上述实验结果整理成论文,投往《细胞》杂志。在论文正式发表的3天前,我飞往洛杉矶举行一个讲座。一个朋友曾送给我一本汤姆·沃尔夫(Tom Wolfe)的最新成长小说《我是夏洛特·西蒙斯》(I Am Charlotte Simmons),他认为这本书肯定会引起我的兴趣,因为书里不仅对神经科学家作了详细描述,还赢得了由英国《文学评论》杂志(Literary Review)评出的“小说类最糟性爱奖”(Bad Sex in Fiction Award)。当我在飞机上阅读这本小说时,其中一段描述的确引起了我的注意:在一个讲座上,主人公夏洛特介绍了一个名为何塞·德尔加多(José Delgado)的西班牙人,他能遥控动物行为,不过用的不是光控蛋白启动元件,而是事先在动物大脑中植入的电极,用无线电信号遥控动物。为了证明自己的方法能控制一头发怒的公牛,德尔加多甚至拿自己的生命做赌注。夏洛特还在演讲中声称,德尔加多的研究是神经生物学的转折点,彻底否定了二元论(dualism)——该理论认为,意识独立于大脑的存在。如果德尔加多对大脑的生理控制能改变动物的意识,那么两者必定是同一种存在。
看到这里,我兴奋得几乎从座位上跳起来。何塞·德尔加多是沃尔夫虚构的,还是确有其人?一下飞机,我就上网搜索,结果找到一张拿着遥控器的斗牛士以及他与斗牛的合照。我了解到,何塞·德尔加多曾是耶鲁大学的一位教授,他的研究就是在我们研究所展开的,算起来还是我的前辈。1969年,德尔加多还出版过一本书,名为《意识的生理控制:迈向心理文明社会》(Physical Control of the Mind: Toward a Psychocivilized Society),他在书中阐述了他为实现控制动物行为、唤起动物记忆与想象、激发愉悦与疼痛而作出的种种努力。在书的结尾,德尔加多讨论了控制大脑可能对医学、伦理学、社会学以及战争造成的影响。正是因为有了这些背景资料,我们的文章在《细胞》上发表当天,一位美国记者打电话问我:“什么时候才能遥控‘果蝇部队’进攻其他国家?”时,我才没有表现出特别的惊讶。
不过媒体的关注并没有就此止步。第二天,美国德拉吉报道网登出头条新闻——《科学家制造出遥控果蝇》,引起的轰动程度甚至盖过歌星迈克尔·杰克逊出庭的新闻。大约一周后,在晚间访谈节目《今晚秀》(the Tonight Show)上,美国名嘴杰伊·莱诺(Jay Leno)遥控一只果蝇,让它飞进了布什总统的嘴里——这是我们发明的新技术的首次应用,创意大概就来自德拉吉报道网的新闻。
此后,科学家开始利用光控元件控制动物的其他行为。2007年10月,德塞罗斯和同事路易斯·德莱塞亚(Luis de Lecea)发表了小鼠实验的结果。他们利用光纤直接照射小鼠分泌下丘脑分泌素(hypocretin,一种神经信号)的神经元,观察这些神经元能否调节睡眠。研究人员曾发现,缺乏下丘脑分泌素受体的犬类成天昏昏欲睡,因此认为下丘脑分泌素具有调节睡眠的功能。实验结果显示,激活脑内分泌下丘脑分泌素的神经元,会使已睡着的动物清醒过来,这一结果支持了先前的推测。
在耶鲁大学的实验室里,我的博士后迪伦·克莱因(Dylan Clyne)用蛋白启动元件研究行为的性别差异。多数雄性动物在追求异性时会不遗余力。雄果蝇会不停振动一只翅膀,用振动出的“旋律”来吸引雌性。为了研究雄性的这种行为如何产生,克莱因通过光线照射,来激活产生这一行为的动作模式发生回路。结果发现,雌性也具有这一回路,只是在正常情况下,它们不能发出激活这一回路的神经信号。克莱因的发现说明,雄性和雌性的神经回路基本一致,性别差异的出现是由于某些启动开关只存在于一种性别的动物体内。
光遗传学疗法
在研究中,很多科学家一般只向神经元转入染料基因和启动蛋白基因中的一种,但事实上,我们完全可以同时转入这两种基因。未来,我们希望能向大脑转入更多的染料基因和启动蛋白基因,这样就能在同一个体上同时研究各种类型的神经元。
我们对神经回路的最新认识,为基础研究创造了很多机会。那么,这些认识有没有实际应用价值呢?或许是有的,不过我觉得这一点已被媒体宣传得有点言过其实了。德尔加多鉴定出了一些大脑区域,控制这些区域内的神经元,能改善多种疾病——比如运动失调 (比如利用深度大脑刺激来治疗帕金森病)、情绪和行为失常等的临床治疗效果。他认为,这些方法是现有医疗手段的延伸,不应该陷入“意识控制”的道德泥沼中。确实,要在基因治疗和药物治疗之间画一条明确的界线本身就很武断,因为这就像在忙碌一天后,你选择用精神药物,还是鸡尾酒来放松一样。从理论上说,基因技术比普通药物的作用目标更明确,剂量更精确,副作用也更少。
目前,已经有人把光遗传学应用于医疗领域。2006年,研究人员在视网膜光感受器退化的小鼠身上,利用光敏离子通道修复残留神经元的光感受性。他们用病毒将编码光敏蛋白ChR2的基因转入神经元中,再把这些神经元直接注入小鼠眼内。结果证实,经过修补的视网膜可以把光线激发的信号传递给大脑,但我们还无法确定动物的视力能否恢复。
不管理论上如何诱人,光遗传学要应用于人体还面临一个难题:如何向大脑引入编码光控蛋白启动元件的外源基因。到目前为止,基因治疗技术还做不到这一点。而且,美国食品及药品管理局(FDA)非常重视转基因可能带来的风险,除了一些严格受限的实验,明令禁止将这类技术应用于人类。
对神经元或其他一些可兴奋细胞(如激素分泌细胞、肌细胞)的控制,有助于寻找新型药物的作用目标。比如,如果我们控制X、Y、Z型细胞,结果使动物开始进食、睡眠或变得冲动,那这三类细胞可能就是治疗肥胖、失眠和焦虑症的靶细胞。对于这些疾病,医生还没有有效治疗办法,如果我们找到能调控X、Y、Z细胞的药物,也许就找到了治疗这些疾病的方法,能够开发出更有效的药物。虽然很多问题仍待研究,但光遗传学的前景十分光明。
请 登录 发表评论