灭蚊“基因战”
科学家正在导演蚊子间的一场生死对决:让转基因蚊子通过交配,把它们的野生同类从地球上抹除,从而消灭世界上最棘手也最凶险的一种疾病——登革热。
撰文 比哈尔·P·特里维迪(Bijal P. Trivedi) 翻译 徐海燕
铁丝网内有一块平地,四周环绕着腰果树,中间安放着一批薄纱网笼。笼子里有数千只当地品种的蚊子,拉丁名为Aedes aegypti(埃及伊蚊),它们与常见蚊子相比个头更小,也更安静,不会嗡嗡作响。早上七点,阳光穿过层层网纱,把一切都笼罩在黄色的光晕里,宛如幻境。然而在网笼内,一场生死对决正在上演:转基因蚊子要通过交配,把它们的野生同类从地球上抹除,从而消灭世界上最棘手也最凶险的一种疾病——登革热。

在众多热带和亚热带国家,流传着四种亲缘关系极近的登革热病毒,每年会感染约一亿人。登革热没有疫苗,也无法治疗。对这类通过蚊子传播的疾病,公共卫生部门的主要策略是防止蚊虫叮咬,例如清除居民区内可供蚊虫繁殖的积水,喷洒杀虫剂,分发蚊帐等低技术含量的防蚊物品。他们只图控制,不求攻克。
然而,美国加利福尼亚大学欧文分校的分子生物学家安东尼·詹姆斯(Anthony James)却要发起一场攻坚战。他在埃及伊蚊中插入了会阻断雌蚊飞行肌发育的基因,通过转基因雄蚊与野生雌蚊的交配,改造过的基因就会传给后代。子代雌蚊存活时间很短,破蛹后只能“静坐”在水面上,无法飞翔和交配,也无法叮咬人类并传播疾病。相反,子代雄蚊则能存活下去,继续传播“灭蚊基因”。 詹姆斯预计,雌性后代的匮乏会很快导致种群崩溃——事实上,他的合作者在美国科罗拉多州的室内封闭实验环境中已经观察到这种崩溃现象。如今,詹姆斯把他的蚊子带到了位于墨西哥南方的塔帕丘拉城。
这是科学家首次采用基因工程来改造某个生物体并用它来消灭特定的野生种群,以阻止疾病传播。假如转基因蚊子能够胜出,那么将它们放到全世界的登革热疫区,就可使上千万人免受疾病之苦。
然而,该计划的反对者指出,即使杀灭对象只是蚊子,也要警惕不可预料的后果出现。
科学家也为如何测试转基因蚊子费尽心思。目前,并无国际法或国际组织来规范转基因新物种的实验,科学家和生物公司基本上可以随心所欲,甚至可以在发展中国家直接释放实验生物,无须知会当地居民或征求他们的同意,当地居民浑然不知自家后院会成为“生物殖民战”的野外实验场。
詹姆斯希望通过规范的方式来进行实验,并为此花费了数年时间。他与塔帕丘拉的社区领导人协调,通过传统的土地共享方式购买土地,构建起安全的实验场所。这些都是费时费力、很琐碎的工作。不过,詹姆斯并非唯一一个在野外测试转基因蚊子的科学家。他的同事、英国生物技术公司奥西特克(Oxitec)的创始人卢克·阿尔菲(Luke Alphey),曾秘密采用了一种较为激进的实验策略。2009年到2010年,奥西特克公司在管理松懈的加勒比海大开曼岛,将数百万只转基因蚊子放归野外。2010年,阿尔菲在亚特兰大一次会议上公布实验结果后,詹姆斯才知道这件事,而此时,距离奥西特克公司的野外实验已有14个月之久。此后,奥西特克公司继续进行他们的实验,分别在马来西亚和巴西两地释放了转基因蚊子。
专家担心,奥西特克公司的行为可能会让人们抵制转基因昆虫,就像欧洲人对待转基因作物的态度。这样一来,科学家可能还没来得及彻底弄清楚该技术的应用前景和可能后果,它就已胎死腹中。
这将会是一个遗憾,因为该技术的前景确实值得看好。在科罗拉多的实验已经证明,转基因蚊子在封闭环境中确实有效,不过室内的几只笼子远远不是中美洲、巴西或马来西亚的原野,要战胜蚊子带来的疾病与死亡,科学家创造出来的生灵必须要征服丛林。
死亡程序
早在2001年,詹姆斯就已经是蚊子分子遗传学领域的先驱,他率先改造了蚊子基因组,是首个克隆了蚊子基因的科学家。同年,他决定利用自己的优势进军疾病传播研究,想把一种本用于控制农业害虫的策略转移到蚊子身上。
此前一年,当时还在英国牛津大学工作的阿尔菲开发了一项新技术,他用该技术培育的果蝇携带某些基因,可以选择性地杀灭雌果蝇。从原理上说,这种灭虫方法不过是昆虫不育技术(sterile insect technology,SIT)在基因组时代的翻版。过去60年,SIT技术成功对付了多种农业害虫:技术员会饲养大量害虫,并用强烈辐射造成雄性不育,这些不育雄性与野外雌性交配后,就不会产生任何后代。这种方法无需杀虫剂,能选择性地针对某一个昆虫物种,历史上有过多次成功案例——包括1977年,在塔帕丘拉进行的一次大型地中海果蝇(Medfly)杀灭行动。
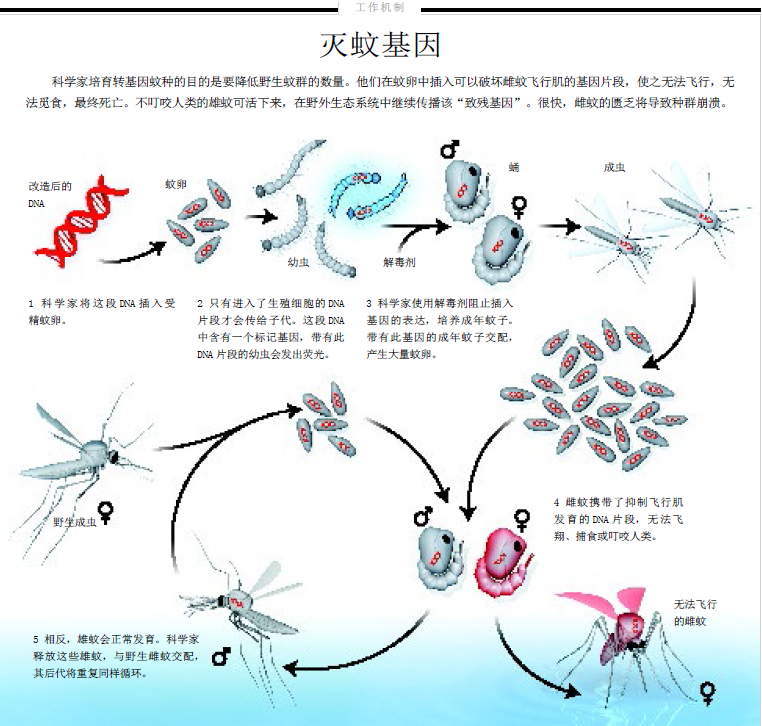
可惜SIT技术对蚊子一直无效,因为雄蚊接受辐射后极度虚弱,在分选和运输过程中便已死亡,无法和野生雌蚊交配。如果阿尔菲在果蝇中开发的新方法能用于蚊子,科学家就能从基因水平上设计出不育雄蚊。
吸取人类血液和传播疾病的蚊子都是雌性。为了杀灭雌蚊,詹姆斯需要找到一个雌蚊才有的基因组片段。2002年,詹姆斯和阿尔菲发现了一个完美的改造对象——控制雌蚊飞翔肌发育的一个天然调控开关。只要关闭这个开关,飞翔肌就不会发育,雌蚊出蛹后只能停留在水面上,无法飞翔,也吸引不到雄性交配。
2002年,阿尔菲创立奥西特克公司,想将这门技术转化为利润。2005年,美国国立卫生研究院基金会(经费主要来自比尔及梅琳达·盖茨基金会)向詹姆斯拨款2 000万美元,用于研究对抗登革热的遗传学方法。詹姆斯拿出500万美元,转拨给奥西特克公司,用于进行蚊子的基因组改造。
奥西特克公司的研究人员设计了一段DNA,其中包含几个基因以及适时打开和关闭这几个基因的调控开关。这个“基因系统”的工作原理类似一个中继系统:在蚊子从幼虫到成年的变化过程中,第一个开关在雌蚊中打开,激活第一个基因,产生相应的蛋白质。这个蛋白质会打开第二个开关,激活第二个基因,合成一种破坏雌蚊飞翔肌的毒素。研究人员还加入了荧光蛋白基因,使得改造后的幼虫带有红色和绿色荧光,以便观察这些基因在种群中的传播。
要大量饲养植入“死亡程序”的蚊子,阿尔菲和詹姆斯需要找出一种方法来保护雌蚊,让它们在生殖前不受毒素基因影响。他们的解决办法是在水中掺入解毒剂——四环素,这种抗生素能够抑制破坏飞翔肌的蛋白质的合成。同时,这也是一种事故预防机制,如果少数转基因蚊子逃出实验室,它们在缺乏抗生素的室外环境中将不能繁殖,不会造成危害。
2008年到2009年,詹姆斯的一位同事、科罗拉多州立大学的梅根·怀斯·德瓦尔德斯(Megan Wise de Valdez),对新种系进行了第一次实验,在实验室内将转基因雄蚊放入一个正常埃及伊蚊群体中。不到5个月,蚊群数量便急剧下降,证明了这个“杀戮开关”确实有效。下一步,就是将转基因蚊子放入野外。
塔帕丘拉实验
詹姆斯的“网笼实验室”所在地塔帕丘拉和墨西哥大部分地区一样,长年饱受登革热之苦。去年我去恰帕斯时,当地的卫生局副局长厄米洛·多明戈·沙拉特(Hermilo Domínguez Zárate)告诉我:“登革热疫情一直是我最担心的事情。”登革热的传播是爆发式的,在人口密集地区危害最为严重。
在恰帕斯期间,我去“穷联”( Pobres Unidos)看了一下。这是位于塔帕丘拉郊区的一个贫困社区,在2009年和2010年,这里的登革热发病率是全球最高的。与我同行的还有一位流行病学家罗杰里奥·丹尼斯-洛萨诺(Rogelio Danis-Lozano),以及詹姆斯团队中负责野外实验场日常工作的亚尼内·拉姆齐(Janine Ramsey)。
我们参观了玛丽亚(Maria)的家。在“穷联”,大多数房子都和她家一样只有三面墙,无法阻止蚊子进入。屋里,地面是泥土的,很潮湿,这种环境深受附近昆虫的“喜爱”,而垃圾堆和收集雨水的几十个容器为蚊子提供了充足的产卵场所。
顺着丹尼斯-洛萨诺的手指方向,我们看到了一个装满清水的黄色木盆,水面上有几百只黑色的蚊子幼虫,细长如线,在水里不断以“之”字形游动。玛丽亚当然知道登革热,但丹尼斯发现,她完全不知道水盆里的幼虫会变成传播疾病的蚊子。
这种情况在全世界的穷人聚居区都随处可见。亚洲、非洲和美洲的100多个国家都有登革热,较轻微的登革热症状被称为“骨痛热症”( breakbone fever), 症状类似于流感,包括发烧、关节肌肉疼痛和剧烈头痛,约持续一个星期。再次感染则可能诱发致命的登革出血热(dengue hemorrhagic fever),包括呕吐、腹部剧烈绞痛和内出血,血会从眼睛、鼻子、嘴、阴道等部位流出。如果不及时治疗,登革出血热病死率高达20%,在有专家护理的条件下可降至1%,但花费高昂。每年,全世界因登革热死亡的人数超过其他所有出血热(包括埃博拉和马尔堡病毒引起的出血热)死亡人数的总和。
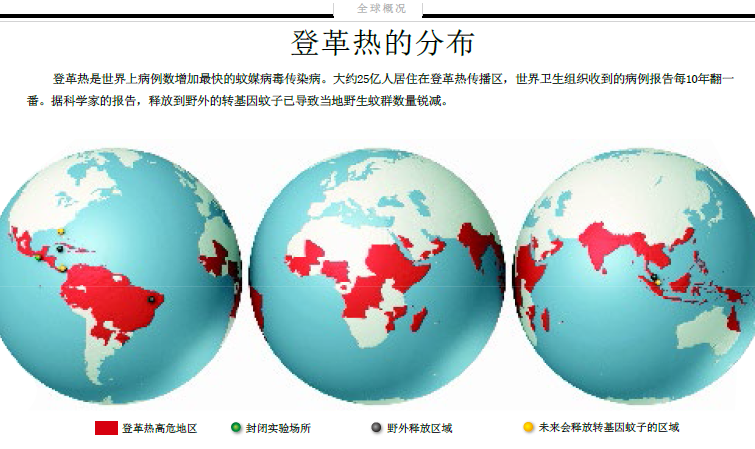
2008年,《美国医学会杂志》(Journal of the American Medical Association)将登革热称为全世界“最凶险的再发传染病”之一(再发传染病是指,过去已存在的,但发病率迅速增加,范围迅速扩大的传染病)。由于国际旅行与贸易日渐增加,以及大量人口从乡村涌入城市,登革热爆发的频率和烈度都在上升。自上世纪70年代开始,登革热病例数每十年便翻一番。2009年,美国佛罗里达州的公共卫生官员报告了该地区70余年来的首个登革热病例,流行病学家担心,登革热很快会在美国落地生根。
詹姆斯决定用基因技术对付登革热,而非其他流行病(例如疟疾)的一个原因是,传播登革热病毒的蚊子通常只有一种(而传播疟疾的蚊子为30~40种),所以只须对一个物种进行遗传手段攻击,便有可能大量降低传播登革热病毒的种群数目。埃及伊蚊是登革热病毒的主要载体,这种具有攻击性的树居蚊种来自非洲,约400年前随贩奴船来到世界各地,如今已成为城市蚊种,在房屋周围任何留存少量清水的地方都可以繁殖。它们的叮咬活动主要发生在白天,因此无法利用蚊帐进行防护。它们基本上只叮咬人类,从人类身上获得营养,在一个月的生命里,足以叮咬多人并传播疾病。
埃及伊蚊的行动很隐蔽,不会发出令人烦躁的嗡嗡声,让人无法及时击打或驱赶。在塔帕丘拉公共卫生研究中心的封闭饲养站里,我面对一个小笼里的转基因蚊群,几乎听不见任何声音。美国加利福尼亚大学戴维斯分校的昆虫学家劳拉·瓦莱里奥(Laura Valerio)戴上手套,将手伸进笼子,指出一只雌蚊给我看。雄蚊都受惊飞起,在笼中乱转;雌蚊则要么不动,要么笨拙地跳开。
携带转基因的蚊子幼虫将被运到詹姆斯的野外实验场,那里有5组笼子,每组包括一个野生蚊群对照笼和一个混有转基因蚊子与本地野生蚊子的实验笼。每个笼子都有多层纱网防止蚊子逃逸,研究人员加入新的实验蚊时必须小心穿过重重纱网。
他们采用如此严格的操作规程是为了避免重蹈覆辙。长期以来,发达国家一直在发展中国家开展野外实验,研究人员对当地环境的漠视已经引起实验地区的抵制,导致很多研究项目停滞。而转基因生物实验,恐怕比任何一种实验都更容易激起当地居民的抵制——不管是在想象中还是现实情况都是如此。
民间阻力
1969年,世界卫生组织(WHO)与印度政府合作,研究针对三种蚊群的遗传控制手段,包括传播丝虫病(即象皮病)的致乏库蚊(Culex fatigans)、传播登革热和黄热病的埃及伊蚊,以及传播疟疾的斯氏按蚊(Anopheles stephensi),其中部分研究得到了美国政府的资助。
1972年,一位科学家在印度的一份报纸上,匿名发表了一篇文章称,某些研究人员把经过噻替派(thiotepa,即三胺硫磷)处理的蚊子放入了农村的饮用水井中。噻替派是芥子气(mustard gas,一种毒气)的一种衍生物,对动物有致癌作用,还可导致新生儿缺陷。曝光后,负责这项研究的科学家作了一些大而空的反驳,并拒绝了媒体的采访要求。
1974年,印度一家通讯社刊登了一篇报道,标题颇具煽动性:“世界卫生组织在印度为美国开展秘密研究”。这篇文章称,灭蚊项目实际上是在测试埃及伊蚊作为生物武器的可行性,这项研究之所以在印度开展,是因为研究用的“化学试剂和实验方法在该研究的发起国是禁止使用的”。埃及伊蚊被选为研究对象的原因则是,与其他蚊卵不同,这类蚊子的卵经过干燥后,可以放在纸上,装进信封,寄到蚊卵可以孵化的印度其他地方。” 尽管研究人员对这些说法进行了强烈抗议,但他们与当地民众的关系已不可协调,世界卫生组织只得终止该项目。
美国国立卫生研究院基金会“全球健康大挑战”计划的负责人斯特凡妮·詹姆斯(Stephanie James,她与安东尼·詹姆斯没有亲缘关系)说,从那以后,科学家就对转基因生物的野外实验有了畏惧心理。“他们真的产生了心理障碍,因为他们知道,一旦出错,后果就会很严重”。
安东尼·詹姆斯说:“这么多年,已经有无数人对我说,你这项研究没法开展,当地人是不会同意你做这些实验的。”在2005年“全球健康大挑战”计划为研究资金获得者举办的晚宴上,他征求了吉姆·拉维里(Jim Lavery)的意见,后者就职于加拿大多伦多圣迈克尔医院的全球健康研究中心,专攻社区关系。詹姆斯问:“人们对转基因实验很抵触,如何才能发动社区居民参与实验?”
拉维里建议他选择登革热已经失控并成为严重健康问题的地区,其所在国要有严格的管理机构,能够评估抗登革热转基因蚊子所带来的风险和收益。在这种情况下,当地居民不会认为自己受人利用,也相信实验对他们没有威胁。拉维里和一位富有蚊子野外实验经验的科学家、加利福尼亚大学戴维斯分校的托马斯·斯科特(Thomas Scott)一起,帮助安东尼·詹姆斯组建了一支由蚊子生态学家、人类学家和伦理学家组成的国际团队,虽然当时詹姆斯还没有培养出足够数量的测试蚊群。
2006年,塔帕丘拉被选中,成为了首批野外实验场所。墨西哥已有转基因生物的相关法案,并签署了卡塔赫纳生物安全议定书(Cartagena Protocol on Biosafety),可以根据这一国际公约引进转基因蚊子。拉维里说,由于经历过地中海果蝇杀灭行动,当地居民算是“见过世面”的,不会对转基因昆虫有太大的恐慌情绪。
“最初,他们提出买地我们感觉有点奇怪,”实验场所在地的社区领导马提米安诺·巴里奥斯·马图特(Martimiano Barrios Matute)说。为什么要造这些大笼子,里面放满人造蚊子?当地居民也不明白转基因蚊子是用来做什么的。假如有蚊子逃出来,会不会对居民和土地造成危害?蚊子不育症会不会传染给其他昆虫?
詹姆斯和他的团队对居民的问题作出了答复,通过当地传统的土地共有制买下土地,建立起大型蚊笼,邀请当地人参与实验。
此外,实验场管理员拉姆齐还在一次塔帕丘拉每周的例行市政会议上,向当地领导(有30名男性和5名女性)讲解了转基因蚊子实验的方方面面。拉姆齐语言生动,诙谐幽默,而且身体语言也很丰富,完全不像是个外国人,会议上的所有人都听得很专心。
她讲完后,听众开始详细提问。一个男人问是否可以参观蚊子笼,另一个人想知道蚊子逃出来的后果,一个年轻女人则问人们为什么反对转基因,还有一个来自山村的年长男性问疟疾和登革热是不是同一种病。拉姆齐回答了所有问题,微笑着与大家一一握手后才离开。
“由于我们有了较多的了解,就更喜欢这项目了,”镶着镀金牙、身形瘦削的农民巴里奥斯·马图特(Barrios Matute)说。“这不单对弗洛里多河村有好处,还可以造福墨西哥和世界其他地方。”
“不老实”的阿尔菲
当上述研究和社区工作在墨西哥缓慢推进的同时,阿尔菲却悄悄走上了一条完全不同的道路。去年11月,他在美国热带医学和卫生协会的年会上公布了一个惊人的消息:奥西特克公司已从2009年9月开始,在加勒比海的大开曼岛上释放转基因蚊子。这些蚊子与塔帕丘拉的实验蚊种有些相似,但不完全相同:在大开曼岛上,雄蚊和雌蚊在幼虫阶段就会死亡。阿尔菲说,奥西特克公司在2010年5月到10月期间,共释放了300多万只雄蚊,使当地埃及伊蚊的数量减少了80%。他们已根据这些数据写成论文向学术杂志投稿。
阿尔菲为他的激进策略辩护说,因为当地政府对本地文化更了解,所以与居民的交流主要由政府部门负责。在大开曼岛,所谓的“交流”只有5分钟的晚间新闻报道和一本宣传手册,手册中只说这些蚊子不育,对转基因只字不提。他们从未举行过公开会议,也没有征求过居民的意见。
阿尔菲在会议上辩解说:“从宣传角度来看,我们只在开曼群岛释放蚊子,所以只须告知当地岛民。”
意大利佩鲁贾大学研究蚊子的分子生物学家马克·本尼迪特(Mark Q. Benedict)认为,奥西特克公司没有违反任何法律,并称大开曼岛实验是“勇敢”的,只是实验涉及的技术注定会引起“人们的注意,好坏都有”。本尼迪特说:“混乱而矛盾的媒体报道会让人产生这样的印象:个别科学家在毫无监管的情况下,拎着一桶蚊子冲进大自然。但这并非事实。”奥西特克公司在所有野外实验之前,都会与当地政府和所在国政府沟通、合作,以便获得批准。
但大开曼岛实验仍在阿尔菲的众多同事、环保组织和公众当中引起了强烈的不信任感和失望情绪。“国际社会对此也很吃惊,”荷兰阿姆斯特丹大学的医学昆虫学家、疟疾信息网站malariaworld.com的创建者巴特·诺尔斯(Bart Knols)说,“在外人看来,奥西特克公司行事神秘,公众必然会怀疑他们的动机。这就是疑虑生长的温床。”
诺尔斯说,这项技术前景广阔,但是“如果某些人乱搞一通,让公众产生错误印象,其他转基因实验都会受到牵连”。他还说,因为奥西特克公司的行为,“我们现在的处境,就像1976年世界卫生组织在印度的处境一样”。
另外一些专家认为,奥西特克公司利用了某些国家在管理上的缺陷。斯特凡妮·詹姆斯说,开曼群岛实验所在地“管理体制还不完善”,只有一项还未成型的生物安全提案,远未达到立法的高度。
马来西亚是奥西特克公司的又一个目标。在20多个非营利组织的抗议声中,该公司于去年12月在一片无人居住区进行了一次实验,接下来还将在附近的一个村庄开展实验。马来西亚的非营利组织“环境、技术与发展中心”( Center for Environment, Technology and Development)的负责人格米特·辛(Gurmit Singh)说,虽然马来西亚新近组建了国家生物安全委员会来监管转基因生物实验,并在2009年通过了《马来西亚生物安全条例》(Malaysian Biosafety Act),但仍有很多人认为,马来西亚缺乏必要经验,无法对这次实验进行监管。
讨论及此,詹姆斯有些消沉地坐在椅子上,但说话仍很老练,保持了一贯平和的语气。“这就是与商业公司合作的困难之处,我无力控制他们的行为,”他说,“商业公司如果搞砸了,他们会说自己早有声明。如果没砸,那算你走运。”詹姆斯说,奥西特克公司的方法在墨西哥不可能实施,他相信,他的团队开展的社区活动“为转基因实验树立了典范”。
阿尔菲并未因外界质疑而停下脚步。今年年初,奥西特克公司在巴西北部的巴伊亚州茹阿泽鲁市开展了一项为期半年的实验。这里是一个贫困郊区,终年受蚊子和登革热的困扰。阿尔菲还计划,今年年底再回到大开曼岛,将塔帕丘拉和大开曼岛两种转基因蚊子同时放入当地蚊群,观察哪个种系存活更久,飞得更远,更易与当地雌蚊交配。巴拿马、菲律宾的灭蚊机构以及美国佛罗里达州也对这项实验表示出了兴趣。
一场赌博?
当然,不论科学家如何解释,仍有很多团体反对科学家释放一切转基因生物。英国绿色和平研究实验室(Greenpeace Research Laboratories)的资深科学家珍尼特·科特(Janet Cotter)警告说:“奥西特克公司的转基因蚊子释放实验风险极大。任何方法都无法达到百分之百的不育效果,他们释放的蚊群中必定有可育雌蚊存在,后果无法预测。”
还有一些人认为,即使仅限于小片地区,消灭一个物种也是不道德和不安全的。转基因支持者认为,埃及伊蚊是一个攻击性物种,它进化至今,在生物链上仅与人类这一个物种相关。美国佛罗里达医学昆虫学实验室的蚊子生态学家菲尔·鲁尼博斯(Phil Lounibos)说:“在城市里,埃及伊蚊不处在任何重要的食物链上。”但鲁尼博斯又怀疑,消灭埃及伊蚊未必能一劳永逸地阻止登革热的传播。他说:“上世纪五六十年代,这种蚊子是城市黄热病的主要传播媒介,美国也曾发起大规模的灭蚊运动,但以惨败告终。”登革热的另一个传播媒介是攻击性的亚洲虎蚊,它会迅速填补埃及伊蚊留下的空白。另外,就算大开曼岛和塔帕丘拉的转基因蚊子获得成功,也无法一劳永逸。从邻近地区迁入塔帕丘拉的蚊子会重新填补当地蚊群缺口,必须持续释放转基因雄蚊才能够继续限制种群数量。
詹姆斯与合作者正在开发一种更具争议的长效方法。这种方法采用“基因驱动系统”(gene drive system),促使抗登革热基因在野生蚊群中传播,这种基因可以阻止至少一种登革热病毒(2型病毒)的复制。与释放后很快死亡的塔帕丘拉转基因蚊子不同,具有“遗传驱动器”的蚊子会一直存在于环境中。詹姆斯说,“基因驱动系统”的野外实验要在好几年后才会进行。
“通过种群传播基因将会遇到更多来自管理体制上的障碍,”詹姆斯说,“所以我愿意采用自限性而非持续性的方法(如塔帕丘拉的转基因蚊子)来进行首次实验。”
在塔帕丘拉卫生局副局长沙拉特看来,基因改造是一种“廉价而新颖”的方法。“若非登革热如此‘嚣张’,我们何苦改变自然?我们应该尽力尊重大自然。”然而,因为登革热所造成的伤亡高于可能的环境风险,他认为此事“值得一赌”。
本文译者 徐海燕是美国哥伦比亚大学的遗传学博士。
请 登录 发表评论