人类的寿命与基因有关,体内有多个基因主宰着你的生命长短。研究表明,那些在恶劣环境下控制机体防御功能的基因,能够显著地改善多种生物的健康状况并且延长其寿命。了解这些基因的运作机制,或许可以帮助我们找到消除老年疾病、延长人类生命的秘诀。
根据一辆旧车的行驶里程及其机型的出产年份,你多多少少都能够估计出它的性能状况。高负荷驾驶所导致的部件损耗以及使用时间的累积,最终会付出必然的代价。人类衰老的过程似乎也是这样,其实不然,因为无生命的机器与有生命的生物之间有着一个非常重要的区别:生物体系的衰退并非不可逆转——生物体系能够根据其所处的环境作出反应,并利用自身的能量来进行防卫和修复。
科学家们曾经认为老化不仅仅是一个衰退的过程,而是生物体的遗传性程序化发育(genetically programmed development)的积极延续。个体一旦成熟,“衰老基因”(aging gene)就开始将该个体导向死亡。但这种观点已经不再为人们所相信了,现在人们普遍认同:衰老其实只是由于身体的正常防卫及修复机制随时间流逝而衰退导致的。根据进化的自然选择逻辑,一旦一个生物体的生殖年龄结束,就不再有继续运作下去的理由。
然而,我们和其他研究者发现,有一个基因家族与生物体的应激耐受性(例如,对高温或食物及水匮乏的耐受性)有关,它们能够加强各个年龄段生物体的自身防卫及修复活性。这些基因通过优化身体的生存机能,最大程度地提高个体渡过困境的几率。如果这些基因处于激活状态的时间足够长,那么还能显著地增进生物体的健康,并延长寿命。其实,这个基因家族就是那些与衰老基因相对立的长寿基因(longevity gene)。
大约在15 年前,我们开始对此进行研究。我们猜想,也许生物进化促成了一种普遍的调控系统的产生,这种调控系统协调着众所周知的那些环境应激反应。如果我们能够确定那些调控生物体寿命期限的主控基因,那么,这种天生的防卫机制,就可能成为人类的武器,对抗由衰老所引起的疾病及体力衰退。
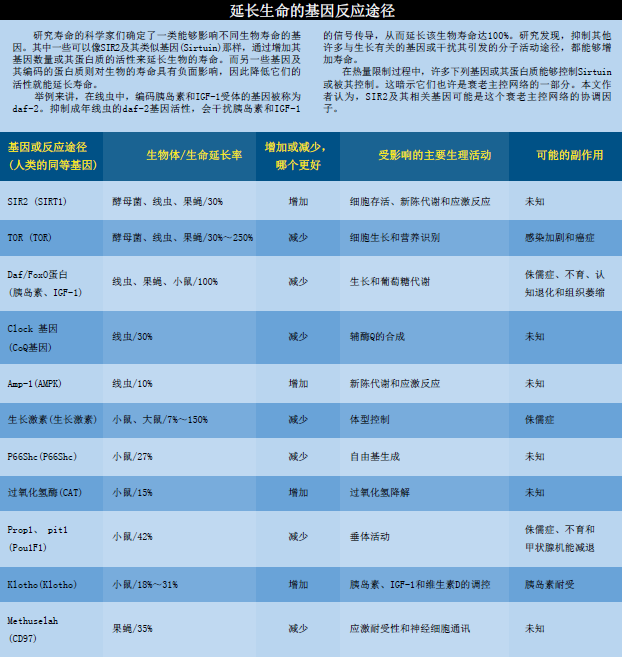
近期所发现的许多名字晦涩的基因(例如,daf-2、pit-1、amp-1、clk-1及p66Shc),能够影响实验生物的胁迫抗性(stress resistance)和寿命,这暗示着它们可能是基本的逆境存活机制的一部分。而我们自己的两个实验室则着重于对基因SIR2的研究。SIR2的变异体存在于从酵母菌到人类等所有目前研究过的生物体中。体内多余的SIR2基因拷贝,能够延长多种生物(如酵母菌、线虫及果蝇)的寿命,而我们正在努力确定它在较大型动物(如小鼠)中是否也具有相同的作用。
作为首先被确认的长寿基因之一,人们对SIR2基因的认识最多,所以我们也将研究的重点放在该基因上。对长寿基因的研究,让我们看到基因的生存调控机制如何延长寿命,以及如何增进健康。而且越来越多的迹象表明,SIR2基因很可能就是这个机制中的重要调控基因。

沉默是金
在寻找引发酵母菌细胞个体衰老的原因时,我们第一次发现:SIR2基因是长寿基因。当时,我们曾设想这种简单生物体的衰老可能是由某种单一基因所控制,并认为对酵母菌寿命的了解,或许会帮助我们理解人类的衰老过程。而这在当时很多人看来,这些观念是极其荒谬的。酵母菌的衰老程度,是以母细胞在死亡之前分裂产生子细胞的次数来衡量的。酵母菌细胞的寿命,通常在分裂20次左右。
本文作者之一瓜伦特以筛选寿命特别长的酵母菌菌落为出发点,希望能找到导致这些细胞长寿的基因。通过这次筛选,瓜伦特找到的是一个SIR4基因的单一突变(single mutation)。SIR4基因所编码的蛋白质是一种蛋白质复合体的一部分,而Sir2酶也是该蛋白质复合体的一部分。这个SIR4基因的突变,导致Sir2蛋白聚集在酵母菌基因组中重复性最高的区域——核糖体DNA(rDNA)上。核糖体被誉为“细胞的蛋白质工厂”,rDNA所编码的蛋白质就是核糖体蛋白。在普通的酵母菌细胞中,存在着超过100个这样的rDNA重复序列,而且它们相当不稳定。这些重复序列彼此之间很容易发生重组,而在人体内,这种重组则会导致多种疾病(例如,癌症和亨廷顿舞蹈症)。我们对酵母菌的研究显示,母细胞的衰老是由某种形式的rDNA不稳定性所造成的,而Sir蛋白则可削弱这种不稳定性。
实际上,我们发现了一种惊人的rDNA不稳定性。当酵母菌细胞经历多次分裂之后,它会将多余的rDNA序列以环状DNA的形式凸出于染色体上。这些染色体外的rDNA缩环(extrachromosomal rDNA circles,ERC)是在细胞分裂前与母细胞染色体一起复制的,但在分裂之后,它们却一直存在于母细胞内。这样一来,ERC就在母细胞内不断积累,最终导致了母细胞的死亡。这或许是由于复制这些ERC会消耗太多的能量,以至于母细胞不再能够复制其基因组。
当向酵母菌细胞引入额外的SIR2基因后,rDNA缩环的形成就受到了抑制,细胞的寿命则延长了30%。这个发现,为SIR2基因如何能在酵母菌中起到长寿基因的作用提供了解释。但令人惊奇的是,不久之后,我们又发现额外的SIR2基因拷贝也能延长线虫50%的寿命。我们不仅惊讶于两种进化距离遥远的生物体所展现出的这种共同性,还惊叹在成年线虫的体内只含有不分裂的细胞。也就是说,酵母菌的自我复制衰老机制并不适用于线虫。我们需要了解SIR2基因到底做了些什么。
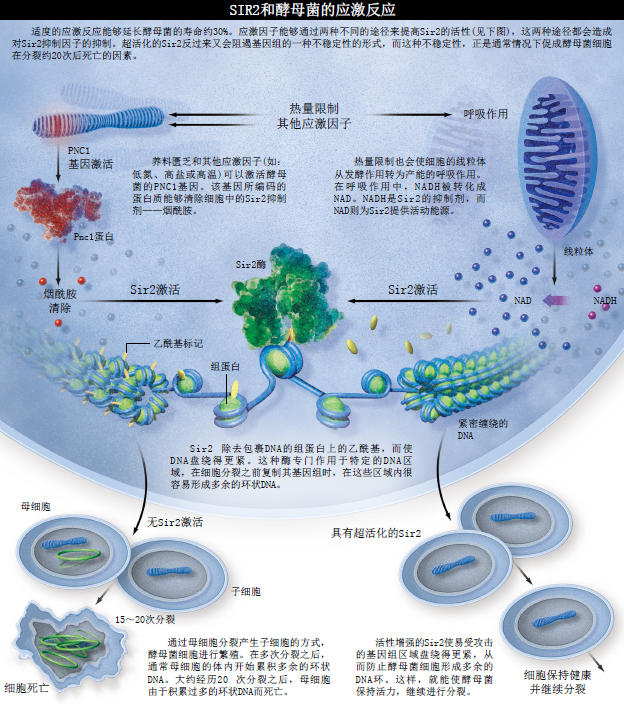
我们很快发现,SIR2基因所编码的蛋白质是一种具有全新活性的酶。细胞中,DNA为组蛋白(histone)所包裹。这些组蛋白具有不同的化学标记(如乙酰基),而这些标记则决定了组蛋白对DNA的包裹程度。除去乙酰基的组蛋白会将DNA包裹得更紧,而使那些负责将rDNA缩环凸出于染色体外的酶不能够接近DNA。由于基因组中的这段去乙酰基DNA所包含的任何基因都不能被激活,所以这段区域被称为沉默区。
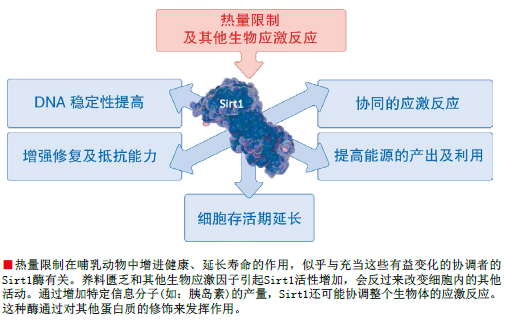
我们已经知道Sir蛋白与基因沉默有关,实际上,SIR是沉默信息调控子(Silent Information Regulator)的英文缩写。Sir2是多种组蛋白的去乙酰基酶中的一种,但是我们发现其独特之处在于它的酶活性绝对依赖于一种普遍存在的小分子——NAD。NAD长久以来被认为是细胞中许多代谢反应的反应渠道。Sir2 与NAD之间的这种联系令人兴奋,因为它把Sir2的活性与代谢作用联系起来了,这样一来,就有可能把我们在热量限制(calorie restriction)研究中观察到的饮食与衰老的关联性与Sir2的活性联系起来。
与卡路里的关联性
限制动物对热量的摄取是最有名的延年益寿方法。这个70 多年前的发现,目前仍是唯一被证明绝对有用的长寿秘诀。这种限制饮食的养生法,一般是将个体的摄食量降低到其物种普通摄食量的60%~70%。采取这种限制性饮食的动物(从大鼠、小鼠到狗,甚至灵长类)不仅可以活得更久,而且活得更健康。几乎所有疾病,包括癌症、糖尿病甚至神经退化疾病,都不再发生。这些动物似乎变得极度适于生存。对于某些生物,这种养生法唯一明显的缺点就是会使之不育。
几十年来,人们一直热衷于理解热量限制的养生机制,以及研发与其一样对健康有益的药品[参见2004年《科学美国人》由马克·A·莱恩、唐纳德·K·英格拉姆和乔治·S·罗思所著《认真寻找抗衰老药》一文]。这种现象长久以来被简单地归因于新陈代谢(细胞将能量分子转化成能量的过程)的减缓以及有毒代谢副产物的相应减少。
然而现在看来,这种观点是不正确的。热量限制并不能减缓哺乳动物的新陈代谢,而且对于酵母菌和线虫,这种热量限制反而会改变和加速新陈代谢。因此我们认为,热量限制是一种生物应激因子(biological stressor),就像自然的食物匮乏一样,它可以诱发生物体的防卫反应,以提高其存活几率。在哺乳动物中,热量限制会引起细胞防卫、修复及能量产出的改变,还会启动细胞程序性死亡(PCD,即细胞凋亡,apoptosis)。我们希望知道Sir2在这些变化中所起的作用,因此我们首先研究它在一些简单生物的热量限制过程中扮演的角色。
我们发现,在酵母菌中限制养料的可用度,会通过两个途径提高Sir2在细胞中的酶活性。一方面,热量限制会启动一个叫PNC1的基因,这种基因编码的是一种清除细胞中烟酰胺的酶,而烟酰胺是一种类似维生素B3的小分子,它通常会抑制Sir2的活性。同热量限制能够激发生存反应一样,其他一些已知的可以延长酵母菌寿命的温和应激因子(例如,高温或过量的盐分)也可以激活PNC1基因。
在酵母菌中,热量限制诱发的第二个途径是呼吸作用。呼吸作用是一种能量的生成模式,在这个过程中,会产生名为NAD的副产物,同时NADH的水平会降低。因为不仅其副产物NAD可以激活Sir2, 而且NADH又是Sir2的抑制剂,所以细胞中NAD/NADH比率的改变就会极大地影响Sir2的活性。
在看过了延长寿命的生物应激反应是如何提高Sir2活性之后,问题又来了:Sir2是不是长寿所必需的因素呢?答案似乎是完全肯定的。一种检测Sir2是否这个过程中必不可少的因子的方法是:将这个基因从体内去除,看生物应激反应对寿命的影响是否仍然存在。我们发现在像果蝇这样复杂的生物中,热量限制的长寿功能确实需要Sir2的参与。而且,因为成年果蝇的体内含有很多与哺乳动物器官相似的组织,我们猜测,对于哺乳动物,热量限制的长寿作用同样也需要Sir2的参与。
然而,假如人类要获得热量限制对健康的好处,极端的节食一定不是明智之举。而能够像热量限制那样调节Sir2及其类似物(总称为Sirtuin)活性的药品就会非常必要。一种叫作白藜芦醇(resveratrol)的Sirtuin激活剂(Sirtuin-activating compound,STAC),就引起了人们特别的关注。白藜芦醇是一种存在于红酒中的小分子,许多植物在受到环境胁迫时,就会产生这种物质。植物在胁迫条件下产生的化合物中,另外至少还有18种可以调节Sirtuin,这表示植物也许就是利用这些分子来调控它们自己的Sir2酶。
只要酵母菌、线虫或果蝇具有SIR2基因,白藜芦醇或者热量限制都能延长它们的生命达30%。此外,过量表达Sir2酶的果蝇也会长寿,但其寿命不再会因为白藜芦醇或热量限制而得以进一步延长。对此最简单的解释是,热量限制和白藜芦醇都是通过激活Sir2来延长果蝇寿命的。
尽管这些喂食白藜芦醇的果蝇可以想吃多少就吃多少,但它们还是能够长寿,而且它们的生殖能力不会像那些进行热量限制的果蝇那样受到影响。对于我们当中那些希望利用作用于Sir2酶的分子来治疗人类疾病的人来说,这是一个令人兴奋的消息。但是,首先需要我们更好地认识Sir2在哺乳动物中所扮演的角色。
乐团指挥
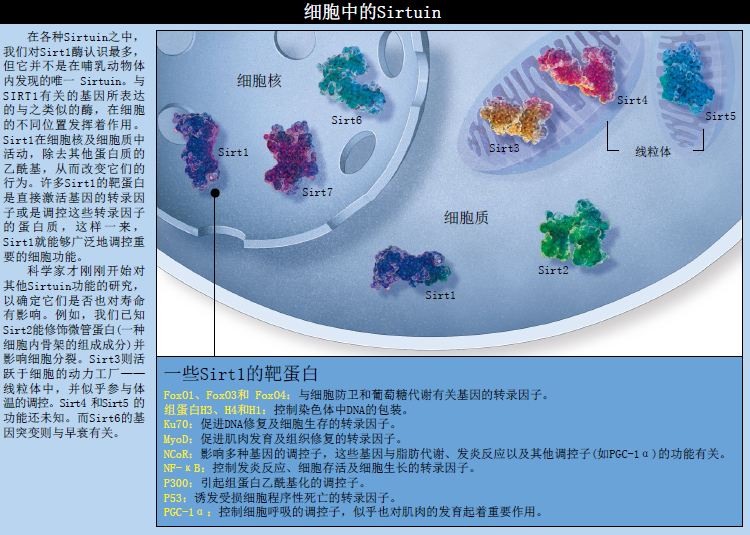
酵母菌的SIR2基因在哺乳动物中的同源体被称为SIRT1(SIR2同源体1,“SIR2 homolog 1”)。它所编码的Sirt1蛋白具有和Sir2相同的酶活性,但Sirt1还具有去除细胞核和细胞质中蛋白质的乙酰基的活性。我们发现,许多由Sirt1去乙酰基的蛋白质都控制着细胞重要的生理活动,这包括:细胞凋亡、细胞防卫及新陈代谢。因而,SIR2基因家族潜在的长寿促进作用,似乎在哺乳动物中也得以保留。在更大型、更复杂的生物体中,这些Sirtuin 的作用途径也随之变得更加复杂,就不再令人感到意外了。
例如,小鼠和大鼠的Sirt1增加,就会使它们体内的那些通常在应激反应中程序性自杀的细胞存活下来。Sirt1调控着很多细胞中的其他重要蛋白质(例如,p53、FoxO和Ku70等)的活性,而这些蛋白质通常不是与细胞凋亡有关,就是与细胞修复有关。Sirt1就是这样提升细胞的修复机制的,并同时为细胞提供更多的修复时间。
在生命的进程中,因细胞凋亡而造成的细胞流失,或许是衰老的重要因素,特别是对于像心脏和大脑这样不能再生的组织,因此延缓细胞死亡或许就是Sirtuin促进健康和长寿的一种途径。瓦氏突变系小鼠展示了一个Sirtuin促进哺乳动物细胞存活能力的惊人例子。这种小鼠的一个基因被加倍复制,这种突变使它们的神经细胞对环境压力有高度的耐受性,而使它们免于中风、化疗性中毒以及神经退化疾病。
2004年,位于美国圣路易斯的华盛顿大学的杰弗里·D·米尔布兰特(Jeffrey D. Milbrandt)及其同事表示,这些小鼠的瓦氏基因突变使产生NAD的酶活性增强,而增加的NAD则似乎能够通过激活Sirt1来保护神经细胞。此外,米尔布兰特的研究小组还发现,STAC,例如白藜芦醇,可以对普通小鼠的神经细胞起到与瓦氏突变类似的保护作用。
法国国家卫生医学研究院的克里斯蒂安·内里(Christian Néri)在最近的研究中表示,白藜芦醇和另一种STAC——漆黄素(fisetin),对两种不同的人类亨廷顿舞蹈症动物模型(线虫和小鼠),都表现出防止神经细胞死亡的作用。在这两种模型中,STAC所起的保护作用都需要Sirtuin基因的活性。
Sirtuin在个体细胞中的保护作用越来越明显。但是,假如就是这些基因的活动体现了热量限制的好处的话,那么这里仍然存在一个疑问:饮食又是如何调控它们的活性乃至整个动物的衰老速率呢?约翰·霍普金斯大学医学院的约瑟夫·P·罗杰斯(Joseph P. Rodgers)及其同事最近的研究显示,在禁食的情况下,肝脏细胞的NAD水平升高,从而促使Sirt1活性增加。在Sirt1作用的细胞当中,有一种被称为PGC-1α的重要基因转录调控因子,能够影响细胞的葡萄糖代谢。这样,就揭示了Sirt1具有感知养料可用度的作用,以及对肝脏反应的调控作用。
根据这些类似的数据产生了一种假想——Sirt1是肝脏、肌肉和脂肪细胞中的主要代谢调控因子,因为它能够通过细胞中NAD/NADH比率的变化感知饮食的变化,从而对这些组织中的基因转录模式产生深远的影响。而这个模型就能解释Sirt1将多种基因和代谢途径整合起来的方式。
然而,Sirt1在整个身体中的活动,并不一定仅以一种机制来介导。另一个吸引人的假说认为,哺乳动物利用以脂肪形式储存在体内的能量,从而记录养料可用度。脂肪细胞分泌的激素能够将信号传递给体内其他组织,但是它们所传递的信息则由脂肪的储存量所决定。热量限制可能通过减少脂肪的储存量,建立一种激素信号模式,来传达“资源匮乏”的信息,从而激发细胞的防卫机制。与这一假想相符的证据是,一种基因改造的小鼠不论其食物摄入量的多少,却一直保持很低的脂肪储存量,而这种小鼠有长寿的趋势。
这种可能性让我们怀疑,Sirt1是否也反过来根据饮食来调控脂肪的储存量。实际上,在限制食物摄入量后,脂肪细胞中的Sirt1活性的确增加,使细胞中储存的脂肪转移到血液中,以便这些脂肪在其他组织中转化为能量。我们猜想,Sirt1感知饮食的变化,然后调节脂肪的储存量及脂肪细胞产生激素的模式。Sirt1对于脂肪细胞及其所发出的信号的影响,又反过来控制整个生物体的衰老速率,而使之成为哺乳动物热量限制所引起的长寿的重要调控因子。它还将衰老和脂肪过多相关的代谢疾病(如Ⅱ型糖尿病)紧密联系起来。因此,对于脂肪细胞中Sirt1途径的药物介入,也许不仅会防止衰老,还能预防某些特定的疾病。
另一个因Sirt1而减轻的重要生理过程就是发炎。发炎与许多病症有关,其中包括癌症、关节炎、哮喘、心脏病及神经退化。美国弗吉尼亚大学的马丁·梅奥(Martin Mayo)及其同事最近的研究显示,Sirt1对NF-κB有抑制作用,而NF-κB是一种促进发炎反应的蛋白质复合体。Sirt1的激活剂——白藜芦醇也有相同作用。这个发现特别鼓舞人心,不仅因为寻找NF-κB的抑制分子是药物研发中一个高度活跃的区域,还因为热量限制另一个众所周知的作用就是抑制过度发炎。
在由应激反应诱发的衰老的调控系统中,如果说SIR2基因是主控因子的话,它的作用也许就像交响乐团的指挥,只不过这个交响乐团的演奏者包括了激素网络、细胞内的调控蛋白质以及其他与长寿有关的基因。近年来,一个更值得注意的发现是,Sirt1调控胰岛素和类胰岛素生长因子-1(Insulinlike Growth Factor,IGF-1)的生成;而且这两种强大的信号分子,似乎又会作为复杂反馈回路的一部分,反过来调控Sirt1的生成。Sirt1 与胰岛素及IGF-1之间的关联是很有趣的,因为它们之间的关系解释了某一组织中的Sirt1活动如何与体内其他细胞相通。此外,我们已经知道,胰岛素及IGF-1的循环水平可以控制多种生物(线虫、果蝇、小鼠、也许包括我们自己)的寿命。
转防为攻
对于延缓衰老的秘诀,人们已经徒劳地寻找了几千年,所以对于一些人来说,可能很难接受人类的衰老或许可以由调整几个基因来控制这一观点。但我们知道可以利用简单的饮食变化(热量限制)来延缓哺乳动物的衰老。而且我们的研究显示,Sirtuin基因控制着很多热量限制所影响的分子途径。虽然,我们还不能确切地知道许多造成衰老的原因,但我们的研究已经显示,在多种生物中,我们可以通过控制一些调控因子来延缓其衰老,保持健康。
我们还知道SIR2基因家族的进化出现在很早以前,因为它们广泛地存在于各种生物中——从酵母菌、利时曼寄生虫(Leishmania)和线虫到果蝇及人类。在这些生物中,除了人类以外,都证实了Sirtuin可以决定其生命的长短。仅仅这样,就让我们有理由相信,人类的Sirtuin基因可能也是控制我们健康和长寿的关键因素。
我们的两个实验室正在进行具备完善对照的小鼠实验,很快就能告诉我们SIRT1基因是否控制着哺乳动物的健康和寿命。或许在未来的几十年内,我们还是不能明确地知道Sirtuin基因是如何影响人类寿命的。因此,现在那些希望出现某种药丸让他们活到130岁的人,还是生得太早了点。然而,现在的人们也许还是有机会看到我们利用控制Sirtuin酶活性的药物来医治一些特定的疾病,如阿尔茨海默氏症、糖尿病和心脏病等。事实上,许多这样的药物已经开始运用于治疗糖尿病、疱疹及神经退化性疾病的临床试验了。
更长远地来看,我们希望解开长寿基因之谜,不仅能够治疗而且还能预防人类衰老引发的疾病。也许我们现在还很难想象,在90多岁时,人们还活得很年轻,基本不受老年疾病的困扰。有些人甚至会质疑延长人类寿命本身是否正确。但在20世纪初,人类的预期寿命只有45岁左右,多亏抗生素以及公共卫生措施的出现,使人们免于传染疾病,并将人类的预期寿命提高到75岁左右。人类社会已经适应了平均寿命的巨大改变,而且很少有人会愿意回到这些进步出现之前的时代。毫无疑问,当未来的人类习惯于活过100岁之后,他们也许会觉得,我们现在改善健康的方法,不过是过去年代的原始遗风罢了。
概述/提高寿命的极限
◆控制生物体在逆境中的耐受能力的基因,会引起整个身体的改变而暂时大幅度提高其 在逆境中的生存几率。
◆对于多种生物来说,如果其应激反应维持的时间够长,就能够延长其生命,并且预防 疾病。
◆Sirtuin基因家族也许是这种生存机制的主控因子。
◆了解这些基因如何增进健康、延长寿命,就能够使人类获得治疗多种疾病的方法及更 长、更健康的生命。
请 登录 发表评论