10年前,两种颇具前景的新型疫苗展开了一次正面交锋:美国国立卫生研究院的科学家希望通过试验,确定哪种疫苗能让人体产生最强抵抗力,抵御地球上最致命的病毒——HIV的侵袭。一种疫苗的主要成分是质粒(plasmid,即环状DNA),每个质粒都携带了1种基因,可编码5种HIV蛋白中的一种。科学家希望,这种质粒疫苗能使接种者自身的细胞制造病毒蛋白,诱导机体的免疫细胞作出保护性应答反应。另一种疫苗是以某种腺病毒(adenovirus)为载体,携带一种编码HIV蛋白的基因。该疫苗的作用机制是,利用一种“安全”的病毒引起免疫细胞的注意,使它们对HIV蛋白作出免疫应答。
在这次试验之前,本文作者韦纳从事DNA疫苗研究已有8年时间,证明质粒能够诱导机体对致命病原体产生免疫应答,一直是他最大的心愿。可惜事与愿违,10年前的那次试验让第一代DNA疫苗的支持者深受打击:DNA疫苗接种者对5种HIV蛋白产生的免疫应答非常微弱,但接种腺病毒疫苗后,机体却产生了强烈的免疫反应。显然,对于科研机构和制药公司的研究人员而言,以腺病毒为载体的HIV疫苗成了更有竞争力的候选者。
由于在以前的试验中,DNA疫苗也只能引发较弱的免疫应答,这次试验的结果并非完全出乎研究人员的意料。但这样的失败仍令人失望,因为科学家本来信心满满地认为,质粒疫苗应该是安全有效的。失败没能动摇科学家坚定的信念,他们从头开始,重新寻找能提高DNA疫苗有效性的方法。现在,努力开始获得回报。人体和动物试验证实,新一代质粒疫苗确实能诱导出预期的免疫应答,再加上安全性和其他优点,这类疫苗的前景实在让人心动。而且,科学家也在尝试,把这种DNA技术用于其他免疫疗法和药物的直接输送。如果发展成熟,DNA疫苗和相关疗法就将因为征服现有数种绝症而名垂青史。
DNA还是腺病毒?
20世纪90年代初,以DNA为疫苗的想法开始受到关注。这类疫苗的优点显而易见:构成简单。疫苗的核心组件是精心设计的质粒,携带有编码一种或多种病原蛋白的基因。接种后,这些质粒能让机体细胞合成病毒蛋白,但由于质粒中只含有病原体的部分基因,因此不会产生完整的病原体。
当质粒进入一个宿主细胞(这个过程叫做转染,transfection),负责解码DNA的细胞机器就开始读取质粒中的基因信息,合成相应的蛋白质。这些蛋白最终会从细胞中游离出来,就像病毒颗粒完成复制后,从宿主细胞中钻出来一样。在细胞外,免疫细胞会把病原蛋白视作外来物质,让免疫系统误认为机体已受到感染,发起针对外源蛋白的长期性免疫识别和应答。这样,仅须注射一种携带了一个病原基因的环状DNA,就能诱导机体产生保护性免疫应答,对抗完整的病原体。
除了安全和简单,DNA疫苗还有很多其他疫苗不可比拟的优势。生产流感疫苗等传统疫苗时,研究人员需要处理和培养活病毒,整个生产周期至少需要4~6个月,而DNA疫苗的生产就要快得多。在室温条件下,DNA是稳定的(我们的细胞“运气”不错,这一点非常重要),因此DNA疫苗应该不需要始终在低温下保存,而在很多传统疫苗的运输和贮存过程中,低温保存则是必须考虑的因素。
对疫苗开发者而言,DNA的另一个优点是使他们在最近几年重新踏上DNA疫苗研究之路的重要因素:人体免疫系统不会把质粒看作异己物质——毕竟,质粒也是由DNA构成的,因此从理论上说,DNA疫苗本身不会引发任何免疫应答。只有当细胞根据质粒上的基因信息合成蛋白质,并把蛋白产物释放出来后,才会引起“免疫哨兵”(即抗原呈递细胞)的注意。这就意味着,质粒可在同一接种者身上反复使用,输送各种基因,而不用担心人体会对质粒产生免疫应答,攻击疫苗本身。
遗憾的是,在早期试验中,DNA疫苗有一个重大缺陷:仅能引发很弱的免疫应答。导致失败的主要原因可能是,相当部分的质粒没能进入细胞,而且即便进入了细胞,质粒上的基因也没能充分表达,合成的蛋白数量有限,无法强有力地刺激免疫系统。
不过,DNA疫苗的竞争对手——腺病毒疫苗面临的问题更严重。2007年,为测试一种HIV疫苗的效果,德国默克制药公司(Merck)开展了一项大型临床试验。该疫苗以腺病毒AdHu5(一种常见的感冒病毒)为载体,向人体输送HIV病毒基因。初期试验的结果曾显示,腺病毒能引发强烈的免疫应答,因此从一开始,这项名为STEP的试验就被寄予厚望。约3 000名HIV检测呈阴性的自愿者参加了试验,接受腺病毒疫苗或安慰剂注射。
随着试验不断深入,两组自愿者表现出令人费解的差异:与对照组(注射安慰剂)相比,试验组(注射疫苗)并未对HIV产生更强的抵抗力,最终结果反而表明,试验组的受试者更容易感染HIV。初步数据统计显示,在试验组的914名男性中,后来有49名HIV检测呈阳性,而在对照组的922名男性中,呈阳性的仅有33位。上述问题发生后,STEP试验于2009年夏季被迫中止。虽然迄今为止,科学家仍在分析试验数据,寻找导致如此诡异结果的原因,但已有证据表明,使用腺病毒AdHu5为基因载体可能是这次试验的一大败笔。某些自愿者曾感染过AdHu5,事先就对这种病毒产生了抵抗力,他们的免疫系统很可能会攻击疫苗本身。至于试验组的自愿者为何更易感染HIV,原因仍不清楚。
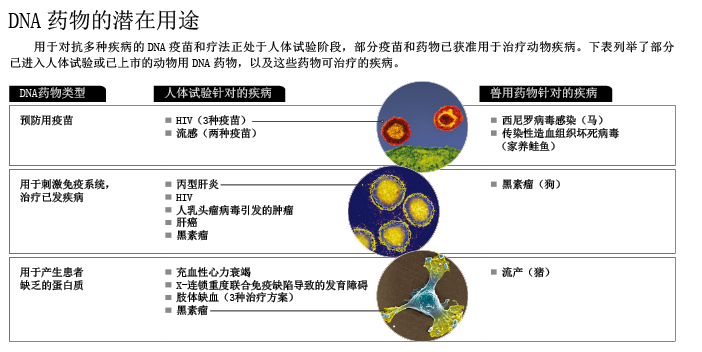
改进DNA疫苗
在默克公司开展STEP试验的前几年,对DNA疫苗的潜力充满信心的科学家一直在努力研究解决方案,以消除第一代DNA疫苗身上的“痼疾”。他们的研究重点是全面增强质粒的活性,比如开发新技术,帮助质粒进入细胞;质粒进入细胞后,使用新方法提高病毒蛋白的合成量;寻找疫苗佐剂,加强免疫系统对病毒蛋白的免疫反应。
在这些研究中,最重要的成果是找到了新的疫苗接种方法,能让质粒进入更多的细胞,甚至包括免疫细胞。透皮贴剂(transdermal patch)、基因枪(Gene Gun)、生物喷射器(Bioject,用压缩空气注射疫苗)等无针接种系统能把质粒送入免疫哨兵高度集中的皮肤组织。而且从物理学角度来看,无针接种迫使质粒进入细胞的数量,也比针刺接种多。如果要使针刺皮肤或肌肉的疫苗接种方式具有类似的效果,可在注射后使用电穿孔技术(electroporation)——施加一系列电脉冲,使细胞膜出现瞬时性孔洞,让质粒更容易进入细胞。在这种条件下,质粒进入细胞的数量将会提高1 000倍。
通过数种方式微调质粒携带的基因序列,科学家也对质粒的基因结构进行了改进。天然蛋白质中的每个氨基酸都由密码子(codon)来编码,每个密码子都由3个DNA碱基构成。虽然有些氨基酸对应着多个密码子(编码同一个氨基酸的密码子叫做同义密码子),但通常情况下,细胞更喜欢使用其中的一个来编码氨基酸,而且在合成蛋白时,该密码子的翻译效率要比其他密码子高。因此,在构建质粒时优先使用细胞的“偏好密码子”,就能增加病原蛋白的合成量。对基因序列的其他调整还可提高转录产物信使RNA的稳定性和准确性,加速蛋白质的合成,因为信使RNA才是蛋白质合成过程的直接“指挥者”。
蛋白质合成过程中,细胞会首先翻译每个基因开头附近的先导序列(leader sequence),制造出蛋白分子的起始部分,对先导序列进行优化能使最终的蛋白产物更稳定。某些先导序列甚至能给蛋白分子打上“标签”,使之成为分泌蛋白,这样的序列正是我们所需要的,因为由此形成的蛋白产物不管是在转染细胞内还是细胞外,免疫细胞都能遇上。蛋白质在细胞内外引发的免疫反应类型稍有不同,而两种反应的叠加则能从总体上增强疫苗产生的免疫力。
最后一个重大改进与佐剂有关。在制造传统疫苗时,研究人员通常会加入佐剂,用以增强免疫反应。有时,人们甚至可以根据需要,用佐剂来操控免疫系统,改变免疫反应的类型,比如可以让免疫系统产生更多T细胞,识别和杀死被病原体感染的人体细胞,而无需大量分泌用于阻止病原体入侵细胞的抗体。有研究表明,在化学物质Vaxfectin的作用下,一种预防流感的DNA疫苗引起的抗体反应增强了200倍。另一种佐剂Resiquimod与某些DNA疫苗一起使用时,能使机体同时产生强烈的T细胞和抗体反应。
在向成品疫苗添加佐剂时,研究人员有时会担心能否使疫苗始终保持在恰当的乳化状态,或者疫苗成分是否稳定。DNA疫苗则不会引起这样的担心,研究人员可以在质粒中直接插入编码佐剂的基因,细胞摄入这种质粒后,就可同时合成佐剂和病原蛋白——这是DNA疫苗让人心动的又一大优点。如果DNA疫苗含有编码佐剂的基因,即使质粒上的基因序列此前已经优化过,最后合成出的佐剂仍能使免疫反应至少再增强5倍。
现在的DNA疫苗设计与多年前仅会编码病毒蛋白的质粒相比,可谓有了云泥之别。随着质粒的优化和接种方法的改进,在STEP试验开始时,DNA疫苗已经准备好东山再起。而且,除了用于疫苗接种,构建DNA疫苗的技术在其他医学领域也开始崭露头角,比如用质粒输送药物和介导针对肿瘤的免疫疗法等。

DNA疗法:路还有多远?
将基因安全地送入细胞,使之高效合成基因编码的蛋白——这种技术的出现,将让很多潜在疗法应运而生。实际上,在通向临床应用的道路上,不少基于DNA的疗法的步伐都已领先于DNA疫苗。与传统药物不同,DNA疗法不会向人体输送化学小分子,而是通过传递基因来治疗疾病。这种疗法也不同于传统的基因疗法,因为质粒不会永久整合到接种者的细胞基因组上,甚至不会一直存在于细胞内,这就避免了并发症的发生。基因疗法的发展一直停滞不前,就因为受到并发症的困扰。
与很多新型医疗技术一样,基于质粒的DNA疗法首先在动物中取得了成功。目前,有一种疗法已经获得批准,用于预防母猪流产(fetal loss)。注射质粒后,研究人员会立即使用电穿孔技术,使质粒尽可能多地进入怀孕母猪的细胞,再由细胞合成生长激素释放激素(growth hormone-releasing hormone),提高母猪胎儿的成活率。由于只需注射一次,质粒就能在母猪这样的大型动物体内发挥作用,这种疗法的成功的确让人兴奋,这也预示着DNA疗法同样可用于治疗人类疾病。
很多用于人类的DNA疗法现已进入临床试验阶段(见下一页表格),比如向人体输送编码某些生长因子的基因,以调动干细胞治疗充血性心力衰竭(congestive heart failure);在质粒上插入编码1型胰岛素样生长因子(IGF-1)的基因,用于治疗X-连锁重度联合免疫缺陷患者的发育障碍;还有一种疗法针对的是一种血液循环障碍——肢体缺血(critical limb ischemia),这是医学界的一大难题,利用质粒输送某些生物因子的基因,可以促进新血管的形成,有望帮助患者逃过截肢之难。
DNA生物免疫疗法(DNA biological immunotherapy)属于另一个范畴,它兼具DNA疗法和DNA疫苗之长,通过输送基因来诱使机体对现有疾病(如肿瘤或慢性病毒感染等)发起免疫攻击。在一项早期试验中,研究人员利用编码病毒蛋白的DNA,促使免疫细胞攻击人乳头瘤病毒(HPV)导致的肿瘤。初步结果显示,一半以上的接种者体内都产生了针对HPV蛋白的T细胞反应,体内存在高浓度抗体的接种者更是超过90%。另一项还在进行的临床试验则在尝试用一种DNA免疫疗法对抗丙型肝炎病毒(hepatitis C virus)。两项试验的初步结果令人鼓舞,意义重大,因为到目前为止,世界上还没有方法能治疗丙型肝炎和HPV导致的肿瘤。
在DNA生物免疫疗法领域,兽医学上的应用研究再一次走在了人类相关研究的前面。美国梅里尔公司(Merial)开发出一种疗法,成功攻克了狗黑素瘤(melanoma),这让从事人类癌症研究的科学家倍感兴奋:身患晚期黑素瘤的狗经过治疗后,平均存活时间是未经治疗的狗的6倍。事实证明,DNA生物免疫疗法有潜力成为新一代DNA疗法,实现此前所有DNA疗法都未能实现的目标——在人类疾病的治疗上取得成功。
展望未来
过去10年里,数十种DNA疗法和疫苗进入了人体试验阶段,有些试验已经结束,有些还在进行。预防流感的质粒疫苗是一个典型实例,在DNA疫苗已得到证实的优点中,不少优点在这类新型流感疫苗上都有所体现。我们开发的一种流感疫苗现已进入初期人体试验,此前的动物试验曾表明,这种疫苗不仅能对抗普通流感病毒,还可抵御已感染过数百人的高致病性H5N1禽流感病毒。这种疫苗能对抗多种流感病毒的原因是,它所用的质粒含有流感病毒基因中的通用序列(consensus sequence)——也就是说,很多流感病毒都具有与该序列编码的蛋白相似的蛋白质。由于流感病毒经常发生突变,相应的疫苗很快就会失效,科学家每年都必须根据病毒变化研制新的季节性流感疫苗,我们研制的这种疫苗也许能彻底解决这个问题。
去年出现的新型H1N1流感病毒引发了一场全球性大流感,凸显了人类对新型疫苗技术的迫切需求。2009年5月,美国Vical制药公司仅用两周时间,就研制出了预防H1N1的实验性DNA疫苗。如果提前进行临床试验,并获得上市批准,这种疫苗大批量生产、上市的时间,至少要比常规疫苗快两个月。目前,该疫苗正处于早期人体试验阶段,初步结果令人兴奋。
DNA疫苗及相关药物已显示出了对抗“绝症”的潜力,这也使DNA重新回到“HIV疫苗竞赛”。Pennvax-B便是一种HIV疫苗,目前正在进行人体试验。它含有3种HIV病毒基因和一些编码佐剂分子的基因,接种方式是电穿孔。科学家也在测试另外两种DNA疫苗的效果,他们采用的免疫策略是,先用质粒引导免疫细胞识别HIV蛋白,接着再给受试者接种其他类型的疫苗,提升免疫反应的强度。GeoVax是这两种DNA疫苗中的一种,接种到人体后,研究人员会用由牛痘病毒安卡拉(Ankara)改造成的疫苗来加强免疫。在美国国立卫生研究院疫苗研究中心,科学家也在测试一种基于DNA的HIV疫苗。具有讽刺意味的是,试验中用于加强免疫的疫苗,竟是曾经战胜过DNA疫苗的腺病毒疫苗。
现在,多种DNA疫苗和药物都已用于治疗动物疾病,这些疫苗和药物的大规模后期人体试验也在进行之中,它们的“打击目标”都是令医生束手无策的人类病症。这一事实足以让我们看到,质粒技术已有了多么巨大的进步。过去十年,这个领域出现的重大进展还催生了一些极具创新性的疫苗和药物,围绕着它们展开的临床试验将让人类受益匪浅。从这个意义上说,那些从一开始就参与DNA药物研究的科学家可以自豪地宣告,这项技术已走过了艰难的童年时代,光明的未来已在眼前。
请 登录 发表评论