一提起“病毒杀手”,人们往往会想到肆虐非洲的埃博拉病毒(Ebola virus)、一度横行亚洲的SARS病毒或者流行于美国的汉坦病毒(Hantavirus)。然而,它们所夺去的生命却远少于“名不见经传”的轮状病毒。轮状病毒能感染所有处于婴儿阶段的儿童,引起呕吐以及严重腹泻,如果不及时治疗,就可能引起脱水性休克甚至死亡。在世界范围内,每年约有61万儿童因感染轮状病毒而死亡,占5岁以下儿童死亡总数的5%左右。在美国,虽然很少有儿童死于该病毒,但是每年有多达7万的人因感染轮状病毒而住院,还有数百万人在家中默默忍受着轮状病毒带来的痛苦。
因此,从30年前第一次鉴定出轮状病毒开始,科学家们就一直在潜心研究攻克它的方法。2006年1月,研究人员发布了一条振奋人心的消息:两种轮状病毒疫苗的有效性已被大量的临床试验所证实。疫苗的研发过程艰难而曲折,充满了人们难以想象的挫折和惊奇。世界卫生组织(WHO,World Health Organization)以及全球疫苗与免疫联盟(GAVI,Global Alliance for Vaccines and Immunization)都为轮状病毒疫苗的研究大开绿灯。幼小的生命经不起轮状病毒的摧残,科学家们必须在这场与轮状病毒的终极对决中取得胜利。
确认病因
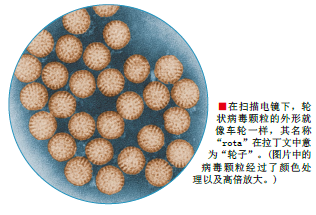
1973年,在澳大利亚墨尔本皇家儿童医院从事胃肠道疾病研究的年轻微生物学家鲁思·毕西普(Ruth Bishop)首次发现轮状病毒。那时,研究人员正对儿童的腹泻感到不解——尽管经常有人腹泻并且症状十分严重,但科学家们却一直无法鉴定出病原体。为了寻找线索,毕西普的研究小组用扫描电镜观察来自急性患儿十二指肠和小肠的活检组织。观察的结果让他们大吃一惊:取自肠道内层的上皮细胞(Epithelial cells)被一些车轮状的病毒(轮状病毒的名称由此而来)所感染。
从1979年开始,我就与轮状病毒紧密联系在一起,当时我和妻子去了孟加拉的国际腹泻疾病研究中心(International Center for Diarrheal Disease Research)工作。年轻而又充满理想,我们决心帮助那些被严重腹泻逼到死亡边缘的儿童。孟加拉首都达卡的中心医院每年都要收容许多不明病因的“肠流感”患者,有的只能被安置在医院走廊或露天帐篷里接受治疗。通常,腹泻是由细菌引起的,所以当发现引起腹泻的不是霍乱弧菌(Cholera)、沙门氏菌(Salmonella)、志贺菌(Shigella)或者大肠杆菌(Escherichia coli),而是大家对它知之甚少的轮状病毒时,我们非常惊讶。后来我们通过一个简单的实验,证实因感染轮状病毒而腹泻的儿童,占所有五岁以下因腹泻入院儿童的25%~40%。
世界各地的相关研究也得到类似的结果。更有甚者,他们发现轮状病毒不仅广泛存在,而且在一些最贫穷的国家,它还是引起死亡的主要原因之一。到1985年,这些数据迫使美国医学研究所(IOM,Institute of Medicine)将轮状病毒感染列于众多疾病之首,而对于发展中国家来说,研制轮状病毒疫苗也刻不容缓。
让人感到吃惊的是,整个美国竟然对轮状病毒的发病率与流行分布几乎没有任何了解。1986年,当我回到美国疾病控制中心(CDC,Centers for Disease Control)时,轮状病毒感染几乎没有被诊断过,实际上,这种疾病根本就没有列于国际疾病分类(International Classifications of Diseases)之中。由于对国外轮状病毒感染所造成的影响深有感触,我和同事们打算弄清楚是否有很多美国人正被轮状病毒所困扰。
但是如何来评估这样一个几乎没有被诊断、没有被列为病因、没有被大多数儿科医生认可的疾病所带来的负面影响呢?我的同事何美乡(Mei Shang Ho)首先从查看全美国儿童的入院记录入手。她发现儿童因腹泻而住院是一个很普遍的现象,占5岁以下入院儿童总数的12%,并且大多数病例的病因都不明确。进一步研究表明,大量未能明确诊断的腹泻病例都与轮状病毒有关。在美国,轮状病毒的感染呈现出3个特点:1. 感染呈现明显的季节性,12月到次年3月是发病高峰期;2. 被感染的儿童绝大多数年龄在5岁以下;3. 除开季节因素,大多数感染轮状病毒的儿童都表现出严重的腹泻症状。
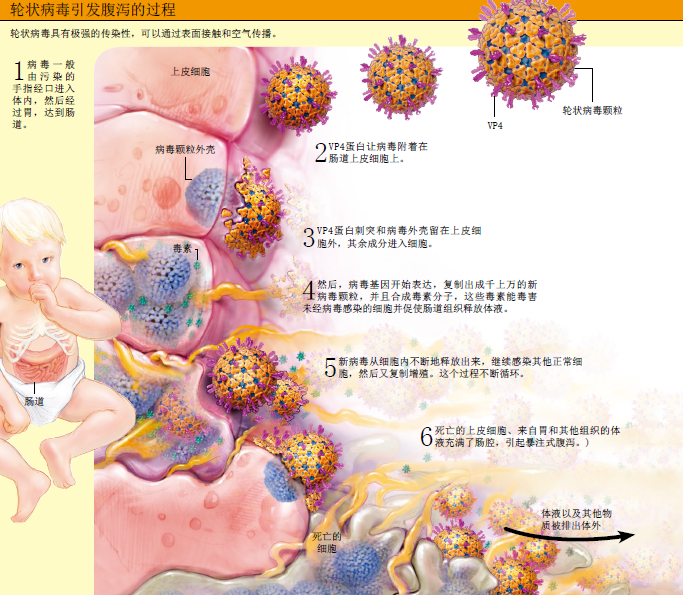
现在,流行病学家确认,轮状病毒无疑是引起全世界儿童腹泻的最主要病因,它可以感染所有年龄在3个月至5岁之间的儿童。不同于细菌——通过污染的水和食物传播,因而多在贫穷地区感染人群——轮状病毒的传播几乎不受地域限制,美国人与孟加拉人都有可能感染上轮状病毒。这也说明轮状病毒具有极强的传染性,与感冒病毒一样容易传播,而且正如感冒病毒一样,保持卫生与清洁饮水也对轮状病毒的传播几乎起不了任何抑制作用。
分子和临床研究见证了轮状病毒的威力。仅仅10个病毒颗粒就能使一个儿童患病。富集病毒颗粒的飞沫,能轻易“登陆”儿童的手指和玩具表面,通过口腔进入消化道,最后定位于肠道上皮细胞,并开始疯狂地复制繁殖。24小时内,10个病毒就能繁殖出数百万的病毒来。它们通过自身蛋白、毒素和新病毒颗粒,不断“占领”和杀死肠道上皮细胞。很快,肠道上皮细胞死亡脱落,体液和电解质大量流失,剧烈的腹泻接踵而至。如果没有补水治疗,一个儿童的体重会迅速减少10%,并在一两天内进入休克状态。
幸运的是,从首次感染中恢复过来的儿童没有长期的后遗症,并且一般不会再度感染轮状病毒——他们对轮状病毒已有了自然免疫力。当病毒再次入侵时,免疫系统能快速识别轮状病毒,然后阻止它复制繁殖。但是,由于许多儿童在首次感染时就病得不轻,因此科学家们认为要挽救这些幼小的生命,最好的办法是获得能够模拟自然免疫过程的疫苗。

开发疫苗
疫苗是人类对付感染性疾病的有力武器,因而接种疫苗是保障公共健康最有效的措施之一。疫苗来自活的或者灭活的微生物,以及它们的关键性蛋白。疫苗刺激接种者机体的免疫系统,使之产生抗体(Antibodies)来对抗疫苗(疫苗不会对生物体造成威胁),正如抵抗真正的病毒入侵一样。在自然免疫过程中,一旦这些病原体入侵,免疫系统就会全面启动,迅速产生大量特异性抗体来限制病原体的活动。
20年前,几家制药公司就对研发轮状病毒疫苗产生了兴趣。因为在全球范围内,这项研究存在着巨大的潜在市场,即便是在偏远的地方,疫苗的销售也将不费吹灰之力,因此值得投入巨资来研发疫苗。而且,轮状病毒疫苗会被纳入WHO和UNICEF(联合国儿童基金会,United Nations Children's Fund)赞助的全球儿童免疫计划(Universal Program for Childhood Immunization),WHO和UNICEF已经为全球约80%的儿童分发过常规疫苗。
虽然研究人员考虑过使用几种不同的方案来研制疫苗:例如比较人与动物的病毒株型、比较活病毒与灭活病毒、比较完整病毒与病毒蛋白亚基等,但他们还是决定采用脊髓灰质炎口服疫苗的创造者阿尔贝特·赛宾(Albert Sabin)倡导的方法。赛宾认为活病毒疫苗能够进行复制,但复制能力弱,不足以致病,能很贴切地模拟自然免疫过程,从而使机体具备抵抗能力。另外,对在消化道致病的轮状病毒来说,口服疫苗正好可以在胃肠道迅速引起免疫反应,发挥作用。因此,研究者迅速将目光聚集到那些能够口服而不用注射的轮状病毒减毒株身上。
1983年,第一个轮状病毒疫苗的测试工作准备就绪。比利时南部里松萨(Rixensart)的史克必成制药公司(Smith Kline-RIT公司,现在的葛兰素史克生物制品有限公司,GlaxoSmithKline Biologicals)的弗朗西斯·安德烈(Francis Andre)和芬兰坦佩雷(Tampere)大学的儿科医生蒂莫·维斯卡里(Timo Vesikari)制备和测试了获取自奶牛轮状病毒株的疫苗。他们之所以选择牛轮状病毒株,是因为这种病毒容易培养,而且在人体内其毒力会自然衰减。
在众多有利因素的支持下,在芬兰的初次试验就获得了里程碑式的成功。该疫苗能有效降低感染率,接种疫苗的儿童对轮状病毒的抗感染率达到88%,说明口服活疫苗能有效诱导免疫反应。此外,该疫苗无任何副作用。受到极大的鼓舞后,史克必成制药公司开始在其他国家进行试验。上个世纪80年代末,终结轮状病毒似乎指日可待了,但在非洲和秘鲁的试验结果却反复无常,让人非常失望。尽管较差的健康状况、未经治疗的感染性疾病、营养不良或寄生虫等原因都有可能影响儿童对疫苗的免疫反应,但由于找不到导致疫苗效果不理想的确切原因,该公司不得不把疫苗计划束之高阁。
从头开始
美国国立卫生研究院(NIH,National Institutes of Health)和费城威斯塔(Wistar)研究院的研究者们想找出史克公司疫苗实验失败的原因。他们认为可能是牛病毒株毒力被过于削弱,以至于不能复制,从而无法引起有效的免疫反应来对抗病毒入侵。于是,他们开始寻找新的疫苗。比如NIH的卡皮凯恩(Kapikian)筛选出一个恒河猴病毒株;威斯塔研究院的弗雷德·克拉克(Fred Clark)和斯坦利·普洛特金(Stanley Plotkin)则筛选出一个拥有更强复制能力的牛病毒株。这些候选病毒株在被投入临床试验后,同第一个疫苗一样,成败参半。看来,关于疫苗的研发,还需要几年时间进行反思。
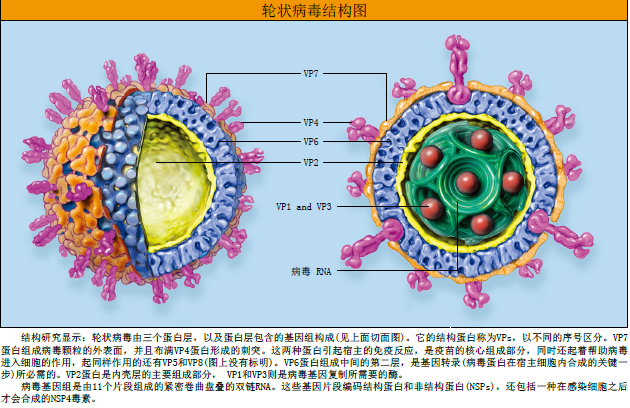
同时,其他一些研究者阐明了病毒的分子结构。虽然轮状病毒横切面像车轮,但实际上是一个三层的球体,内含由11个片段组成的双链RNA,每个片段就是编码一种蛋白质的基因。这些蛋白质分为两个基本类型:一种是病毒的结构蛋白(构成病毒),而另一种是非结构蛋白(在宿主细胞内合成)。结构蛋白,简称VPs,依次称为VP1、VP2等。而非结构蛋白,即NSPs,参与病毒复制以及破坏肠道功能。
最外层的外壳蛋白,是引起宿主免疫反应的重要部分,已成为疫苗研究中倍受关注的焦点。VP7构成起伏的外表层,VP4蛋白构成最外侧的刺突。VP6蛋白是病毒颗粒中数量最多的蛋白,位于VP7的下面,参与病毒蛋白在宿主细胞中的合成。非结构蛋白NSP4可能是一种引起剧烈腹泻(甚至在病毒破坏细胞之前)的毒素。
这些蛋白分别有多种亚型,不同的病毒株表现为不同蛋白亚型的组合。当两种病毒感染同一细胞时,它们的基因片段会重新组合,从而形成新的重组病毒。这些重组病毒会不断产生,但大多数突变体都会丧失存活的能力,这些重组病毒也不例外。因此,迄今为止所鉴定的42个独特的轮状病毒株都是基于VP7和VP4蛋白亚型的重组而产生,但在世界范围内,90%轮状病毒感染仅由其中的4~5株引起。
利用轮状病毒自身的基因重组能力,卡普凯恩和他在NIH的同事哈里·格林伯格(Harry Greenberg)建立了一种实验方法来构建有利于疫苗研制却不致病的病毒重组体。他们从制备重组病毒着手,重组体的10个基因片段来自猴轮状病毒(引入猴基因片段是为了削弱重组病毒的毒力),另外一个编码表面蛋白VP7的基因片段来自人轮状病毒。他们制备了三株这样的重组体(每一株表现不同的VP7蛋白亚型)和一株完全的恒河猴病毒株,但是它表现的VP7亚型在人和猴病毒株中都存在。他们将这四种病毒混合制成四价疫苗,希望能有效防治四种最流行的人轮状病毒株。
1991年,美国食品与药品管理局(FDA,Food and Drug Administration)允许惠氏公司(Wyeth Ayerst,后来的惠氏立达公司,Wyeth Lederle)制备并测试这种疫苗。疫苗被命名为Rotashield。此后的5年,该公司在美国、芬兰和委内瑞拉进行了大量的临床试验来验证Rotashield的安全性、引起防护性免疫反应的能力以及效率持续性。1998年,Rotashield被FDA批准,并被CDC计划免疫咨询委员会(ACIP, Advisory Committee on Immunization Practices)、美国小儿科学会(American Academy of Pediatrics)推荐为所有美国儿童常规性疫苗之一。在此之后的9个月内,超过60万的儿童服用了120万单位的Rotashield。
但该疫苗的研究仍然处于攻坚阶段,因为疫苗的测试还须在广大发展中国家那些营养不良的儿童身上获得成功。在这些地区,口服疫苗包括脊髓灰质炎疫苗和霍乱疫苗的效果都不太理想。此外,疫苗价格对这些发展中国家来说仍然太高。但这毕竟是在世界范围内对抗轮状病毒所取得的首次胜利,是值得欢欣鼓舞的。
但灾难随后便降临了。1999年,几个婴儿在服用疫苗两周后,出现了严重的并发症:他们的小肠嵌在大肠里造成梗阻(称为肠套叠)。患者相当痛苦,必须尽快用空气或液体灌肠来复位,或者采取紧急外科手术来复位。一些罕见病例甚至出现肠穿孔造成婴儿死亡。监控Rotashield效果的CDC立刻停止了它的免疫计划。一个耗时15年、耗资数亿美元的疫苗研究,就此搁浅了。
代理机构初步估计了一下发生肠套叠的风险概率,约为1/2500,这是不能被接受的。后来的研究认为发生概率只有万分之一,另有研究发现,肠套叠与年龄也有关:年龄在三个月以内的儿童发生肠套叠的可能性比年龄稍大的儿童要小。如果只给这些初生婴儿服用疫苗,发生肠套叠的概率会下降10倍,大约为三万分之一。
新的数据催生新的问题:美国人会接受这种风险吗?在美国,常有因感染轮状病毒而住院的儿童,但致死病例却十分罕见。这种概率在发展中国家就会合理一些吗?在一些发展中国家,每200个感染轮状病毒的儿童就有一个会死亡。如果为了救治150个儿童而发生一例肠套叠病症,这合理吗?统计数据表明,该疫苗实际上每年可以挽救50多万的生命,放弃它是否不人道呢?或者抛开这些利弊分析,把这些在美国已经停用的疫苗投放到发展中国家,是否不道德?
CDC和WHO召开了一个发展中国家决策者会议。经过激烈的讨论后,政治战胜了科学。正如一个印度高级官员声称的那样:“我明白这个疫苗能挽救我国的10万儿童。但是当第一个肠梗阻发生时,人民是不会原谅我的。因为我允许这种在美国已经停用了的疫苗在我国继续使用。”

胜利在望
研究人员没有停止研究疫苗和肠套叠之间的联系。感染轮状病毒的儿童并不比其他儿童更容易发生肠梗阻,那么,疫苗是如何提高发生肠梗阻风险的呢?一些科学家开始怀疑肠梗阻只是由恒河猴病毒株所引起的,并不是所有的口服活病毒疫苗都有同样的问题。
由于坚信能够解决肠套叠问题,两个疫苗制造商再次把目光投向轮状病毒。葛兰素史克公司规避干扰因素,致力于研制完全来源于人减毒病毒株的单价疫苗。因为天然轮状病毒感染跟肠套叠并没有关联,所有他们推断新疫苗不会导致肠套叠的发生。
并且,该公司只将疫苗接种年龄在6周~13周之间的儿童,在这个年龄阶段的婴儿几乎不会发生肠套叠。与此同时,默克公司开发了一个5价疫苗,它是来自5个人与牛病毒株的重组体,针对目前最为流行的轮状病毒株。默克公司的科学家认为,牛病毒株不像恒河猴病毒株那样生长复制迅速,但是它不引起低热(接种恒河猴病毒株来源的疫苗时会引起)。另外,公司限定临床试验的受试者只能是6~12周大的婴儿。
两家公司都严格参照FDA的规定来进行临床试验。FDA希望新一代疫苗能比Rotashield更安全,所以强调必须经过大量的试验,以检测可能出现的任何与疫苗相关的风险,哪怕是很小的风险。初步目标是每期临床试验参与者达到6万名,在获得生产许可之前进行如此大规模而且花费如此巨大的疫苗安全性试验是空前的。不仅仅试验的花费很高,而且进行实验本身就极具风险。因为口服疫苗组发生肠套叠的几率一旦超过对照组,那么每个人都会立即崩溃。研发人员承受着巨大的压力,如履薄冰。
现在,因肠套叠而中断6年的攻克轮状病毒的计划,终于再次看到了胜利的曙光。默克公司和葛兰素史克公司都完成了临床试验,结果是振奋人心的。疫苗的有效率高达85%~98%,而且与对照组相比,参与实验的儿童发生肠套叠的概率并没有升高。
葛兰素史克公司的疫苗Rotarix最初在拉丁美洲进行测试。截至2004年,超过20个国家已经允许该公司销售Rotarix。最近,葛兰素史克公司又获得欧洲的疫苗销售权,但在美国还处于评审阶段。默克公司则相反,一开始就瞄准美国市场,希望先在美国证明疫苗的安全性。该公司现在已获得了墨西哥和美国的批准,并且有望在年内获得欧洲的许可证,这将是获得更多国家许可的前奏。
许多发展中国家的疫苗开发商对轮状病毒疫苗也很感兴趣。因为轮状病毒疫苗不像那些需要尖端生物工程技术的疫苗,它依靠传统的组织培养技术就能制备,所以一些小公司也能参与竞争。目前,超过10家分布在印度、中国、印尼和巴西的开发商正在生产轮状病毒口服活疫苗,而且一家中国公司已经获得了销售许可权。

展望未来
新疫苗点燃了攻克轮状病毒的希望。但是,仍有一些障碍需要继续跨越。首先,由于许多发展中国家的决策者根本没有听说过轮状病毒,更不知道它所带来的可怕后果。CDC、WHO和美国适宜卫生科技组织(PATH) 在40多个国家的监督机构开始向这些决策者们提供相关数据,这些数据将会使他们了解并欢迎这些疫苗进入他们的国家。其次,在一些最为贫穷的地区,仍然缺乏令人信服的证据,证明口服活疫苗的安全性和有效性。此外,全世界每年有1.35亿的婴儿出生,但并不是每一个婴儿的父母都承担得起接种疫苗的费用——这些疫苗都是花费数亿美元研制成功的。
然而,接种疫苗已经箭在弦上,许多人希望通过当前最经济有效的公共卫生措施——免疫, 10年内在发展中国家彻底消灭轮状病毒——引起严重腹泻的主要“元凶”以及残害儿童的罪魁祸首。在全世界的共同努力下,轮状病毒将会像脊髓灰质炎、天花和白喉一样被疫苗所征服,再也不能肆虐人间。流行病学家希望能标榜那些为攻克这个疾病做出了历史性贡献而不为人知的科学家们,成功的疫苗正是他们最崇高的荣誉。
请 登录 发表评论