人类的大脑是一部异常复杂的有机电脑,能接收所感知到的各种信息,并对信息进行加工与存储,然后在适当的时候对筛选出的信息进行调用和整合。阿尔茨海默病对大脑记忆的破坏类似于从电脑硬盘上删除信息,从最新文件开始,依次向后删除。该病的最初征兆常常表现为无法回想起前几天所发生的事情,例如与朋友的电话交谈、修理工的造访等,却对很久以前的事记忆犹新。然而,随着病情恶化,患者所有的记忆逐渐消失殆尽,最后,即使面对亲人,也形同陌路。对阿尔茨海默病的恐惧,并非源于想象中的生理病痛和折磨,而是不可阻挡地失去一生的记忆——正是这些记忆构成了一个人的真实本体。
不幸的是,类似于电脑的人类大脑出了毛病,仅简单地重启大脑以及重装文件和程序,解决不了问题。因为阿尔茨海默病不仅删除信息,而且还会毁坏大脑中储存信息的硬件。这一硬件由上千亿的神经细胞(神经元)组成,在神经细胞之间,存在着数以百万亿的连接通道。许多神经元都会释放一种名为乙酰胆碱的化学通信介质(神经递质),抑制分解乙酰胆碱的酶(乙酰胆碱酯酶)的活性,可以提高乙酰胆碱的浓度。对于患者而言,提高乙酰胆碱的浓度,就可以刺激神经元,使思维更加清晰。因此,现阶段大多数治疗阿尔茨海默病的药物,都是以乙酰胆碱酯酶为作用靶标,限制其活性,提高乙酰胆碱的浓度,以达到治疗目的。但是阿尔茨海默病会不停地毁坏神经元,面对这种情况,这些药物也无能为力,因此它们的药效只能持续6个月到1年的时间。另一种药物,美金刚(memantine),通过限制另一种神经递质(谷氨酸)的过度活性,似乎可以延缓患者认知能力的衰退,但是研究人员仍未能确定该药物的药效能否持续一年以上。
10多年前,战胜阿尔茨海默病几乎是天方夜谭。科学家们对该病的生物学机理知之甚少,认为其发病机制复杂到令人绝望的地步。但近些年来,在研究阿尔茨海默病分子机理方面,科学家们取得了巨大的进步。目前,他们正在试验各种治疗方案,以延缓或阻止神经元的死亡。也许上述方案之一,或者结合几种方案,能有效阻止神经元的退化,从而避免阿尔茨海默病的恶化。几种候选方案已处于临床试验阶段,试验结果初显成效。越来越多的科学家看到了治愈阿尔茨海默病的希望―曾几何时,阿尔茨海默病带来的只有绝望。

淀粉样蛋白假说
100年前,德国神经病学家阿洛伊斯·阿尔茨海默(Alois Alzheimer)首次提出,在承担重要大脑功能的大脑皮层和边缘系统中出现的蛋白斑块和缠结,是阿尔茨海默病的两个重要特征。斑块是出现在神经元外的蛋白沉淀,主要成分是一种小分子蛋白,即淀粉样蛋白-β(简称A-β)。缠结则形成于神经元及其分支投射(轴突和树突)内部,由一种蛋白纤维构成,即tau。围绕这两个特征,科学家们展开了一场几乎贯穿了整个20世纪的争论:蛋白质斑块和缠结到底是神经元退化的“凶手”,还是仅为死亡神经元的“代言人”?从过去10年所得到的证据来看,淀粉样蛋白连锁反应(amyloid-cascade)假说最接近阿尔茨海默病的发病机理,也就是说阿尔茨海默病的发生与A-β和tau紧密相关,其中A-β向神经元挥出了“第一刀”。
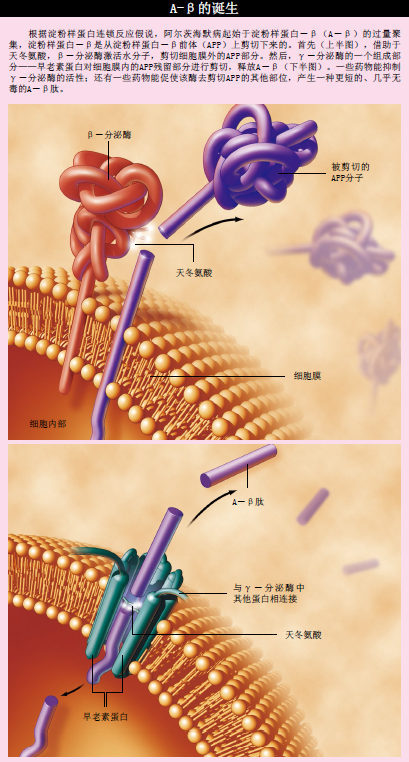
A-β是一种短肽,即蛋白片段。1984年,美国加利福尼亚大学圣迭戈分校的乔治·G·根纳(George G.Genner)和凯恩·W·王(Caine W.Wong,音译)首次分离并鉴定了A-β。A-β来源于一种大分子蛋白―淀粉样蛋白-β前体(APP)。APP是一种跨细胞膜蛋白,一部分留在细胞内部,另一部分则伸出细胞。两种剪切蛋白质的酶,即蛋白酶(β-分泌酶和γ-分泌酶),将A-β从APP上剪切下来。实际上,在所有人体细胞中,这一生化过程时常发生,但尚不清楚细胞为何要产生A-β。现有证据表明,这一过程可能是信号传导途径的一部分。
在APP上,A-β的一部分在细胞膜内,处于细胞膜内外层之间。由于细胞膜由疏水性脂质组成,因此过膜部分一般都含有疏水性氨基酸。当APP受到蛋白酶剪切,把A-β释放到细胞膜外的水环境中时,不同A-β分子的疏水部位相互聚集,形成可溶性小体。在上世纪90年代初,彼得·T·小兰斯伯里(Peter T.Lansbury, Jr. ,目前就职于哈佛大学医学院)指出,只要浓度够高,A-β分子在试管中可形成纤维状结构,而在阿尔茨海默病斑块中也发现有类似结构。试验证明,可溶性小体与A-β纤维对培养在皮氏培养皿中的神经元有毒害作用,并且前者会干扰小鼠学习和记忆过程中的关键步骤。
这些发现都有利于淀粉样蛋白连锁反应假说,但最有力的证据来自于对一些家庭,尤其是对阿尔茨海默病高危家庭的研究。这些家庭的成员携带有罕见的基因突变,这些突变注定他们在相对年轻的时候(一般在60岁以前)就会遭受阿尔茨海默病的折磨。1991年,约翰·A·哈迪(John A.Hardy,目前就职于美国国立老年研究所)及其同事,在编码APP的基因中发现了第一种这类突变,突变专门影响A-β部位内部和周围的蛋白区域。不久以后,哈佛大学的丹尼斯·J·塞尔凯(Dennis J.Selkoe)和佛罗里达州杰克逊维尔梅奥临床医疗中心(Mayo Clinic)的史蒂夫·扬金(Steve Younkin),分别发现这些突变促进了常见A-β或一种特殊A-β的形成,这种特殊的A-β极易形成沉淀。此外,唐氏综合征患者发生阿尔茨海默病的几率比正常人高很多,因为他们携带了21号染色体的3个拷贝而非正常情况下的两个―APP基因正好位于21号染色体。因此,唐氏综合征患者一生下来就会产生更多的A-β。在12岁时,他们的大脑中就会出现淀粉样蛋白沉淀。
很快,研究人员又发现了阿尔茨海默病与调控A-β生成的基因之间的其他联系。1995年,多伦多大学的彼得·圣乔治-希斯洛普(Peter St George-Hyslop)及其同事发现了存在于早老素1和早老素2(Presenilin1&2)基因中的突变,这种突变会导致早期急性阿尔茨海默病的发生,携带突变的人一般在30岁~50岁之间就会发病。进一步的研究表明,这些突变提高了易于聚集的A-β的比例。目前已经知道,两种早老素基因编码的蛋白正是γ-分泌酶的一部分。
因此,在已知的三种导致早期阿尔茨海默病的基因中,其中一种编码A-β前体,另外两种基因则专门负责合成蛋白酶的组分,以制造A-β。另外,科学家们还发现,如果某人的载脂蛋白E(将A-β聚集在一起形成小体和纤维)基因中存在特定的变异,那么在他晚年时,极有可能饱受阿尔茨海默病困扰。阿尔茨海默病的发生,很可能是各种遗传因素共同作用的结果,尽管每个因素都不是决定性的。小鼠实验表明,环境因素也可能是一个影响因素(例如,体育活动就可能降低患病风险)。
尽管科学家们仍未知晓A-β可溶性小体和不溶性纤丝破坏并杀死神经元的确切机理,但证据表明,神经元外的A-β聚集体会启动连锁反应,包括改变神经元内的tau蛋白。尤其是A-β聚集体将会彻底改变细胞内磷酸激酶的活动―磷酸激酶可将磷酸基团添加到tau蛋白上。受到影响的激酶会给tau蛋白添加过多的磷酸基团,于是改变了该蛋白的一些化学性质,并致使它们形成扭曲的纤丝。发生改变的tau蛋白会杀死神经元,可能是因为它们破坏了那些沿着轴突和树突传输蛋白分子以及其他大分子的微管。tau蛋白基因的突变也能生成tau纤丝,可以导致除阿尔茨海默病之外的其他神经退化性疾病。因此,tau纤丝的形成显然是导致神经元死亡的元凶,而A-β仅仅是阿尔茨海默病的特异性起始因子。

抑制蛋白酶活力
假如A-β在阿尔茨海默病的进程中起着至关重要的作用,那么很明显,产生这种肽的蛋白酶便是一个很好的药物靶标,只要抑制这些蛋白酶的活性就能达到治疗目的。目前,已证实蛋白酶抑制剂是一类非常有效的药物,例如治疗AIDS和高血压等疾病。A-β形成的第一步由β-分泌酶引发,该酶会把位于细胞膜外的APP部分剪切掉。1999年,5个不同的研究小组分别发现了β-分泌酶,在大脑神经元中,它的含量很高。虽然β-分泌酶被束缚在细胞膜上,但是它与在细胞内部和外部水环境中发现的一个蛋白酶亚群极为类似。这个亚群的成员包括与HIV(引发AIDS的元凶)复制有关的蛋白酶,它们利用天冬氨酸(氨基酸的一种)催化蛋白质剪切反应,具体实施剪切的则是一些水分子。为此,天冬氨酸蛋白酶家族的酶要用一对天冬氨酸来激活一个水分子。
β-分泌酶显然属于天冬氨酸蛋白酶家族,而对这一家族,研究人员已经有了充分的认识。因此,利用已有的知识,可以更好了解β-分泌酶以及研究抑制其活性的方法。事实上,研究人员已经知道β-分泌酶的三维结构,并以它为向导,辅以计算机,来设计β-分泌酶的抑制剂。遗传学研究表明,抑制该酶的活性不会产生毒副作用:敲除小鼠的β-分泌酶基因后,便没有发现小鼠大脑中有A-β形成,并且没有任何明显的负面作用。但是,目前β-分泌酶抑制剂仍未能投入临床试验,因为开发出能够有效穿过血脑屏障的小分子药物是一个巨大的挑战。与人体其他器官的血管不一样,大脑中的毛细血管衬有紧密堆砌在一起的内皮细胞。因为在这些细胞之间几乎没有空隙,所以蛋白酶抑制剂必须通过细胞膜,方能到达脑组织,但是大多数大分子药物都无法透过细胞膜。
γ-分泌酶执行A-β形成的第二步:在β-分泌酶剪切之后,对APP残余部分进行剪切。利用水分子剪切处于细胞膜内疏水环境的APP部分,γ-分泌酶完成了A-β形成过程中至关重要的一步。要认识这种蛋白酶,两个重要线索不可或缺。第一,1998年,比利时卢万天主教大学的巴特·德斯特罗珀(Bart De Strooper)发现,剔除小鼠的早老素1基因后,γ-分泌酶几乎无法剪切APP,说明该基因编码的蛋白对于γ-分泌酶的功能完整性是必需的;第二,我的实验室(当时在田纳西大学孟菲斯分校)发现,与天冬氨酸蛋白酶经典抑制剂属于同一类别的药物,能抑制细胞中的γ-分泌酶对APP的剪切。这一结果表明,与β-分泌酶一样,γ-分泌酶也含有一对天冬氨酸,并且对于催化蛋白剪切反应来说必不可少。
基于以上发现,我们猜测,早老素蛋白可能是嵌在细胞膜上的一种特殊天冬氨酸蛋白酶。在哈佛大学塞尔果实验室休假的同时(美国的公休假,每隔7年给予大学教师的最长1年的休假,支全薪或部分薪金, 让其进行研究工作或休息、旅行等),我与夏伟鸣合作,在早老素中发现了两个天冬氨酸,而且我们认为这两个氨基酸应该存在于细胞膜内。并且,我们还证明,对于γ-分泌酶剪切APP产生A-β这一过程来说,两个天冬氨酸都至关重要。接着,我们与其他研究人员都发现:γ-分泌酶的抑制剂会直接与早老素结合。早老素必须与其他三个膜包蛋白(嵌在细胞膜中,被细胞膜包被的蛋白质)聚集在一起,才能发挥催化功能。目前,γ-分泌酶被认为是一类新蛋白酶的创始成员,它们明显地利用细胞内的水分子来执行生化功能。幸好,γ-分泌酶抑制剂可能是一些很小的分子,能穿越细胞膜,透过血脑屏障。
两年前,我向读小学5年级的小儿子讲述我实验室的研究工作,解释了什么是淀粉样蛋白,以及我们如何迫切地希望抑制这些致病的酶,从而发现治疗阿尔茨海默病的药物。小男孩打断我的话问:“要是那种酶发挥着重要作用的话,结果会怎么样呢?你这样做可能会伤害到病人!”一个10岁小孩认识到的这个问题,确实非常实在:作为一种药物靶标,γ-分泌酶的潜力被这样一个事实所淡化—人体各个器官都存在一些未分化的前体细胞,在它们的成熟过程中(例如发展成红细胞和淋巴细胞的骨髓干细胞),γ-分泌酶发挥着重要作用。尤其是γ-分泌酶会对一种细胞表面蛋白(Notch受体)进行剪切,细胞膜内层的Notch片段被释放后,就会给细胞核发送信号,这个过程掌控着细胞的命运。
由于破坏了Notch信号,大剂量的γ-分泌酶抑制剂给实验小鼠带来严重的毒性效应,人们对这种潜在疗法忧心忡忡。尽管如此,礼来(Eli Lilly)制药公司研发的一种候选药物已在自愿者身上通过安全性试验,即一期(phaseⅠ)临床试验。该药物目前随时准备在早期阿尔茨海默病患者中进行二期(phaseⅡ)临床试验。此外,研究人员已经找到一些调节γ-分泌酶的分子,能抑制A-β的产生,却不会影响对Notch的剪切。这些分子并不与γ-分泌酶的天冬氨酸发生作用:它们能与酶的其他任何部位相结合,并改变酶的构型。
有些抑制剂甚至能明显抑制易聚集A-β的产生,却有利于一种更加短小的肽生成,而这种小肽不会轻易聚集。加利福尼亚大学圣迭戈分校的爱德华·库(Edward Koo)领导的一个研究小组,与美国杰克逊维尔梅奥临床研究中心的托德·戈尔德(Todd Golde)一起,发现了一种药物—Flurizan。在对早期阿尔茨海默病患者的临床试验中,Flurizan表现出色。目前,该药已经进入三期(phaseⅢ)临床试验,全美国有1000多名受试者参与了这一期的临床试验。

清除A-β聚集体
另一种治疗阿尔茨海默病的方案,就是清除大脑中的毒性A-β小体。一种方法是主动免疫,这需要调动患者自身的免疫系统来攻击A-β。1999年,南圣弗朗西斯科Elan公司的戴尔·B·申克(Dale B.Schenk)及其同事以基因工程小鼠为实验对象,进行了相关研究。正常情况下,这种小鼠的大脑内会出现淀粉样蛋白斑块。结果,他们开创性地发现,注射到实验小鼠体内的A-β引起了免疫应答,不仅能防止幼鼠脑内淀粉样蛋白斑块的形成,还能清除成年小鼠脑内已形成的斑块。在这些小鼠体内产生了能识别A-β的抗体,明显促使小鼠大脑内的免疫细胞—小神经蚀质细胞去攻击A-β小体。由于小鼠实验得到了令人欣喜的结果,例如小鼠学习和记忆能力的增强,因此人体试验得以迅速开展。
遗憾的是,虽然注射A-β的方法通过了最初的安全性试验,但是在二期临床试验中,数名参与试验的病人患上了脑炎。2002年,这项研究被迫流产。随后的研究表明,这种治疗方案可能促使免疫系统的T细胞对A-β小体进行过度攻击,从而引发脑炎。然而,研究证实,许多阿尔茨海默病患者都产生了A-β抗体。尽管迹象甚微,但这些患者的病情的确有所改善:记忆能力增强,A-β浓度降低。
由于担心主动免疫不够安全,研究人员开始尝试被动免疫―为患者注射抗体,以清除A-β。经过基因工程改良,利用小鼠细胞生产的抗体,可以防止在人体内产生免疫排斥反应。这些抗体引发脑炎的可能性很小,因为它们不会触发大脑中伤害性T细胞应答。Elan公司开发的被动免疫疗法已经进入二期临床试验。
主动或被动免疫如何清除大脑中的A-β?想起来有点不可思议,因为我们尚不清楚这些抗体是如何有效穿过血脑屏障的。一些证据表明,抗体可能并不需要进入大脑,只要将人体其他器官中的A-β清除掉,大脑中A-β便可能会自动出来,因为分子往往倾向于从高浓度区域向低浓度区域移动。目前,被动免疫似乎最有希望成功,但是主动免疫并非没有机会。在哈佛大学,我的同事辛西娅·莱梅尔(Cynthia Lemere)领导的课题组做了相关研究,初步研究表明,选择A-β的部分肽段而非全肽进行免疫,能刺激免疫系统中的B细胞产生抗体,却不会触发引起脑炎的T细胞应答。
还有一些研究人员正在探索非免疫疗法,阻止A-β的聚集。几家公司已发现一些药物,能直接与A-β发生作用,使它始终溶解于大脑神经元外的液体中,防止毒性斑块的形成。加拿大魁北克神经化学(Neurochem)公司正在研制Alzhemed,一种与天然抗凝剂―肝素极为相似的小分子。在血液中,肝素阻止血小板凝聚成血块,但是当肝素与A-β相结合时,A-β很容易形成沉淀。因为Alzemed和肝素都与A-β的同一部位相结合,所以Alzemed能阻止肝素与A-β相结合,从而降低A-β聚集的几率。即使在高剂量的情况下,Alzemed也未表现出毒性。一些中度阿尔茨海默病患者用药后,他们的认知能力有一定的改善。Alzemed的三期临床试验正在顺利进行。
开发激酶抑制剂
阿尔茨海默病有两个把柄,淀粉样蛋白只是其中之一,另一个则是引起神经元缠结的tau纤丝―抓住这个把柄,同样可能阻止大脑神经元退化。研究人员尤其致力于设计磷酸激酶抑制剂,因为正是磷酸激酶将过量的磷酸基团添加到tau蛋白上,才导致了tau纤丝的形成。这种努力尚未化作成果,目前还没有候选药物进入临床试验,但是激酶抑制剂仍有希望与那些将A-β作为靶标的药物一起,为战胜阿尔茨海默病而共同战斗。
抑制素是一种可以降低胆固醇浓度的药抑制素是否也
可用于治疗阿尔茨海默病呢?研究人员正在探索准确答案。流行病学研究表明,服用抑制素会降低患阿尔茨海默病的风险。对于出现这种相关性的原因,科学家们并非一无所知:通过降低胆固醇浓度,抑制素可以减少APP的产生,或者通过抑制分泌酶的活性,直接影响A-β的生成。三期临床试验正在进行,旨在确定诸如Lipitor(立普妥,又称阿伐他汀,辉瑞公司产品)之类的抑制素能否真正防治阿尔茨海默病。
另一个激动人心的最新进展与细胞疗法有关。加利福尼亚大学圣迭戈分校的马克·图辛斯基(Mark Tuszynski)及其同事,从中度阿尔茨海默病患者身上取下皮肤进行活检,并把神经生长因子(NGF)基因插入这些皮肤细胞。然后利用外科手术,将这些经过基因修饰的细胞植入这些患者的前脑。植入的细胞可能会产生并分泌NGF,防止丧失乙酰胆碱能神经元并增强记忆。就输送NGF而言,细胞疗法非常巧妙,因为NGF是一种生物大分子,正常情况下无法渗入大脑。尽管这项研究仅有少量的受试者,并且缺乏重要的控制手段,但是后续研究表明,细胞疗法延缓了患者认知能力的衰退。这些实验结果将是下一步临床试验的有力保证。
虽然这些潜在疗法不会全部成功,但是科学家们希望找到至少一种能有效延缓或阻止大脑神经元渐失的方法。一种方法就是一个突破,就能拯救数百万的人,让他们免受记忆遗失之苦,同时,也为研制恢复神经功能的再生性药物铺平道路。
将A-β作为靶标,可阻止阿尔茨海默病的发生或延迟发病的时间,但是对晚期患者是否有效,还不得而知,至少目前如此。不过,研究人员仍有充分的理由持谨慎乐观的态度。在大量最新的研究成果面前,大家信心百倍,我们为防治阿尔茨海默病所作出的努力,决不会竹篮打水一场空。
请 登录 发表评论