30多年前,面对癌症的挑衅,人类吹响了反攻的号角。时至今日,科学家们用汗水换来了令人瞩目的成就:一些儿科癌症已经可以治愈。以往,人们一旦患上这些癌症,就等于被判了死刑。现在,新研发的药物至少能控制某些癌症的病情,延长患者的寿命。2001年,格列卫(Gleevec)获准上市,它可以治疗慢性髓细胞白血病(CML)。在临床上,格列卫取得了巨大的成功,成为众多CML患者的保护神。但是,人类不应为此沾沾自喜,临床证据明确显示,这些患者并非真正逃离了死神的魔爪,因为恶性肿瘤细胞的“根”还在,癌症随时可能复发!
长期以来,人们一直认为,残留于体内的肿瘤细胞是癌症复发的凶手。因此,目前的治疗方法都采取了同一策略:竭力剿杀恶性细胞。虽然这一策略获得了巨大的成功,但对于身患晚期恶性实体肿瘤的患者,这种方法的预后很差。
其实,在CML和其他几类癌症中,仅有极少数细胞有能力产生新的恶性组织。靶向消灭这些特殊细胞,可能是癌症治疗最有效的途径。从根本上讲,这些细胞堪称癌细胞之母,它们本身可能就是恶性肿瘤的元凶——肿瘤干细胞。从字面上讲,肿瘤干细胞也可理解为:原本是正常的干细胞(或它们的子细胞)发生突变而形成肿瘤干细胞。
极少量的恶性干细胞就能导致癌症,对此,科学家们早已司空见惯。在上个世纪五六十年代,干细胞研究就扬帆启航,与实体瘤及血液恶性病变的研究热潮相伴而行。当健康组织发生恶变时,总会留下蛛丝马迹。通过对这些痕迹的观察,科学家们反过来摸索出了健康组织发生、发育的基本规则。
如今,干细胞研究的成果将引导对癌症的研究。在过去的50年中,科学家们向干细胞研究倾注了大量的心血,他们不断探索,完善着关于调节正常干细胞及其后代细胞行为的生理机制的理论。透过研究成果,科学家们惊讶地发现,在肿瘤组织中,有一群与干细胞行为极为相似的细胞——肿瘤干细胞,它是众多癌症的万恶之源!那么,正常干细胞是如何由一个“谦谦君子”沦为“恶棍”?只要找到答案,就有希望成功杀死肿瘤干细胞,根治癌症、解救患者便可手到擒来。
干细胞与癌细胞
人体是一台异常复杂的机器,由各种不同的组织器官构成,它们各司其职而又协调一致,共同维护着生命。但是,构成组织的每一个细胞的生命却又转瞬即逝:今天,你身上的皮肤已非30天前的皮肤,因为表层细胞已完全脱落,取而代之的是新生上皮细胞;肠道上皮完成更新只需两个星期;促进血液凝固的血小板的寿命仅有10天。
功能细胞的生命如此短暂,而它们又如此重要,那么人体是如何维持功能细胞的数目呢?人体的全身组织都采用了同一种方法,这是一种在所有复杂物种中通用的方法:干细胞分化。干细胞数目少,但寿命长,就像功能细胞的源泉,可以源源不断地提供新生细胞。在一系列严格有序的调节作用下,干细胞的子代细胞就能转变成特定的功能细胞。
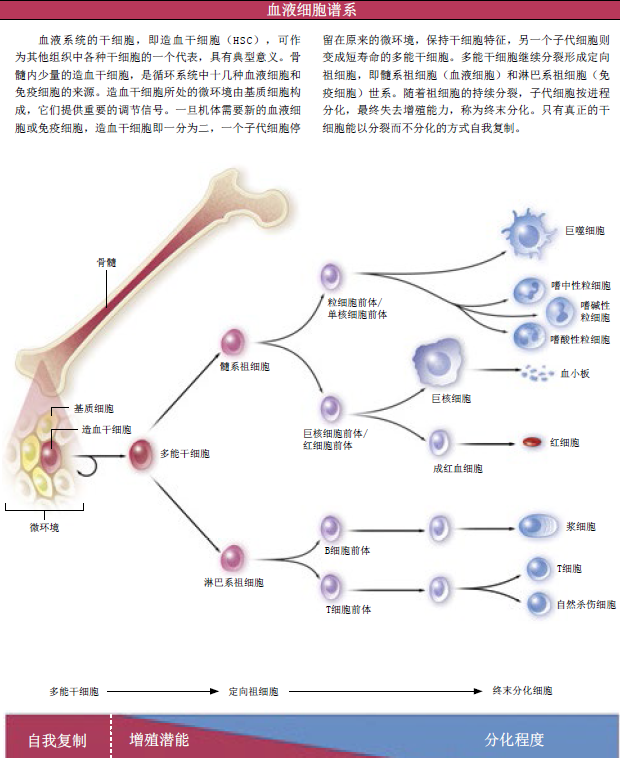
让我们来看看干细胞分化的典型实例吧。血液系统和淋巴组织中的所有细胞都来源于骨髓中的同一祖先:造血干细胞(HSC)。在成年人体内,造血干细胞不及骨髓总细胞数的万分之一,但正是这些数量极少的干细胞,产生了大量的、不同分化程度的前体细胞。较之造血干细胞,前体细胞有一定程度的分化,并能继续分裂增殖,进一步分化为拥有特定功能的成熟细胞:它们有的能抵抗感染,成为免疫细胞;有的能运输氧气,成为血红细胞。而细胞一旦进入特定的功能阶段,它们就丧失了增殖能力,它们的命运就被注定,这就是所谓的“终末分化”。
与此同时,干细胞却始终保持未分化状态,具有“自我复制”的潜能,这是干细胞的重要特性:为了生成新组织,一个干细胞分裂为两个子代细胞,但只有其中之一是前体细胞,它会逐渐分化成特定功能细胞;另一个子代细胞则保持干细胞特性。因而,干细胞数目总处于一个恒定的水平。在体内,前体细胞随时待命,一旦机体需要,它们就可以快速增殖,分化成特定的功能细胞群。
通过自我复制来维持自身数目的稳定,这是干细胞有别于其他细胞的重要特征。它们几乎长生不老,能无限增殖。相反,虽然前体细胞也能增殖、也能自我更新,但命运之手——内在计数机制,却精确地限制着它们的分裂次数,因而限制着它们的寿命。伴随逐渐分化,前体细胞产生子代细胞的能力持续递减。
造血干细胞及其子代细胞的在功能上有着重大差异。在移植实验中,这种差异体现得淋漓尽致。经放射线处理,小鼠的骨髓被摧毁,造血功能丧失。将前体细胞移植于骨髓后,小鼠的造血功能随即恢复。可惜这只是昙花一现,4~8周后,前体细胞消耗殆尽,造血功能得而复失。但是,哪怕只移植一个造血干细胞,小鼠的造血功能也能全部恢复,小家伙就能安度余生。
造血干细胞研究已走过了30多个春秋,但直至近年,才在人类的其他组织器官(包括脑、乳房、前列腺、大肠、小肠和皮肤)中,发现了类似的细胞谱系。在这些组织中,干细胞行为的调节机制非常相似,例如控制干细胞数目、决定干细胞的分化方向等。几条基因通路决定着干细胞的命运和功能。这些基因通路由数个基因构成,包括Bmi-1、Notch、Sonic hedgehog 和Wnt。意外的是,发现这些基因的科学家多数是癌症专家,而不是干细胞专家,因为在癌症的发生过程中,也能见到这些基因忙碌的身影。
干细胞和癌细胞就像孪生兄弟,有太多相似之处,这已经引起了科学家们的关注。癌细胞具有无限的生命周期、旺盛的增殖能力、犀利的侵袭能力(对邻近组织)以及强大的迁移能力(向远隔组织),它们演绎着恶性化的经典概念。对正常细胞而言,分裂增殖受到严格限制,而癌细胞则冲破了这一限制。
干细胞的自我复制能力,让它们摆脱了有限生命周期与增殖能力的束缚。它们具有分化潜能,可以分化为各种类型的细胞,形成某一组织器官。同样,肿瘤组织也是多种细胞的混合体,只是相对于正常组织,它是那么凌乱、那么邪恶。在损伤信号的刺激下,造血干细胞也可像癌细胞一样,远距离迁移至相应位置。
在严格的基因调控机制下,干细胞是正常的,保持着无限增殖和分化的能力。而一旦调控机制失控,灾难就降临了:干细胞露出邪恶的一面,向着肿瘤干细胞演变!干细胞和肿瘤细胞的相似性,以及细胞增殖实验的证据传递着这样的信息:调控干细胞自我复制与增殖的失败是癌症发生的起点,是导致癌细胞获得永生化的原因,可能也是恶性化组织得以扩散的元凶。
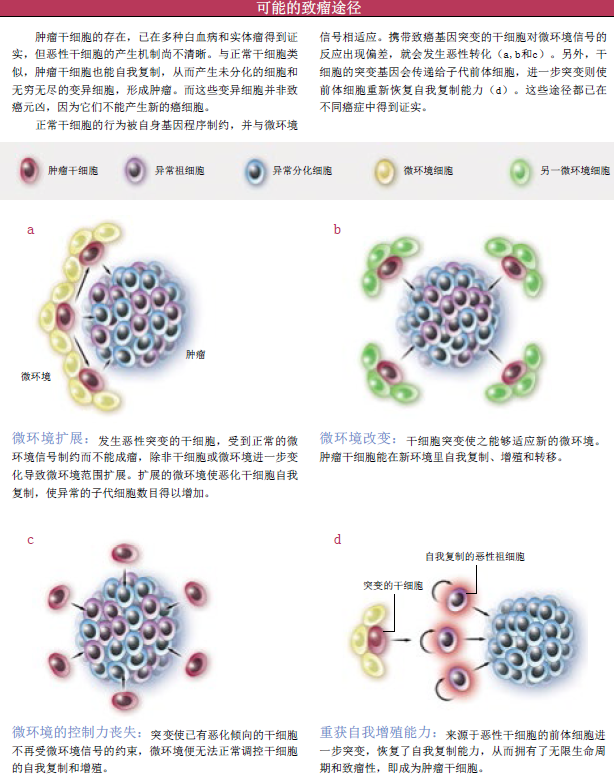
恶化源于突变
在某些特定组织,尤其是肠道和皮肤等更新速度快的器官,以干细胞增殖分化的方式来修复损伤和更新衰老细胞,这是一个复杂而又缓慢的过程。假若每一个细胞都能增殖,都能满足修复损伤、更新换代的要求,岂不是更简单、更有效?表面看来也许如此,但如果真是这样,那么每一个细胞都可能是潜在的癌细胞!
在某些细胞中,关键基因发生“致癌”突变,并不断积累,导致细胞生长、转化异常。基因突变的方式多种多样:DNA的直接损伤,如细胞暴露于射线或某些化学物质的环境中;细胞分裂前,基因复制不当,发生随机突变。在那些易于发生癌变的组织中,干细胞的数量极少,因为干细胞越多,发生突变累积的机会也越多。尽管如此,干细胞还是最有可能变成基因损害的“收容所”,因为它的寿命实在太长了。
那些遭受辐射或长期接触毒素的组织,为什么在长达数十年之后才会发生癌症?干细胞的长寿给出了合理的解释。一系列基因突变是细胞恶性转化的必要条件,而最初的损伤,也许只是基因突变的开头。除了积累和保存致癌性损伤外,干细胞超强的增殖能力,也使它成为恶性突变的最佳靶点。因为干细胞的自我复制受到严格的调控,所以较之普通细胞,较少的突变事件就可能导致恶性转化。
通过分析,癌变逐渐露出了它的狰狞面目:其一,干细胞本身发生突变,自我复制失控,从而产生一群恶性化的肿瘤干细胞。随后一系列的恶性转化发生于这些肿瘤干细胞或其子代细胞——肿瘤前体细胞,肿瘤细胞,最终形成肿瘤;其二,最早的恶性突变仍然发生于干细胞,只是最终的恶性转化仅发生于肿瘤前体细胞,而且还需要这些前体细胞的自我更新能力失而复得。
这两种模式在不同的癌症中都得到了证实。在慢性髓细胞白血病中,两种模式在病程发展的不同阶段起作用。慢性髓细胞白血病是由于两个基因不正常融合所致,这一融合成为了转折点:正常造血干细胞转变为白血病干细胞。如不经治疗,慢性髓细胞白血病就会进入白血病急性转化期。斯坦福大学医学院的卡特里奥纳·贾米森(Catriona Jamieson)和欧文·韦斯曼(Irving Weissman)证明,在慢性髓细胞白血病急性转化期的患者中,特定的基因事件赋予了某些前体细胞新的自我复制能力。
揭开癌变之谜
过去10年的发现,使人们强烈地意识到:干细胞会发生恶性突变,肿瘤细胞和干细胞有一些共同特性,一群干细胞样的肿瘤干细胞,是肿瘤生长的动力之源。多年前,这一理论就已经为人们所知,但是落后的技术拖了后腿,人们无法验证这一理论。
早在20世纪60年代,一些科学家就注意到,在同一肿瘤内,存在不同的细胞亚群,它们的增殖能力或强或弱,有的可以产生新的肿瘤组织,有的却不能。1971年,加拿大多伦多大学的C·H·帕克(C. H. Park)和同事们发现,取自同一原发性骨髓瘤(发生于骨髓浆细胞的恶性肿瘤)的细胞,在进行体外培养时,它们的增殖能力却极为不同。当时,他们无法确定这一现象是偶然的,还是另有原因,因为至少有两种说法可以解释这一现象:一是所有肿瘤细胞都有增殖能力,但只有部分进入增殖状态;二是肿瘤中存在一系列细胞,其中,肿瘤干细胞产生了无致瘤倾向或无增殖能力的细胞。
1967年,华盛顿大学的菲利普·J·菲亚尔科(Phillip J. Fialkow)才提出,干细胞成因学说才是对白血病的正确解释。采用G-6-PD这一细胞表面蛋白作为细胞谱系的标志,他们发现,在某些女性白血病患者中,无论是致瘤细胞,还是分化程度更高的非致瘤细胞,它们都来源于同一母细胞。
早期研究对肿瘤的干细胞成因学说意义重大,但由于技术方面的限制,科学家们无法直接从肿瘤中分离和检测不同的细胞亚群。20世纪70年代,在干细胞研究领域,发生了一件里程碑式的大事件:流式细胞仪商品化。流式细胞仪可以根据细胞表面标志的不同,自动分选出不同的活细胞群体。
20世纪90年代,肿瘤干细胞研究取得了又一重大进展,多伦多大学的韦斯曼和约翰·迪克(John Dick)发明了一种使正常人类干细胞能够在小鼠体内存活增殖的实验技术,这项技术是一种检测人类细胞自我复制能力的方法。1994年,迪克采用流式细胞术和这种开创性小鼠实验,确认了白血病干细胞的存在,并发表了一系列的文章。2003年,约翰·霍普金斯大学的理查德·琼斯(Richard Jones)从多发性骨髓瘤中也分离得到了肿瘤干细胞群体。
我们的实验小组在密歇根大学安阿伯(Ann Arbor)分校。2003年,我们首次报道了实体瘤内的肿瘤干细胞。我们将乳腺癌细胞分离为不同的群体,并分别移植到小鼠体内。实验证明,在新环境中,并非所有的乳腺癌细胞都具有形成新肿瘤的能力。只有其中的一个亚群,在新的环境中能再生新的肿瘤。随后,我们对小鼠新生瘤和患者原发瘤的细胞表型、生理特征进行比较,发现两者具有惊人的相似性。这些发现说明,移植的致瘤细胞不仅有自我复制能力,还能分化为原发瘤中的所有细胞群体,包括非致瘤细胞。
我们的研究也证实,乳腺癌与血液恶性肿瘤有一个共同之处,那就是存在一个细胞谱系式的细胞群体。自此,世界各地的实验室也相继在其他肿瘤中,发现了类似的致瘤细胞亚群,肿瘤干细胞的研究可谓遍地开花。在2004年,多伦多大学的彼得·德克斯(Peter Dirks)实验室发现,取自人类中枢神经系统原发肿瘤的细胞,也能在小鼠体内形成完整的新生肿瘤。进一步实验发现,传说中的肿瘤干细胞,大量存在于生长最快的成神经管细胞瘤中,而在那些致瘤性低、侵袭性小的脑肿瘤中,仅有少量的致瘤细胞。
目前,另一研究热点似乎也成为肿瘤的干细胞成因学说的忠实拥趸:细胞外信号环境(Niche),即微环境,对肿瘤的发生和维持起着重要的作用。对正常体细胞和干细胞研究后,科学家们发现,细胞邻近组织与细胞外基质会发出信号,而正是这些信号维持着干细胞特性、调节着干细胞行为。体细胞一旦脱离其生理环境,比如置于培养皿中,就会迷失自我、丧失原有功能和特性;与之相应,培养干细胞时,必须在培养基中添加一定的信号分子,从而使它处于未分化状态,否则干细胞就会依照默认途径增殖、分化。可见,干细胞的微环境至关重要。
在机体中,所谓干细胞微环境是指包围着干细胞的特殊细胞类群,例如在骨髓中构成结缔组织的骨髓基质细胞,就是干细胞的微环境。除少数例子外,干细胞总是处于微环境之中,通过黏附分子介导发挥生理功能。相反,前体细胞随着分化进程从微环境中迁出,在相随细胞的护送下,继续完成分化进程。
通常情况下,微环境发出信号来抑制干细胞分化,使它们处于静息状态。一旦局部微环境信号发生改变,就会激活干细胞。肿瘤干细胞所处的微环境是否具有同样的作用呢?几个振奋人心的实验给出了肯定答案:先对干细胞进行致瘤性突变处理,再移植到正常的微环境中,没有观察到有肿瘤发生;相反,如果先用放射线破坏组织微环境,那么移植至此处的正常干细胞肯定会生成肿瘤。
干细胞及其微环境信号与癌症发生相关,许多相同的基因通路存在于干细胞和肿瘤细胞,这些都说明,在干细胞最终发生恶性突变的过程中,微环境起关键作用。例如,发生恶性突变的干细胞处于微环境监控之下,当微环境发生变化、范围扩大,恶性干细胞就会获得扩展空间;因为致癌突变,肿瘤干细胞变得更加“坚强”,能适应多种不同的微环境,于是它们也能“招兵买马”、扩展领地;突变赋予了肿瘤干细胞更为强大的能力,使它们完全摆脱了原微环境的控制,自立门派。
寄希望于未来
从干细胞角度来理解癌症发生,使我们对癌症及癌症的治疗有了更清醒的认识。目前,流行的治疗方法是消灭肿瘤中快速增殖的细胞。但最新的研究显示,有能力重建肿瘤、维持肿瘤的肿瘤干细胞的数量极少。传统治疗虽然能够缩小瘤体,但却使肿瘤干细胞成为漏网之鱼,使癌症频频复发。未来的治疗策略,将以这群肿瘤干细胞为靶标,摧毁癌变的原动力,而那些非致瘤细胞终将自然耗尽,一去不复返。
正所谓不能以貌取人,识别干细胞也不能仅仅依赖细胞形态,当务之急是研发强有力的工具和技术,分离并研究这群神秘而少见的细胞,认清它们的特征,揭开它们的秘密。一旦我们获知肿瘤干细胞的特征,就能据此制定合理的治疗方案;如果能发现导致肿瘤干细胞获得自我复制能力的突变或环境信号,我们就可以有的放矢,靶向消灭致瘤细胞。
罗彻斯特大学的克雷格·T·乔丹(Craig T. Jordan)和莫尼卡·古兹曼(Monica Guzman)给我们展示了一个重要的研究策略。2002年,他们在急性髓细胞白血病(AML)的恶性干细胞中,发现了一个独特的分子标志,带有这个标志的干细胞能够被某些药物特异识别。去年,他们又从菊科植物中提取了一种药物,能够诱使AML干细胞自杀,而正常干细胞却不受影响。
目前,针对肿瘤干细胞的治疗策略多种多样、见仁见智:利用免疫细胞来识别和追踪肿瘤干细胞;应用现有的药物改变微环境信号,使肿瘤干细胞与其微环境之间的联系中断,阻止它们增殖;寻找促使肿瘤干细胞分化的新药,剥夺它们的自我复制能力。
最重要的是,我们已经发现了疑凶作案时遗留下来的蛛丝马迹,如果以肿瘤干细胞特有的基因进行靶向治疗,切断肿瘤干细胞与其微环境之间的联系,相信在不久的将来,我们就能揭开癌症之谜,根治癌症。
请 登录 发表评论