“超级病菌入侵城市”——听起来这很像是一部科幻电影,却是2007年10月26日《纽约邮报》头版头条的标题。在这则新闻刊出12天前,美国纽约市布鲁克林区的12岁小男孩奥马尔·里维拉(Omar Rivera)在篮球场玩耍时不小心受伤,伤口感染耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA),不治身亡。里维拉感染的这种病菌,能对抗当前最有效的抗生素。
健康人感染病菌后无法治愈,这似乎是抗生素诞生前的事,却在21世纪初真实“再现”了。2007年,据世界卫生组织统计,每年全球有数百万人感染耐药性金黄色葡萄球菌,其中约30%的人最终会不治身亡——这比HIV的致死率还高。而且在日常生活中感染这种病菌的年轻人的比率还在不断上升。以前,只有在医院和疗养院才会发生类似感染事件,因为病人的免疫系统有缺陷,容易感染细菌。对于感染者而言,即使能康复,也要付出沉重的代价:至少住院10天,花费3万美元。
为了治疗耐药性金黄色葡萄球菌感染,每年全世界的总花费超过200亿美元,而金黄色葡萄球菌还只是众多越来越难对付的病原体中的一种。人们一度认为,致病细菌已被征服,但现在看来,如果不尽快研制新型抗生素,那么在这场与病菌的战斗中,最终的失败者将是人类。
耐药菌的产生
耐药性金黄色葡萄球菌的例子告诉我们,病菌能迅速产生耐药性。而了解金黄色葡萄球菌和其他病菌产生耐药性的天然机理之后,你就会发现,耐药性的产生几乎不可避免,所以我们必须不断开发新型抗生素。
甲氧西林(methicillin)是青霉素(penicillin)的衍生物,从1959年开始,医生们就用它治疗感染了金黄色葡萄球菌、肺炎链球菌(Streptococcus pneumoniae)等病菌的患者——当时,这些病菌都已对青霉素产生了耐药性。然而好景不长,两年后,科学家又在欧洲国家的医院中,发现了耐甲氧西林金黄色葡萄球菌。到上世纪80年代,这类耐药菌已遍布全球的医疗保健场所。1995年前后,科学家又发现了一种新的耐甲氧西林金黄色葡萄球菌,它的传播区域不是医疗机构,而是公共社区。
这种耐甲氧西林金黄色葡萄球菌很难对付,因为它一进入人体的血液系统,就会迅速扩散。最致命的是,它能合成一种酶,破坏药物结构,从而对一类重要抗生素——β内酰胺类抗生素(beta-lactams),包括头孢菌素和所有类型的青霉素,产生耐药性。如果β内酰胺类抗生素无法对付耐甲氧西林金黄色葡萄球菌,医生能用的抗生素就非常有限,而且都会产生严重副作用。最糟糕的是,一些耐甲氧西林金黄色葡萄球菌对万古霉素(vancomycin)也产生了耐药性,这种药物是医生目前的几种选择中疗效最好的一种。
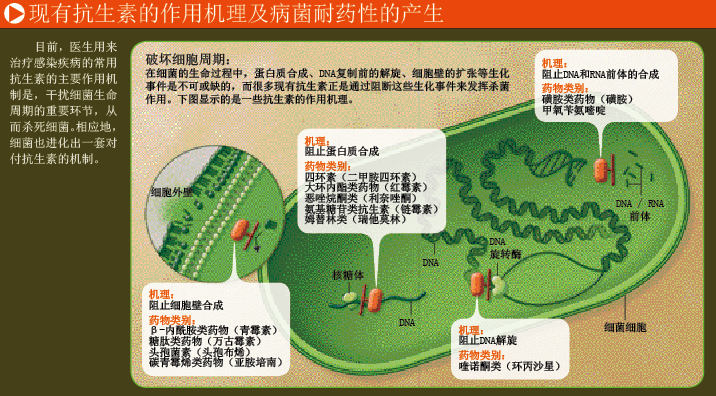
耐甲氧西林金黄色葡萄球菌产生对万古霉素的耐药性,让医生和药物研发者意识到一个严重问题:从一种抗生素投入临床使用的那一刻起,它的疗效就开始走下坡路。导致这种现象的根本原因是自然选择:当我们使用某种抗生素时,就会人为创造一种环境——只有对这种抗生素具有耐药性的病菌才能存活,其他病菌则走向死亡。万古霉素的上市时间可追溯到1958年,耐甲氧西林金黄色葡萄球菌出现后,它就成为治疗金黄色葡萄球菌感染的“主力”。2002年,科学家在医院中发现了能对抗万古霉素的耐甲氧西林金黄色葡萄球菌——“耐万古霉素金黄色葡萄球菌”(vancomycin-resistant S. aureus,VRSA),是耐甲氧西林金黄色葡萄球菌的后代。它们拥有一个耐万古霉素的“基因盒”,由5个基因组成,能像盒子一样整体移动。这些基因编码的酶可以改变万古霉素在病菌细胞壁上的作用位点,使万古霉素无法与相应位点结合,让作为医生手里“最后一张王牌”的万古霉素,彻底失去了抑制耐万古霉素金黄色葡萄球菌生长的能力。
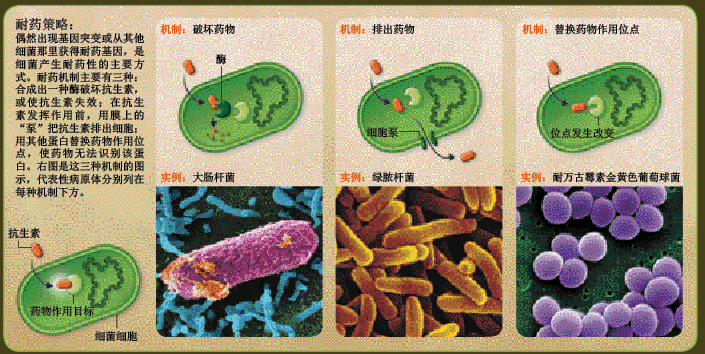
改变抗生素的作用位点,是病菌逃避药物攻击的三大策略之一;另一种策略是利用耐药基因编码一种酶,对抗生素进行破坏或化学修饰,限制药效的发挥。耐甲氧西林金黄色葡萄球菌对β内酰胺类抗生素的耐药性就是通过这种机制实现的。最后一种策略是由耐药基因编码一个“泵”,安置在细胞膜上,将进入细菌细胞的抗生素排出,使抗生素浓度低于致死剂量。
这些耐药基因是如何出现的?一些是细菌基因经过随机突变产生的,比如环丙沙星(ciprofloxacin)及其他氟喹诺酮类(fluoroquinolone)抗生素的作用位点是细菌细胞内的一种酶,但编码该酶的基因发生随机突变后,合成的酶就能对抗这类抗生素的攻击。还有一些耐药基因是从邻近细菌那里获得的。包含5个基因的耐万古霉素“基因盒”最初出现在合成万古霉素的细菌中,因为它们需要这个“基因盒”来保护自己不受万古霉素的侵害,其他细菌可能就是通过细菌间的基因交换,获得了耐万古霉素的“基因盒”。
基因交换通常以质粒(plasmid)为载体。质粒其实就是环状DNA片段,它们的特性就像是脱去“外衣”的病毒:能从一个细菌转移到另一个细菌,而且这些细菌会把它们看作自身DNA,并用自己的复制系统帮助它们进行自我复制。为了便于在细菌间传播,质粒通常带有能帮助寄主存活的基因,其中就包括耐药基因。科学家曾在一个污水处理厂发现一种细菌,从中分离出的质粒竟带有9种编码不同抗生素耐药性的基因。

2002年,在美国密歇根州一家医院接受透析治疗的病人身上,研究人员同时分离出耐甲氧西林金黄色葡萄球菌、耐万古霉素金黄色葡萄球菌和粪肠球菌(Enterococcus faecalis),发现病菌间确实存在基因交换现象。对这三种病菌进行的遗传分析还显示,一个含有耐万古霉素基因盒的质粒(其中还含有其他三种耐药基因和一种抗消毒剂基因),从粪肠球菌转移到了耐甲氧西林金黄色葡萄球菌,从而产生了第三种病菌——耐万古霉素金黄色葡萄球菌。
因此,如果一位慢性疾病患者感染了两种病菌,他的体内再出现第三种病菌就不奇怪了。由于医院的重症监护病房和疗养院通常聚集了大量免疫力低下,需要接受高强度抗生素治疗的人群,这些场所就成了“孵育”新型耐药菌的温床。医生和护士们在病室里穿梭往返,为患者更换静脉导管、导尿管等医疗设备,病菌在不知不觉间就通过他们的双手完成了大范围转移。这就是医护人员每次接触不同患者前先洗手,就能明显降低耐药菌感染率的原因。

到目前为止,虽然耐万古霉素金黄色葡萄球菌的传播范围还比较小,但只有极少药物能有效抑制或杀灭它们,因此这类感染的致死率非常高。新近出现的另一类病原体——泛耐药革兰氏阴性菌(pan-drug-resistant gram-negative bacteria)甚至具有更强的耐药性。革兰氏阴性菌有两层细胞膜,在外层细胞膜的保护下,很多抗生素都无法进入细菌细胞。换句话说,现在临床使用的所有抗生素,对这类病菌几乎都不能构成威胁。致病性革兰氏阴性菌包括能导致食物中毒的大肠埃希氏菌(Escherichia coli)及其近亲肺炎克雷伯氏菌(Klebsiella pneumoniae),还有两种“机会主义”病菌——铜绿假单胞菌(Pseudomonas aeruginosa)和鲍曼不动杆菌(Acinetobacter baumannii),它们能乘虚而入,让医院里免疫力低下的患者染上肺炎、脑膜炎和菌血症。
显然,医护人员必须尽一切努力,阻止耐药菌在医疗机构和公共社区扩散(包括耐药基因的转移)。但是,仅靠医护人员的努力还不够,科学家必须尽快研制出新型抗生素来对抗耐药菌。
上世纪30年代末到60年代初是抗生素开发的黄金时代,目前使用的大部分抗生素都是那段时间开发的。遗憾的是,从1962年喹诺酮类抗生素(quinolones)上市,到2000年恶唑烷酮类抗生素(oxazolidinones)通过上市申请的40年间,抗生素研发一直处于停滞状态,没有一种新型抗生素投入临床使用。造成这种状况的原因有两个:一是相对于“生活方式类”药物(用于治疗长期存在的慢性疾病,比如高血压和关节炎),抗生素开发难度较大,利润回报率却很低,制药公司不愿意开发抗生素;现有的抗生素研发技术已经过时,要开发新抗生素必须要有新策略。
改造抗生素
现有抗生素中,大部分是由细菌和真菌合成的,或是天然抗生素经化学修饰后得到的衍生物。细菌合成的抗生素不仅可以对付其他微生物,当分泌量较低时,还能充当信号分子。科学家筛选天然抗生素的传统方法,是从土壤样本中分离微生物,拿到实验室里用培养基培养,再从培养基中提取微生物的分泌物。然后,科学家会测试分泌物中各种化学成分对致病菌的抑制或杀灭效果,再根据测试结果,分离出具有潜在医用价值的单一药物成分。利用这种方法,制药公司已测试过几百万种细菌分泌物,但只有10类天然抗生素最终成为可使用的药物,其他抗生素由于各种原因(比如抗菌效果差、毒性难以掌控等),未能得到广泛使用。

在抗生素开发的黄金时代,这种方法非常有效,但现在似乎已经走到尽头。过去50年,尽管制药公司从未停止筛选抗生素,新发现的抗生素却越来越少,其中一个很重要的原因是抗生素雷同:大多数能分泌抗生素的细菌会形成孢子并到处传播,与抗生素合成相关的基因也会像耐药基因一样在细菌间转移,导致多种微生物合成相同的抗生素。近期的一项调查显示,在最常见的抗生素产生菌——放线菌(actinomycetes)中,每250种就有一种能合成四环素(tetracycline)。如此的高重复率让一些研究人员认为,“抗生素矿”已经枯竭,但遗传分析结果并不支持这一结论,看来是时候采用新的开发策略了。
不过,科技进步常使老学科焕发生机,抗生素开发似乎也将迎来“第二春”。目前,开发新型抗生素的方法有两种:修饰已有抗生素或者合成全新类型。对细菌合成的抗生素进行化学修饰后,研究人员就能得到“半合成”抗生素,它在病菌上的作用位点与天然抗生素一致,但部分结构有所改动。最近,科学家开始利用这种方法改造四环素类抗生素。四环素的抗菌机制是抑制细菌的“蛋白合成工厂”——核糖体的活性,病菌则依靠细胞膜上的“泵”来对抗四环素的攻击——在四环素发挥作用前,就将它们泵出细胞。在泛耐药革兰氏阴性菌中,这种耐药机制非常普遍。
美国惠氏制药公司的研究人员合成出一种经过化学修饰的四环素,名为替加环素(tigecyclin),能避免被病菌细胞膜上的药物泵排除出细胞。2005年,经美国食品及药品管理局(FDA)批准,替加环素已用于治疗各种耐四环素的感染性疾病。但由于需要通过静脉注射的方式给药,这种药物仅限于在医疗机构内使用。不幸的是,科学家已经发现了能对抗替加环素的鲍曼不动杆菌,这种耐药性究竟能以多快的速度在病菌中传播,时间会给出答案。
除了直接修饰青霉素、万古霉素和红霉素(erythromycin)等天然抗生素,科学家还可以对合成抗生素的细菌进行基因改造。合成抗生素时,大部分细菌都有一条庞大的装配线——多个酶组成一个装配团队,每个团队负责安装抗生素分子上的一个组件。只要通过基因技术,改造某个“酶团队”,科学家就能让细菌合成出与天然抗生素只有一个位点差异的新型抗生素。美国百时美施贵宝公司旗下的Kosan生物技术公司,就是利用这种基因工程技术合成了多种红霉素衍生物。如果采用普通的化学修饰手法,很难取得这样的成效。
尽管修饰现有抗生素是一个不错的选择,并已取得了不少成果,但研究人员还是渴望开发全新品种,因为面对新型抗生素,病菌不大可能在短时间内产生耐药性,而这正是现有的数代抗生素都无法打破的“魔咒”。
寻找新型抗生素
近年来,新药开发的重点是鉴别细菌存活所必需的关键酶,如果某种化学物质能抑制这些酶的活性,就可能成为一种抗生素。不过,在寻找化学物质前,科学家首先要确定,关键酶的活性受到抑制后,将会对细菌产生什么影响。一旦破解了细菌的基因组序列,研究人员就可以选择性地抑制特定关键酶的基因,观察在缺失这种酶的情况下,细菌还能否存活。
尽管上述努力还没能转化为成果,但前景相当乐观,也许明年就能找到新型抗生素。科学家面临的一个难题是,细菌的细胞壁能阻碍药物分子的进入,也就是说,即便我们发现了能强力抑制细菌关键酶的药物,如果它无法进入细菌细胞,接触不到关键酶,也不能对细菌产生任何影响。除了在病原体上寻找突破口,还有一个办法,就是从抗生素产生菌的基因组着手。
2002年,科学家首次测定了一种抗生素产生菌的基因序列,发现了一个很有意思的现象:从序列来看,放线菌平均含有25~30组基因,似乎都负责编码合成抗生素的酶,但细菌只会使用其中的一小部分。在实验室培养时,这些放线菌通常只合成1~2种抗生素分子。
为了研究放线菌体内的“休眠”基因是否会编码与抗生素合成相关的元件,我们和哈佛大学医学院、哈佛大学-麻省理工学院联合学院的同事,又测定了20种放线菌的基因组序列,然后运用复杂的计算机算法,筛选出所有编码与抗生素合成相关的酶基因。研究这些基因周围的DNA序列,也有助于我们了解细菌如何决定何时启动抗生素的合成。综合上述两类信息,我们就可以利用基因技术,按自己的意愿让放线菌启动某个基因的表达,从而测定基因表达产物是否具有抗生素活性。
与“哄骗”放线菌合成我们想要的抗生素不同,德国萨尔大学的一个研究小组采取了另一种策略:把负责合成抗生素的基因从细菌中提取出来,转入更适合合成抗生素的菌株中。罗尔夫·穆勒(Rolf Müller)及其同事的研究对象是粘细菌(myxobacteria),这种细菌和放线菌一样,都是抗生素的“生产大户”。但在实验室里,培养粘细菌要比培养放线菌困难得多,因此科学家很少在粘细菌中寻找新型抗生素。
穆勒巧妙地解决了这个难题。他先从橙色标桩菌(Stigmatella aurantiaca,粘细菌的一种)中提取合成抗生素myxochromide的基因,然后转入很容易培养的恶臭假单胞菌(Pseudomonas putida),这是商业合成工业用酶的常用菌株。穆勒的工作解决了两个关键问题:一是找到了便于基因改造,并具有合成抗生素所需基本“代谢设备”的细菌宿主;二是发明了一种技术,能将大段DNA从一个细菌转移到另一个细菌。他开辟了研究粘细菌的新途径,也让很多科学家意识到,大规模测定粘细菌基因组,对于寻找新型抗生素具有重要意义。
除了研究已知土壤细菌,科学家还应注意一些从未开发过的生态环境,这些地方也许有很多惊喜正等待发现,因为生活在特殊环境中的细菌很可能会合成我们尚不知晓的抗生素。德国蒂宾根大学的罗德里希·苏斯姆特(Roderich Süssmuth)和同事,就给了我们这样一个惊喜:他们从一块采自日本海289米深处的沉积物样本中,分离出一种放线菌,结果发现这种细菌能合成一种名为abyssomicin的新型抗生素。美国斯克里普斯海洋研究所的布拉德利·摩尔(Bradley Moore)、威廉·费尼可(William Fenical)和同事,正在研究海洋细菌,目前已经完成两种未知海洋细菌的基因组测序工作。他们发现,这些细菌中与抗生素合成相关的基因序列和已知细菌的有很大差异,这说明在开发新型抗生素方面,海洋细菌是极具潜力的研究对象。
在新生态环境中寻找抗生素的另一个思路是研究共生菌。共生关系在自然界很普遍,两种生物生活在一起,“互惠互利”,但分开以后都不能独立生存。南方松甲虫(southern pine beetle)就携带着一种共生真菌,当它们钻进松树后,身上的真菌有助于分解松木。最初,人们一直不明白甲虫如何保护共生真菌,让它们在与其他细菌争夺食物的过程中获胜。后来,美国威斯康星大学麦迪逊分校和哈佛大学医学院由卡梅伦·科里(Cameron Currie)、乔恩·克拉迪(Jon Clardy)领导的研究小组发现,松甲虫身上还有一种共生微生物,属于放线菌类,可以合成某种当时科学家还不了解的强力抗真菌物质。这种分子现在被称为mycangimycin,可以杀死其他竞争真菌,但不会影响共生真菌。
德国波恩大学约恩·派尔(Jorn Piel)发现,另一种甲虫与一种海绵也携带着能合成抗生素类物质的共生细菌。德国汉斯诺尔研究所(Hans-Knoll Institute)的克里斯蒂安·赫特维克(Christian Hertweck)还发现,一种真菌本身就携带有共生菌,可以合成名为根霉素(rhizoxin)的抗生素类药物。鬼臼霉素和喜树碱是常用的抗癌药物,人们一直以为它们是植物本身合成的,实际上合成这两种药物的都是植物携带的真菌。尽管对共生微生物的研究才刚刚开始,它们却是最有潜力的天然抗生素来源,科学家很可能从中发现新型抗生素,或具有全新作用机制的抗菌药物。此外,研究人体自身的共生微生物也是开发抗菌疗法的新途径。
定向杀灭病菌
人类和昆虫、海绵一样,携带有种类繁多的共生细菌。从帮助食物消化到促进免疫系统发育,共生细菌在人体内发挥着多种功能。然而,目前市场上的抗生素不够“智能化”,在消灭病原体的同时,很多寄宿在肠道内的有益共生菌也会遭殃。有时,杀灭胃肠道的微生物群反而会为有害细菌的入侵、繁殖提供方便(如艰难梭菌,Clostridium difficile),引起继发性感染,危害程度甚至超过最初的感染。
一些科学家据此提出了一种抗感染方法:给病人服用有益微生物或促进人体共生细菌生长的药物,让有益微生物或共生菌去对抗病原体。这种方法叫做“益生菌疗法”,虽然可以避免抗生素滥用,防止耐药病菌的产生,但并没有报道证实,该方法能有效治疗现有感染性疾病。
不过,人们至少已经认识到,人体肠道菌群能预防感染性疾病,这种认识催生了一种新的抗菌思路:开发定向药物,专杀致病细菌,而不影响正常菌群。最近,英国Prolysis公司的尼尔·斯托克思(Neil Stokes)和同事,研发出一种很有潜力的新型抗生素,可以在不影响其他细菌的情况下,阻止细菌细胞分裂,有效杀灭金黄色葡萄球菌及其亲缘微生物。美国加利福尼亚大学圣迭戈分校的维克托·尼日特(Victor Nizet)、安德鲁·王(Andrew Wang)与伊利诺伊大学的埃里克·欧菲尔德(Eric Oldfield)领导的研究小组,把这一理念又向前推进了一步。他们发现,一种药物可以阻断金黄色葡萄球菌内一种色素分子的合成——这种分子对于金黄色葡萄球菌的致病性非常关键,受到药物影响后,金黄色葡萄球菌虽然失去了致病能力,却不会死亡。
削弱病菌致病力方法的一个好处是,可以避免耐药菌的产生。如果药物不会杀死细菌,“自然选择”就不会偏爱耐药菌,它们的进化之路将不再顺畅。同样,定向抗菌的关键就是要找到一些特殊的“细胞组件”作为药物靶标,它们是某种病原体独有的或必不可少的,而在其他细菌中却不是必不可少的。这样一来,即使该病原体逐渐产生耐药性,也无法在细菌间传播,因为对于其他病原体来说,这种耐药性没有什么用。
不管是单独使用还是结合其他疗法一起使用,上述治疗法最终能否在临床上应用还有待时间的检验。患者用药前,医生必须对患者进行快速诊断,找出具体的致病病原体,虽然相关诊断方法已经开发出来,但尚未普及。另外,定向杀菌的药物应用面很窄,很难引起制药商的兴趣。
当然,世界上也没有能抵抗所有病菌的抗生素。上世纪六七十年代,我们曾一度以为人类已征服感染性疾病,但最近,很多媒体又声称,多重耐药菌的出现使抗生素“走到尽头”。现在,我们知道这两种说法其实都不正确:在和病原体的对抗中,人类不可能始终是胜利者,但至少在过去一个世纪,抗生素的出现让我们得以领先病原体。不过,人类要想保持优势,还需要不断努力。
请 登录 发表评论