一个单基因的突变就可以宣判亨廷顿病患者的死刑。
科学家们正致力于研究这个突变损伤神经元的机制,这将为今后的临床治疗工作提供有力的指导。
砰!一个茶杯从他的手中滑落;突然间他忘记了经常联系的妹妹的电话号码;在马路上,他猛然间说出一连串诅咒的话,还莫名其妙地追赶刚才拦路的司机……难道这些都是那可怕的警告信号吗?
对于48岁的船舶业务代理人马丁(Martin)来说,一些在别人看起来很普通的笨拙、健忘或者由紧张引起的过度反应,对他则是极大的不幸。这些年来,他一直用警惕的目光审视着自己和兄弟姐妹,任何一个小失误都被他认为是不祥的预兆。但是,在最近的一连串不幸发生之后,他再也忍受不了自己那毫无休止的猜疑,去医院做了血液检查。3天后,化验结果证实了他从小就一直害怕面对的事实:他携带一种遗传突变,而他的妈妈、舅舅和祖父正是死于这种突变。
100多年前,人们就意识到亨廷顿病(Huntington’s disease)具有遗传性,但直到1993年人们才发现它的致病性突变。很快,人们开始利用血液标本中的DNA检测技术来诊断体内是否携带异常的基因型,这种异常的基因型可以导致脑、肌肉以及精神功能的进行性损伤。如果一个人的父母或者其他亲戚患有亨廷顿病,他将面临非常恼人的选择:究竟该不该做DNA检测?阳性结果意味着恶魔的诅咒——因为目前这还是一种致死性的不治之症;而如果不去管它,则要简单得多——因为大多数人直到中年才会发病,而且病情进展缓慢。然而,后者对自己到底有没有亨廷顿病的质疑会一直盘绕在心头,充斥着生活的每一个角落,就像马丁一样。
对美国3万名已确诊为亨廷顿病的患者进行的调查显示,适当的治疗措施会延缓疾病的发展,也可以在很大程度上减轻患者的压力,并延长寿命。科学家们正致力于研究这种基因突变在神经元内部的损伤机制,这将为今后的临床治疗工作提供有力的帮助。
疾病的致命性
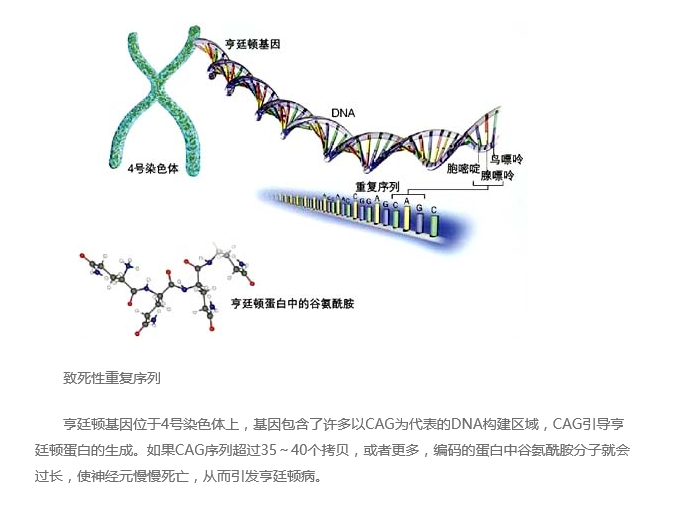
亨廷顿病是由4号染色体上亨廷顿基因的异常引起的,由于是单个基因致病,因此,对于亨廷顿病的检查准确度较高。典型的基因结构中同时存在几个DNA构建区域的重复单位:胞嘧啶(cytosine),腺嘌呤(adenine)和鸟嘌呤(guanine),缩写为CAG。CAG可以促进亨廷顿蛋白的产生,而且,CAG的拷贝数越多,亨廷顿蛋白中的谷氨酰胺(glutamine,氨基酸的一种)含量越高。正常的基因可以有28个CAG序列拷贝,当多于35或40个拷贝时,亨廷顿蛋白中的谷氨酰胺链就会加长——麻烦来了。CAG越多,谷氨酰胺链越长,携带者越早发病,而且临床症状越严重。
对于马丁来说,基因检测已经证实了他曾惧怕的猜测,而他毅然决定尝试看看到底自己能为此做些什么,于是他来到位于德国波库的鲁尔大学北莱茵河威斯特伐利亚亨廷顿病研究中心(North-Rhine-Westphalia Huntington Center)进行相关咨询。这个研究中心目前为600多名亨廷顿病患者和他们的家庭提供服务。马丁对咨询员说:“我接受现实的命运。”然后他问道:“我现在应该做些什么才能对以后控制病情有所帮助呢?”中心的工作人员就马丁的具体情况进行讨论,并制定了几套治疗方案。
突变基因表达过多的CAG序列可由单亲遗传。因此,只要父母双方有一个人携带致病基因,子女就会有50%的携带可能。波库的治疗师追溯马丁的家族遗传史时,马丁回忆说:“当时,我的祖母一步步走向火车,我想她一定知道自己在做什么,”马丁没有继续下去,只是暗示性地表示,她那时已经知道了自己的命运,“而我祖母的爸爸在年老后变得非常奇怪。”尽管马丁的妈妈生前没有明确的基因诊断,但是很明显,她也患有亨廷顿病。
马丁和他的姐姐苏珊妮(Susanne)最后鼓起勇气做基因检测,就是因为再也忍受不了自己一味的猜疑——同时,他们也想好好地规划一下自己以后的生活和工作。苏珊妮也携带了有缺陷的基因,而他们其他的兄弟姐妹没有做基因检测,他们选择逃避知晓自己临近死亡的几率。
现在,距离马丁摔破杯子、忘记电话号码的那个周末已经有两年了,他第一次表现出了亨廷顿病的典型症状:手臂和大腿的突然颤动。而苏珊妮目前则没有任何症状出现,但她还是忍不住想知道,这种她以前从来没有注意过的无害性动作是否就是随之而来的困扰的先兆。亨廷顿病通常的发病年龄为35-45岁,但亲属之间的发病年龄和起病过程可能会有很大的不同。没有人愿意将马丁10岁的儿子视为下一个受害者,而儿科医生也宁愿相信小男孩目前的疼痛、肌无力和精细的协调障碍是由其他疾病引起的。但是,孩子有这样的症状已经6年了,马丁也已经被确诊,于是,医生为他做了基因检测。结果,马丁的儿子被诊断为儿童期亨廷顿病,这是一种少见的由极度延长的亨廷顿基因导致的疾病。
冷酷的疾病进展
几个世纪以前人们已经认识到亨廷顿病,只是那时还没有给出确定的疾病名称。中世纪,一些被认为是“舞蹈”受害者的人去德国乌尔姆的圣维特斯(Saint Vitus)礼拜堂做祷告,后来,人们就把圣维特斯作为这种病的名字,即圣维特斯舞蹈病(Saint Vitus’dance)。1872年,年轻的美国神经科医生乔治·亨廷顿(George Huntington)第一次发现了这种疾病具有遗传性。乔治和他父亲一起在纽约长岛的一个家族中收集病例,并把这种病与链球菌感染引起的、有相似症状的小舞蹈病区别开来。如今在美国,每1万人中就有1个人患有亨廷顿病。
从疾病的最原始命名中,我们就可以看出它的主要症状,即类似“跳舞”的动作——肢体夸张的摆动就是它最频繁、最显著的表现。开始时,患者会试图掩饰像耸肩这样的抽搐和颤动,或者将它转化为有目的的运动,如舒展肢体等。但是,慢慢地,肌肉变得难以控制。患者可能会突然间扮个鬼脸,而且说话和吞咽变得越来越困难。疾病后期,肢体的运动速度减慢,肌肉收缩幅度加大,有时肢体疼痛和扭曲的症状甚至会持续几分钟或几个小时。
通常,在躯体症状出现的几十年前就会出现特征性的神经系统症状,主要表现为患者的喜怒无常,情绪不稳定。而做完基因检查后,阳性患者意识到自己即将面临疾病的困扰,这也会让他们变得情绪不稳定。家属经常会发现患者性格上的改变——他们变得偏执,毫无理由地妒嫉周围的人,并且专横地对待亲人,或者因为很小的意见不和便大动干戈。随着疾病的恶化,他们会被芝麻蒜皮的小事困扰几天或几周,这给家庭带来了沉重的精神负担,并且破坏了个人的社会关系。同时,患者的认知能力也会下降,记忆力减退,越来越难以集中精力,最后会发展到严重的痴呆甚至完全丧失自理能力。就算是在疾病的早期,严重的心理障碍也会给患者的生活和工作带来极大的危害,他们经常会有自杀的念头。
遗传信息的崩溃
一直在研究导致亨廷顿病的肌肉和精神异常机制的学者们,首先必须搞清楚为什么这种病会累及不同年龄段的人群。他们发现很多其他的遗传因素同亨廷顿基因突变一起,在疾病发展的过程中起到了非常重要的作用。比如,脑内神经元受体与谷氨酸结合的难易程度就会发生很大的变化,而神经元受体在神经元之间的信息传递中起到信使分子的作用。这种受体蛋白的协助决定了疾病的发展速度。
亨廷顿病虽然相对罕见,但是现在已成为人们探讨神经变性疾病[包括帕金森病(Parkinson’s)和阿尔茨海默病(Alzheimer’s)]如何引发脑损伤的热点。从发现亨廷顿基因至今的13年里,科学家们对它损伤神经元的机理已经有了一定的了解。亨廷顿蛋白是这种疾病的唯一致病因素,它提供了一个可以不夹杂其他复杂因素进行研究的途径。
亨廷顿蛋白本身并不是一个“坏”蛋白。它在哺乳动物胚胎期发育中起到了重要的作用。但是,当在人类体内发生突变时,过长的蛋白会与其他对细胞存活至关重要的蛋白结合起来,从而损害正常的生理功能。
这些与细胞存活相关的蛋白包括转录调节因子,它的主要功能是确保遗传信息的准确读取,当亨廷顿蛋白与同一个细胞内的转录因子结合时,会使亨廷顿蛋白的遗传活性紊乱,并导致细胞蛋白合成调控障碍。其中有些转运神经递质(信使分子)的蛋白在这个过程中没有被合成,神经递质如谷氨酸,就是在神经元之间的突触缝隙中传递信息的。当突触中残留了大量的谷氨酸,邻近的神经元就会不断被激活;而这种过度活性表达最终将对细胞造成损害。这种称为兴奋性中毒的现象已经在动物实验中得到了证实。
现在越来越多的证据表明,亨廷顿蛋白在神经元中的作用比我们曾经认为的要复杂得多。一个被称为亨廷顿交互反应性蛋白1(huntington interacting protein 1,HIP-1)的分子主要功能是辅助神经元中信使分子的分泌和再摄取,而过长的亨廷顿蛋白链不能正确地与亨廷顿交互反应性蛋白1结合,这将导致一连串的酶级联反应,启动细胞凋亡,即细胞的程序化死亡。这可以看作是神经元的诱导性自杀。
观察发现,过长的基因可以导致亨廷顿蛋白的错误折叠,人们以此为基础提出了另一个理论。错误折叠的蛋白可能会扰乱神经元的新陈代谢,有证据表明,线粒体(细胞“动力工厂”)呼吸链中的几个步骤会因此无法正确地发挥作用,这将会导致细胞能量的缺乏,最终使细胞死亡。
寻求治疗方法
目前,研究人员已经提出了一些改善这种致死性细胞崩裂的办法。但是,各种药物治疗仅对控制亨廷顿病的症状有效。比如,一些神经科医生用精神镇定药物来缓解肌肉的过度收缩,这些药物对患者的活动有限制性的副作用。还有些医生用抗抑郁药、镇静药或抗精神病药物来缓解患者的精神症状。然而,现在仍然没有治疗心理能力丧失的方案,而马丁对此的恐惧要远远大于对肌肉病痛的恐惧。
世界上很多实验室都在寻求可以延缓或者阻断神经元损伤的药物。现在的研究结果中,谷氨酸拮抗剂可以调节谷氨酸的分泌;利鲁唑(riluzole)这种化合物已经被用来治疗一种严重的快速进展性神经系统疾病——肌萎缩性侧索硬化,或称为路·盖里格氏病(Lou Gehrig’s)。这种药目前正在欧洲范围内对450名亨廷顿病患者进行临床试验。
科学家们对抗生素米诺环素(minocycline)也寄予了厚望。2003年,美国哈佛大学医学院的罗伯特·M·弗里德兰德(Robert M. Friedlander)对患有亨廷顿病的小鼠进行了试验,结果表明,米诺环素可以抑制引发神经元自杀的酶的活性。
还有一种物质,可以阻碍加速神经元死亡的、错误折叠的亨廷顿蛋白的聚集。2004年,日本理研脑科学研究所的科学家用多种荒漠植物产生的海藻糖抑制了蛋白的聚集,从而延缓了发病时间。
医生们也在人体内发现了一些可以用作治疗的物质,如辅酶Q(coenzyme Q)和肌酸(creatine)。 辅酶Q在人体中广泛存在,它通过俘获氧自由基,来发挥抗氧化的作用,并且可以限制亨廷顿蛋白的损伤作用。肌酸在肝脏和肾脏中产生,可以改善肌肉和脑细胞中的能量贮存。动物试验已经证实了上述作用,但是在人体试验中现在还没有明确的证据。
研究人员也在尝试基因治疗。2005年,美国爱荷华大学的贝弗莉·L·戴维森(Beverly L. Davidson)和斯科特·Q·哈珀(Scott Q. Harper)成功抑制了小鼠突变的亨廷顿基因活性。他们把精确模拟突变蛋白遗传指令的RNA片断注入动物大脑中,最终阻止了动物体内突变蛋白的合成。试验结果表明,这些啮齿类动物的致病性亨廷顿蛋白减少了。
干细胞也有助于疾病的治疗。2000年,法国克雷泰伊的亨利·蒙多尔大学医院(Henri Mondor University Hospital in Creteil, France)的安妮-剀瑟琳·巴舒-莱维(Anne- Catherine Bachoud-Lévi)把从流产胎儿体内取出的神经元干细胞移植到亨廷顿病患者大脑内,试图研究这些干细胞能否取代患者体内的受损细胞。两年后,美国南佛罗里达大学的罗伯特·A·豪泽(Robert A. Hauser)也进行了类似的尝试。在这两组试验中,一些患者对治疗有反应,但是其他的人则发生了脑出血,使病情更加严重。所有接受基因治疗的患者都需要服用阻断免疫排斥反应的药物。
现在,马丁已经无计可施,没有任何办法来阻止病情的无情发展。但是,从整个亨廷顿病研究的历程来看,以前从来没有任何时候像现在这样,有如此之多的新治疗方案正处于研究当中。欧洲和美国的科学家正在筹备一项更大规模的研究,许多亨廷顿病患者以及还没有做血液检测,但是根据家族史推测有患病风险的人也会参加到这次研究中来。希望在这些科学家和自愿者的帮助下,我们最终能够得到令人满意的治疗方案,拯救那些像马丁一样的亨廷顿病患者。
请 登录 发表评论