染色体动了 疾病来了
撰文 汤姆·米斯特利( Tom Misteli)
翻译 杨宁宁
十年前,人类基因组序列公布,向世界展示了人类的基因蓝图。但是,正如一张汽车配件表不能告诉我们汽车引擎如何工作,完整的基因组序列——人类细胞所有染色体上的DNA“字母”表,也无法显示基因组如何指导细胞的日常活动,如何使个体从一个受精卵发育成具有活动能力的成人。
为了更好地理解基因组作为一个整体如何指挥这首名为“生命”的生物活动交响乐,我和基因组细胞生物学(genome cell biology)这个新兴领域的其他科学家正在研究,染色体及其上面的基因在细胞核这个三维空间内是如何排列的,这种组织结构对染色体及基因又有怎样的影响。

新型3D成像技术让我们可以更加深入地观察活细胞。借助这些技术,我们已在细胞内部发现了一个令人吃惊的、生机勃勃的“生态系统”。在细胞核内,相邻染色体发生物理上的相互作用,染色体上的基因根据它们要完成的任务,迁移到细胞核中的不同位置,而调控基因活动的分子则聚集在一片繁忙的“枢纽地带”。对于基因组如何维持我们的健康、包括特定癌症在内的某些疾病如何产生,这些新发现让我们有了新的认识,一些新的疾病诊断技术或许会因此出现。
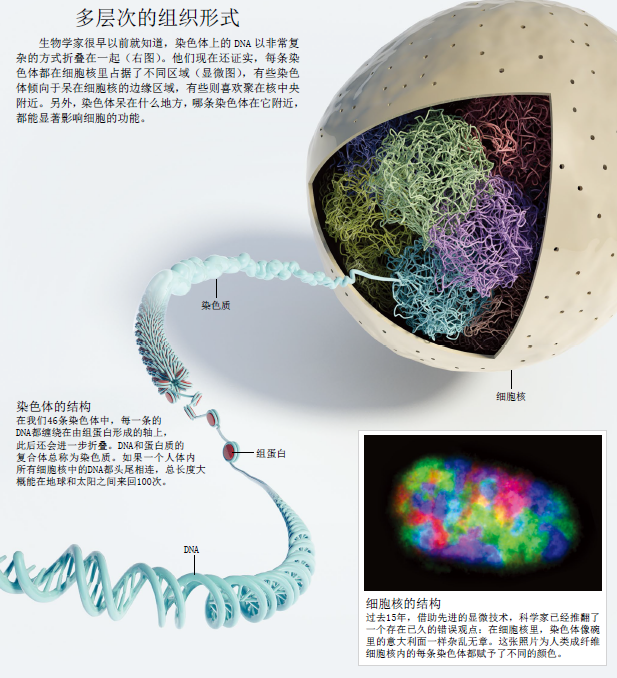
“像一碗意大利面”
近年来的进展都始于上世纪80年代的一些发现。当时,生物学家发现,在细胞分裂期间,染色体会高度压缩,呈沙漏状结构——这是我们大多数人想到携带着基因在人类中世代相传的染色体时,它们出现在我们脑海中的样子。生物学家还知道,细胞没有分裂时,染色体的结构较为松散,并在这种状态下完成日常工作。松散的结构让科学家很难把一条条染色体区分开来,就算用最高级的显微镜也不行。曾有一种流传甚广的说法是,在没有分裂的细胞中,乱作一团的染色体就像一碗杂乱无章的意大利面。
这种看法一度十分流行,但也有一些与此相反的发现。上世纪初,德国一位名叫特奥多·博韦里(Theodor Boveri)的细胞生物学家就反对基因组结构的“意大利面模型”。根据对马蛔虫所做的研究,他认为尽管在细胞的生命周期中染色体的形状和大小都会发生变化,但在细胞核中,每条染色体都占据在特定的不同区域。他把染色体占据的区域命名为“染色体领地”。但由于染色体很难观察,而且博韦里研究的蛔虫也不是生物学界常用的实验模型,他的“染色体领地”的概念在很长一段时间里都没引起多少注意。
直到另外两位德国科学家——托马斯·格雷默(Thomas Cremer)和克里斯托弗·格雷默(Christoph Cremer)兄弟发明了一种技术,能够标记和显示细胞核里小范围内的染色体时,“染色体领地”的概念才得到了实验证据的明确支持。上世纪80年代初,格雷默兄弟发现,用一束激光击中细胞核内特定区域中的DNA时,只会有几条染色体打上了标记。如果在细胞核中,染色体是像此前认为的那样胡乱缠绕在一起,每束激光应该会击中多得多的染色体。
几年后,科学家完善了标记和显示所有染色体的方法,定位更精确,色彩更鲜明。这种方法叫做“染色体涂色”(chromosome painting),是将带有荧光标记的“标签”添加到单条染色体的DNA序列上。每条染色体都可以标上不同的荧光标记,从而对它们进行精确定位。这些研究明确显示,在细胞核中,每条染色体都是一个独立存在的实体,各自占据着一个独立的空间(见右页显微图像)。
这一发现引发了很多疑问,基因组细胞生物学家正在寻找答案。在细胞核中,染色体的分布是否像参加自由席会议的与会者一样,可以随意占据一个位置?还是说染色体在细胞核内只能在“指定座位”就坐?更重要的是,它们所处的位置会不会影响基因的活性?
沉寂的细胞核边缘
我们现在知道,每条染色体都倾向于占据自己偏爱的位置。在人类白细胞内,18号染色体通常“挂在”细胞核的核膜上,而19号染色体喜欢呆在中间部位,7号染色体则徘徊在两者之间。每条染色体喜欢的位置距离细胞核的边缘或远或近,它们占据偏好位置的这种倾向,在细胞核内形成了一种很明确的“邻里关系”。因此,只要是来自同种生物的细胞,每条染色体在细胞核中的“邻居”通常都是那么几个。比如,在研究小鼠白细胞时,我和同事发现12号染色体总是和14号、15号染色体相邻而居。
不过,染色体的位置并非一成不变。我的实验室发现,染色体在不同类型的细胞中排列方式也不同。其他科学家还发现,染色体的排列方式在机体发育或病态情况下也会改变。而且,一条染色体所处的位置,似乎会影响到它所携带的基因能否表达。
科学家发现,某些基因的活性发生变化时,它们的位置也会改变。这就暗示,一个基因在细胞核内的位置对它的活性可能有重要影响。对一种名为GFAP的基因所做的跟踪研究为我们提供了一个例子。星形胶质细胞(astrocyte)是一种大脑细胞,通常带有GAFP基因的两个拷贝,其中一个是活跃的,能合成该基因编码的蛋白质,另一个则是“沉默”的,不会合成蛋白质。我们实验室的滝沢琢己(Takumi Takizawa)发现,那个“沉默”的拷贝通常靠近细胞核边缘,活跃拷贝则位于细胞核的中央区域。在编码防御性抗体的基因中,其他科学家也发现了类似的定位现象。抗体又叫做免疫球蛋白(immunoglobulin),外源细胞的入侵会促使白细胞分泌这类蛋白质。当外源细胞的出现导致白细胞处于警戒状态时,带有IGH基因(编码免疫球蛋白的组成单元)的染色体就会朝细胞核中央移动。综合这些发现,我们不难看出基因的位置影响功能的一条简单规律:处于细胞核边缘的基因通常都处于“沉默”状态。

会不会是细胞核外侧有什么东西促使基因变得“沉默”?初步给出肯定答案的,是上世纪30年代的一次观察研究:科学家发现,细胞核边缘排列着一些异染色质(heterochromatin),这是高度压缩的染色体区段。如果你有超自然视力,可以看见染色体内部,你会看到染色体由DNA双螺旋构成,它们会自我卷曲成一根粗“纤维”,被称为染色质(chromatin),然后缠绕在组蛋白(histone)形成的一根根“轴”上 (见第63页插图)。染色质纤维自身还会进一步卷曲,压缩得更紧。异染色质是一种特殊形式的染色质,卷曲得特别紧,通常能够阻止前来“读取”基因信息的蛋白质接触染色质上的基因。
当然,这项早期的观察研究无法揭示,基因“沉默”是由于它身处细胞核边缘,还由于其他原因,这些高度压缩的染色质才被吸引到边缘区域的。不过到了2008年,在几个实验室精心设计的一系列实验中,前一种说法得到了证实。科学家把活跃的基因从细胞核中央的正常位置移开,把它们“拴”在核膜上时,这些基因的活性通常都会降低。因此,细胞核的边缘区域至少能使一些基因“沉默”。
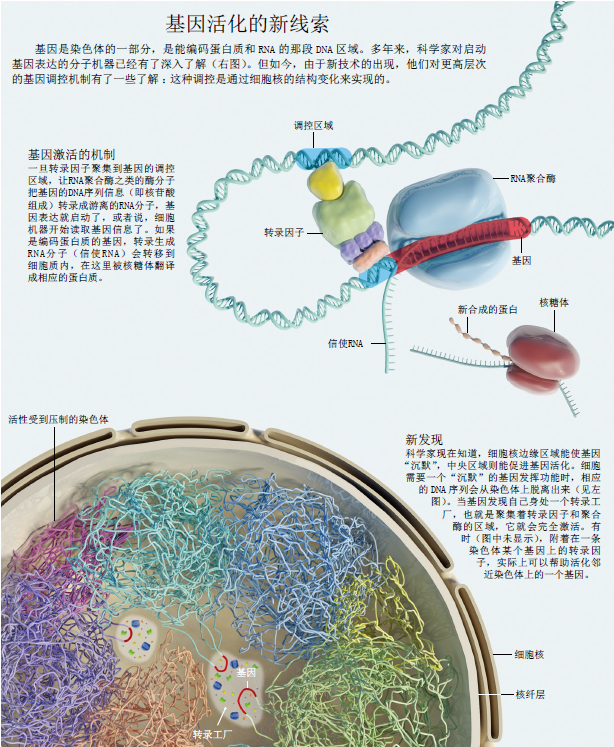
除此之外,细胞核的中央区域可能还会给需要经常或迅速发挥作用的染色体和基因提供一些特殊物质:被称为“转录工厂”的一系列蛋白质聚集物 。这些蛋白质都是激活基因所需的细胞组件,包括核酸聚合酶(polymerase,能把DNA转录成指导蛋白质合成的mRNA)和转录因子(transcription factor,结合到基因的调控区域,启动聚合酶转录过程的蛋白质)。
细胞中存在“转录工厂”,最早是由英国牛津大学的彼得·库克(Peter Cook)在1993年提出的。他在研究中注意到,聚合酶会聚集在细胞核中的某些位点读取基因信息,但无论何时,细胞核内活跃基因的数量都要比这些位点多得多。对于这种表达模式,一个很明显的解释是,多个基因聚集到“转录工厂”,在此处共同使用聚合酶和转录因子(见第64页图)。这种解释其实有先例可循:在细胞核中,有一个可用显微镜观测到的亚结构叫做核仁(nucleolus),有时会有成百上千的基因聚集在此,一起转录成细胞中蛋白质合成机器的关键组件——核糖体RNA。
位置决定健康?
虽然基因组细胞生物学家还未弄清在细胞核不同区域调控基因活性的所有机制,但我们已经证明,基因在细胞核中的位置会影响个体的发育和健康。
在胚胎干细胞研究中,对于基因在胚胎的正常发育过程中组织形式如何变化,科学家有了一个惊人的发现。胚胎干细胞堪称“万能细胞”,能分化为人体中约220种特化组织中的任何一种,比如神经细胞、血液细胞或肌肉等。不同于完全分化的细胞,功能多样的胚胎干细胞内没有使基因“沉默”的大片异染色质区域,也没有可把“沉默”基因束缚在细胞核边缘的核纤层蛋白(lamin)。结果,在胚胎干细胞的基因组里,几乎 每个基因都保持较低水平的活性。
假如胚胎干细胞收到一个信号,要分化为骨细胞或者神经元,它们的细胞核结构就会发生巨大变化:核纤层蛋白出现并汇聚在一起,紧密交织成一种垫状物——核纤层(nuclear lamina),紧贴在细胞核膜的内侧。科学家认为,这层支撑性的作用是维持细胞核的形状,防止外部机械压力损害染色体。不过,核纤层似乎还参与了正常的基因调控。仅携带较少活性基因的染色体片段含有一种特殊的结构蛋白,会把这些染色体片段压缩成异染色质,并把它们结合到细胞核边缘的核纤层蛋白上。这种隔离,让多基因染色体片段可以更接近细胞核中央区域,更容易接触到能激活基因的“转录工厂”。这样一来,在胚胎发育期间,核纤层蛋白的出现让细胞可以把不需要的基因驱逐到细胞核的“边境”区域,使它们无法表达。
特定染色体片段的“流放”,对于成熟细胞中正常的基因运行可能至关重要。核纤层蛋白失常时发生的情况证实了这种推测。核纤层蛋白的变异会导致一系列人类疾病,包括肌萎缩、神经障碍,甚至早衰。这些疾病都叫做核纤层蛋白病(Laminopathy),可冠以这种名称的疾病多得异乎寻常:某一特定基因的任何突变一般只会导致一种疾病,这是大多数疾病的情况,但核纤层蛋白的变异不同,通常会引起各种各样的疾病。细胞生物学家还不清楚不正常的核纤蛋白如何导致这些疾病。一种可能是,这种蛋白的变异削弱了核纤层的强度,以至于无法保护细胞核免受机械压力的损害,结果导致细胞的抵抗力减弱,基因组的大部分区域都受到物理损伤,引起细胞死亡。另一种有趣的推测是,受损的核纤蛋白在功能上打了折扣,不能有效地组织基因组,结果将某些基因安置在错误的区域,可能扰乱了基因的正常运作。
后来,科学家对核纤层蛋白病患者进行了研究,绘制出了病人细胞中染色体的确切位置,结果表明后一种推论更具说服力。一项研究显示,如果13号和18号染色体的位置从细胞核周边反常地移动到中央区域,就会在人体内埋下核纤层蛋白病的种子。不过现在还不能确定,染色体位置的变更到底是疾病的起因还是后果。
在一些癌症中,染色体的位置变化明显起着非常关键的作用。恶性细胞内常会发生染色体易位(translocation)——一个染色体片段从一条染色体上断开,连接到另一条染色体上,从而形成异常染色体(见第67页图)。有时,由于染色体的连接会产生突变基因,使细胞过度增殖,这种易位就会引发癌症。在其他情况下,染色体易位只是一个“旁观者”,没有明显作用。
事实证明,哪些染色体会相互连接,产生致癌性易位现象,是受染色体在细胞核内的位置影响的:在细胞核内聚在一起的染色体相互连接的几率较高。拿伯基特氏淋巴瘤(Burkitt’s lymphoma,常见于非洲)来说,很多患者在8号染色体上的MYC基因与14号染色体的IGH 基因之间都有易位现象。在一些罕见病例中,MYC基因会跟2号染色体上名为IGK的免疫球蛋白易位。在更为少见的病例中,MYC基因甚至会与22号染色体上的IGL基因发生易位。2003年,我们实验室的杰弗里·洛伊克斯(Jeffrey Roix)发现,MYC基因与3个易位对象之间的平均距离,跟它们之间易位频率存在准确的对应关系,这就意味着,基因间的距离和易位概率紧密相关。从那以后,科学家又在其他多种疾病中发现了相同的联系。
我们实验室还发现,一条染色体断开时,断裂的那一端仍然靠近原位,不会游离到距断裂发生点很远的地方。这一发现解释了,为什么聚在同一区域的染色体相互结合的几率要高于相隔较远的染色体。这也解释了,为什么特定的易位现象是某一组织,而非其他组织发生癌变的标志:因为在不同组织内,染色体的分布方式不同。就像在肾细胞里相互靠得很近的染色体,它们之间的易位在肾癌细胞中观察到的几率要远高于其他癌症,因为在其他组织的细胞(如白细胞)中,这些染色体之间的距离一般较远。
在这一研究领域,最令人兴奋的进展是,科学家现已认识到,我们对染色体在细胞核内通常所处位置的了解,也许代表了一种新的癌症检测手段。 一些初步研究已经证实,对基因位置的观测有助于判断细胞是否会癌变。在乳腺癌的一项初步研究中,我们实验室的凯伦·米伯恩(Karen Meaburn)发现,有好几个基因在肿瘤细胞和正常乳腺细胞中的位置都不同。事实表明,这几个基因是很好的乳腺癌标志物:根据它们的位置变化,我们可以非常准确地鉴别出癌变组织的样本。在恶性细胞中,有些基因甚至在细胞开始恶变之前就已经改变了位置。因此我们有理由期待,基因定位分析有一天会成为一个很给力的分子工具,用于帮助医生诊断极早期癌症。
自我组织的细胞核
基因组细胞生物学领域的终极问题是,什么因素决定了基因或染色体在细胞核中的位置。当细胞朝着特化方向分化时,细胞核中的基因和染色体怎么知道移到什么位置?它们又如何到达那里?
理论上的一种可能是,染色体是由某种细胞机器“护送”到合适的位置的。也许是一种能与DNA结合的蛋白质,它会识别并结合到染色体上的特定基因序列,然后在“分子发动机”(molecular motor protein)的协助下,将那部分染色体拖移到细胞核的特定位置。但到目前为止,还没人观察到这类系统。而且也很难想象,细胞中居然存在这样一个信号系统,能将一系列位置坐标传达给染色体上的DNA,引导它们在细胞核的中央区域“闲逛”,或带着它们拜访所有基因都很喜欢的“转录工厂”。
我们提出的假说有些不同:细胞核定位是自发的,有点像中学生中的小群体,他们是因为共同的爱好聚在一起,而不是在家长或老师的指使下这么做。从这个意义上说,细胞核里基因和染色体的位置是它们自身活动决定的,而非受到某些外在机制的推动。反过来,它们的位置也影响着它们的活动。
这种自我组织如何实现呢?让我们看看一个成熟细胞中,一个基因开始对某个信号(如一种激素)作出反应时,在自我组织式的细胞核里会发生什么。信号到达细胞前,基因是没有活性的——很可能掩藏在一段高度压缩的染色质里,甚至可能在一段挂在细胞核膜上的异染色质里。信号到达细胞核时,染色质重构复合物(chromatin remodeling complex)就会使基因内或其周围高度压缩的DNA展开,让这段序列更容易接触转录因子。在自我组织式的细胞核里,DNA结构的松散化会把这部分染色质从细胞核膜上高度压缩的异染色质中解放出来,在附近游荡,探索细胞核中新的区域。只需要一点运气,这段松散的DNA终将碰到“转录工厂”。
请注意,基因的这些活动——从细胞核边缘区域移到中央的行为,是在没有专门的运送机器的帮助下实现的,完全由基因自身的活动决定。所以,基因的位置是由自身决定的。这个模型有着耐人寻味的意义:尽管在细胞核中,基因的位置不是随机的,但它到达那里的过程可能是随机的。
对基因进行跟踪观测得到的许多结果都支持自我组织理论。基因会“跳出”染色体,在细胞核中游荡。少数基因甚至将这种转录机制发挥到了极致。白细胞受到细胞因子(cytokine,一种激素)的刺激时,编码免疫蛋白MHC II型分子的基因会从它们所在的染色体跳出来,游荡到很远的区域,有时甚至会横穿半个细胞核。
整条染色体的定位可能也遵从同样的机制。尽管大多数基因的活动幅度都很小,但把每个基因的活动叠加在一起,就会推动整条染色体,决定它们在细胞中的最终位置。如果染色体的位置确实是自我组织的,我们就可以预测,主要由非活跃基因组成的染色体会逐步朝着细胞核边缘的非活跃区域移动,而活跃基因占多数的染色体则会被拖到细胞核的中央。
为了验证这一预测,美国西雅图弗雷德·哈钦森癌症中心(Fred Hutchinson Cancer Center)的马克·格鲁丁(Mark Groudine)和同事收集了一些血液祖细胞(blood precursor cell,比造血干细胞次一级的干细胞),然后触发它们的成熟过程。在不同的阶段,研究人员都会采集细胞样本,监测数千个基因的活动。同时,他们还会观察这些基因所在染色体的位置。结果发现,在细胞成熟过程中活跃基因最多的染色体移动幅度最大。
这些研究开了一个好头,但研究过程还很艰难,因为在显微镜下,科学家很难同时监控那么多基因组区域的位置。一个可能具有革命性的技术——Hi-C,也许很快就能解决这个问题。这种技术由美国马萨诸塞大学医学院的乔布·德赛(Job Deccer)开发,可通过化学方法把细胞核里彼此接触的染色体区域连在一起,从而得到这个基因组在某一瞬间的三维结构快照。利用Hi-C,生物学家应该很快就能确定不同时间和不同条件下,不同组织的细胞核中染色体所处的位置。通过对比一系列活跃和非活跃基因的位置模式,科学家就能以前所未有的深度,了解细胞核中染色体和基因的位置如何影响细胞功能,它们位置的变更又如何引发疾病。
绘制世界首幅人类基因组框架图,科学家付出了10年的巨大努力。但基因组细胞生物学家并不满足于单单由基因组序列揭示的信息,他们还想弄清楚基因组在细胞的天然环境中如何运行。对于他们来说,现在取得的一切成果都还只是一个开头。他们想要达成的目标确实让人兴奋,但也让人生畏。考虑到研究对象的复杂性,生物学家达成目标所需的时间,很可能要比人类基因组计划花费的要长得多。
请 登录 发表评论