作为一名在业精神科医生,我每天都受困于医疗手段上的种种限制。虽然临床医生和研究人员做了大量努力,但由于我们对精神疾病的发病机理不够了解,很难找到有效的治疗法案,这类疾病一直是全球致死率或致残率最高的疾病之一。显然,要根治这一顽症,必须得有新的疗法。但正如科学哲学家卡尔·波普尔(Karl Popper)所说,要找到新的答案,先得有能力提出新问题。换句话说,我们需要新的技术。
不过,哺乳动物的大脑太过复杂,开发适用的技术并不容易。大脑是一个错综复杂的系统,其中有数百亿神经元以五花八门的方式交缠在一起,相互之间还以精确到毫秒的时间刻度不断交换着电信号,以及各种各样的生化信号分子。由于这样的复杂性,科学家很难深入了解大脑到底在干什么——特定大脑细胞的特定活动方式最终如何形成思维、记忆、感觉和情绪。我们也无从知晓,大脑功能失常如何导致抑郁症、精神分裂症等症状迥异的精神疾病。我们在探讨精神疾病时,通常会把病因归咎于大脑中化学物质失衡和神经递质水平的改变,但从未考虑电信号快速传导通路上的变化会对疾病造成哪些影响。因此,当前的治疗方案的出现实际上都有很大的偶然性,科学家并不清楚这些方案是如何发挥作用的。
难怪在1979年的《科学美国人》上,1962年诺贝尔生理学或医学奖得主弗朗西斯·克里克(Francis Crick)发表文章称,神经生物学需要攻克的最大难关是,在控制某一类大脑细胞的同时,不对其他细胞造成影响。电刺激无法实现这个目标,因为电极是一种极其笨拙的工具:它会不加区分地刺激插入点的所有细胞,也不能通过电信号精确阻止某种神经元放电。后来,克里克在一系列演讲中推测,光线也许可用于控制神经元,因为光波的发射时间、颜色和目标位置都可以精确控制。但在当时,没人知道如何让特定细胞对光作出反应。
同一时期,生物学的另一个领域,科学家在对一些微生物进行研究,这些工作似乎与研究哺乳动物的大脑风马牛不相及。但谁也没有料到,多年以后这两类研究非常紧密地联系在了一起。至少在40年前,生物学家就知道,一些微生物会合成一些蛋白质,能对可见光作出反应,从而直接调节电荷的跨(细胞)膜流动。这些蛋白由一组“视蛋白”基因合成的,有助于微生物从周围环境的光线中提取能量和信息。1971年,当时任职于美国加利福尼亚大学旧金山分校的沃尔瑟·施特克尼亚斯(Walther Stoeckenius)和迪特尔·厄斯特黑尔特(Dieter Oesterhelt)发现,其中一种名为细菌视紫红质(bacteriorhodopsin)的蛋白,本身就能起到离子泵的作用,可被绿光瞬间激活——换句话说,细菌视紫红质是一种令人惊叹的“一体式”分子机器。此后,科学又在1977年和2002年,分别找到了这个“蛋白质家族”的另外两个成员:嗜盐菌紫质(halorhodopsins)和视紫红质通道蛋白(channelrhodopsins),它们和1971年发现的细菌视紫红质一样,也是一种单基因合成的“一体式”分子机器。
事后来看,克里克提出的问题其实早就有了解决方案——这是一个足以使脑科学发生翻天之变的研究策略,它的出现甚至还在克里克提出问题之前。遗憾的是,直到30多年后,这些概念才融合在一起,以“光遗传学”(optogenetics)面目出现在世人眼前。
光遗传学将遗传学和光学结合起来,控制发生在活体组织(不仅仅是神经系统)中任何细胞内的特定事件。运用这门技术时,首先需要找到并向细胞插入能产生光敏感性的基因,其次得用一系列辅助技术,向大脑传输光信号、调控光线对目标基因或细胞的影响,并评估光控作用的效果。让神经科学家感到兴奋的是,光遗传学技术可以在指定时间点上调控指定细胞中的指定事件——这样的精确度不仅前所未有,而且对于研究人体的各种生理活动也极可能是至关重要的。
对于一个细胞中的任何一个事件,只有把它放在更大的背景下,与发生在细胞周围、组织其余地方、整个生命体甚至更大环境中的其他事件进行比较,才可能真正理解这一事件的重要性。有时,一个神经元发放电信号的时间即使仅有数微秒的变化,这个信号在整个神经系统中的作用也可能完全相反。现在,成千上万的科学家都在利用光遗传学技术,对线虫、果蝇、鱼类、鸟类,小鼠、大鼠和猴子展开研究,希望弄清特定神经元群的某种活动模式如何导致复杂的生理活动和外在行为。根据这些研究的结果,科学家已经对抑郁症、睡眠障碍、帕金森病、精神分裂症等人类疾病有了更深的认识。
 从细菌到神经元
从细菌到神经元
让神经元合成微生物视蛋白本是一个难以实现的目标,但大自然安排的一个巧合,给了科学家成功的机会。
在生物学界,用光干预生命系统早有先例。科学家长期利用光灭活作用(chromophore-activated light inactivation,简称CALI,荧光基团被光激活后产生活性氧簇,活性氧簇会使蛋白失活)来“摧毁”特定蛋白,让它无法发挥作用;激光也曾被用于杀灭秀丽隐杆线虫(Caenorhabditis elegans)体内的特定细胞。光还可以发挥相反的作用:美国贝尔实验室的理查德·L·福克(Richard L. Fork)和哥伦比亚大学的拉斐尔·尤斯特(Rafael Yuste)分别在1970年和2002年报告称,用激光破坏神经元的部分细胞膜可以激活神经元。过去十年中,美国纪念斯隆-凯特琳癌症中心盖罗·米森伯克(Gero Miesenböck,2007年去了英国牛津大学)的实验室,以及加利福尼亚大学伯克利分校埃胡德·伊萨科夫(Ehud Isacoff)、理查德·H·克莱默(Richard H. Kramer)和德克·特劳纳(Dirk Trauner,现任职于德国慕尼黑大学)的实验室,都已通过构建多组件系统,实现了用光调控目标细胞。他们在多组件系统中同时引入一种蛋白质和一种化学物质,前者能调控神经元的活动,而后者受到紫外光的照射之后会激活前者,使它发挥调控作用。
然而,破坏目标蛋白或细胞显然会给实验带来诸多限制,而依靠多组件系统的方案虽然巧妙、有效,但必然会面临很多实际困难,而且在哺乳动物中,这种方法也一直没有得到广泛应用。一场以单组件策略为目标的根本性转变势在必行。事实证明,以往光控方案中的任何方法或组件都无法实现单组件策略,能够担当大任的,只有微生物中那些不同寻常的“一体式”光敏蛋白:细菌视紫红质、嗜盐菌紫质和视紫红质通道蛋白。
2000年,细菌视紫红质和嗜盐菌紫质已为科学界熟知。这一年,日本上总DNA研究所(Kazusa DNA Research Institute)在网上公布了莱茵衣藻(Chlamydomonas reinhardtii,一种绿藻)数千个新的基因序列。当时任职于德国雷根斯堡大学的彼得·黑格曼(Peter Hegemann)在分析这些序列时发现,有两个基因的序列和编码细菌视紫红质的基因非常相似。黑格曼曾预测莱茵衣藻可能有一个光敏离子通道,因此当他从上总DNA研究所得到那两个基因的拷贝后,立即送到当时在德国法兰克福大学任首席科学家的格奥尔格·内格尔(Georg Nagel)那里,请他帮忙检验,看这两个基因是否确实在编码离子通道。2002年,黑格曼和内格尔公布了他们的发现:其中一个基因编码的蛋白质,本身就是细胞膜上一个能对蓝光作出反应的离子通道。受到蓝光的激发时,这个蛋白就会调节正离子的流动。随后,它被命名为视紫红质通道蛋白-1(channelrhodopsin-1,简称ChR1)。第二年,黑格曼、内格尔和法兰克福大学的恩斯特·班贝格(Ernst Bamberg)等同事一起,又研究了另一个基因编码的蛋白,并把它命名为视紫红质通道蛋白-2(简称ChR2)。几乎与此同时,美国得克萨斯大学医学院约翰·L·斯普迪赫(John L. Spudich)找到的证据也表明,这两个基因在莱茵衣藻的光敏反应中起着非常重要的作用。视紫红质通道蛋白是科学家发现的第三种光敏离子通道蛋白,但就像两个“前辈”细菌视紫红质和嗜盐菌紫质一样,它也没能立即转变成神经科学发展的推动力。
不少科学家向我透露,他们都曾想过,把细菌或衣藻的视蛋白基因转入神经元,然后用光来控制这些改造后的细胞,但后来都放弃了这个想法。动物细胞很难安全高效地合成微生物蛋白,即便合成出来,这些蛋白对光的反应也必定很慢很弱,难以发挥作用。而且,要使光敏蛋白发挥作用,还需要一种辅助因子——全反式视黄醛(一种维生素A类化合物)来吸收光子。因此,这项研究很可能花费大量时间和经费却得不到任何结果,风险极大。
然而,对于我在斯坦福大学建立的生物工程研究组来说,由于太想加深对临床精神病学的了解,我们决定即使冒着极有可能失败的风险,也要尝试一番。在精神病科工作期间,我亲眼目睹了药物和电休克等疗法在疗效上的羸弱,以及由此产生的副作用给患者带来的痛苦。正是这种经历促使我去冒险尝试,寻找新的治疗方法。2004年,作为斯坦福大学的一名首席科学家,我成立了一个研究小组来解决这个问题,小组成员包括我的研究生爱德华·S·博伊登(Edward S. Boyden)和张峰(Feng Zhang)。我通过转染(transfection)这种成熟技术,在实验室培养的哺乳动物神经元中插入了视紫红质通道蛋白-2——具体过程是,首先把编码该蛋白的基因和一个“开关序列”(即启动子,promoter)拼接到一个载体(比如良性病毒)上,再用这个载体去感染神经元,让它们把前述基因带入细胞中。启动子能确保,只有在指定类型的神经元(比如会分泌神经递质谷氨酸的神经元)中,视紫红质通道蛋白-2的基因才会表达。
尽管困难重重,但实验成功了——而且效果出奇地好。只需安全剂量的可见光脉冲,我们就能以毫秒级的精度,稳定控制神经元动作电位的发放模式。(神经元动作电位是一种电压脉冲,将信息从一个神经元传递给另一个神经元。)2005年8月,我们小组发表文章首次报道了,将单个微生物视蛋白基因转入哺乳动物神经元,就可以使神经元准确地对光作出反应。研究表明,所有视紫红质通道蛋白都能安全高效地对光作出反应,它们像开关一样,可以启动或终止神经元的电活动(我们后来发现,嗜盐菌紫质和发现于1971年的细菌视紫红质也有同样的效果)。这些蛋白之所以能做到这一点,部分原因在于大自然给我们送了一份意想不到的礼物:哺乳动物组织中恰好天然就有足量的全反式视黄醛(这种化学物质是光子激活视蛋白的关键性辅助因子),因此除了视蛋白基因,我们不必再向目标神经元中转入其他任何基因。
我们的首篇报道问世一年后,我和斯坦福大学的同事马克·施尼策尔(Mark Schnitzer)在一篇综述文章中,把这种技术命名为“光遗传学”。那时,世界各地的实验室都已开始使用光遗传学技术,所用基因也是我们小组专门合成、能在哺乳动物细胞中发挥最佳效果的“版本”。迄今为止,我们已向大概700个实验室发送过这些基因。
改造与“杂交”
科学家在不断改造已知视蛋白,甚至把不同视蛋白进行“杂交”,以增强光遗传学技术的功能。
由于与生态学和工程学的融合,光遗传学工具的数量和用途都在极速增加。一方面,科学家不断在自然界中寻找新的视蛋白,把它们加入“工具箱”中,同时也在运用分子工程技术改造已知视蛋白,让它们能在更多的实验中、更多的生物体内,发挥越来越强大的作用。
2008年,张峰带领着基因组搜索小组,在另一种藻类植物——团藻(Volvox carteri)中发现了第三种视紫红质通道蛋白(VChR1)。我们和黑格曼的研究表明,这种蛋白会对黄光而不是此前的蓝光作出反应。如果同时使用几种视紫红质通道蛋白,我们就能操纵一群不同种类的神经元:用黄光控制部分神经元,其余神经元则由用蓝光指挥。我们现已发现,最有潜力的视紫红质通道蛋白实际上是VChR1和ChR1的杂交产物(与ChR2完全无关)。在由奥弗·伊扎尔(Ofer Yizhar)、利夫·芬诺(Lief Fenno)、莉萨·居纳伊登(Lisa Gunaydin)、黑格曼及其学生构建的其他改良版视蛋白中,还包括“超快”和“超慢”视紫红质通道蛋白变体,通过它们可以精确控制动作电位的发放和持续时间:前者能使神经元在一秒内放电200多次,而后者仅需受到单个光脉冲的刺激,就能使神经元进入或结束持续性的兴奋状态。我们最新构建的视蛋白能对深红色光线作出反应。这种颜色的光线靠近红外光区,聚焦性更好,更容易穿透组织,细胞对它的耐受力也极强。
在分子工程学的推动下,光遗传学技术现在不仅能控制细胞的电行为,还可以影响它们的生化过程。在所有获准使用的药物中,大部分的作用目标都属于同一个“膜蛋白家族”——G蛋白偶联受体(G-protein-coupled receptor)。这种蛋白会“感知”细胞外的化学信号(如肾上腺素,epinephrine),并对此作出反应,改变细胞内生化信号分子(如钙离子)的浓度,从而影响细胞活动。我们实验室的拉格·D·艾兰(Raag D. Airan)等人把视紫红质的感光部分添加到G蛋白偶联受体上,构建出了一组名为optoXR的受体,能对绿光作出快速反应。当研究人员利用病毒,把这类受体的基因插入啮齿类实验动物的大脑后,即使动物还在笼子里自由活动,我也能控制它们体内的生化事件。这项研究预示着,我们完全可能通过光线,快速而准确地控制特定细胞中的生化途径——不管细胞是在培养皿里,还是在自由活动的动物体内。对细胞生化过程的精确控制,也将为光遗传学打造更宽广的舞台:从本质上说,这种技术可用于生物体的任何细胞和组织。
在多种微生物的基因组中,科学家相继发现了很多天然视蛋白的基因。可惜的是,哺乳动物细胞并不能顺利表达这些基因。不过,为了更好地把视蛋白基因转入细胞,提高它们的表达效率,我们小组的维维安娜·格勒迪纳鲁(Viviana Gradinaru)开发了一系列广泛适用的策略。比如在视蛋白基因上“捆绑”一些DNA片段,充当“邮编”,确保视蛋白基因会被运送到哺乳动物细胞内的正确位置上,以合成出具有特定功能的蛋白。利用我们在2006年和2007研制的光纤工具,研究人员现在能把光线传输到自由活动的哺乳动物大脑内的任何位置(不论是在表面还是大脑深处),从而实现光遗传学控制。为了实时记录光刺激诱发的动态电信号,我们把光纤工具和电极“杂交”,制作出了一些毫秒级的监测设备(我们称之为“光极”,optrode)。
由于相互不会产生干扰,光刺激和电极记录完全可以做到“合作无间”。以控制机体运动的神经回路为例,我们可以直接观测这条回路的电活动变化,同时又可以用光刺激来源于微生物的视蛋白,对回路进行控制。我们发出的光信号和记录到的电信号越多越复杂,越便于我们对神经回路进行逆向工程研究(reverse engineering):根据这条回路把光信号转换成电信号的机制,我们可以推断它如何计算和生成神经信号。对健康神经回路进行逆向工程研究将打开一扇窗户,让我们得以看清在精神和神经疾病中,神经回路的哪些特性和活动会出现异常。反过来,这些信息也有助于我们找出让这些回路恢复常态的办法。
照亮疾病
光遗传学技术已经加深了科学家对抑郁症、精神分裂症等数种疾病的理解。
作为一种研究工具,光遗传学的重要性与日俱增,尤其是在它与其他技术结合之后。近年来,在功能性核磁共振成像技术(functional magnetic resonance imaging,fMRI)的推动下,神经科学取得了长足的进步。这种大脑扫描技术常顶着“无所不能”的光环:能让人们看到大脑对多种刺激作出反应时的神经活动,甚至连活动细节都能显示出来。但严格来说,fMRI图像显示的并不是神经活动,而是大脑不同区域上血氧水平的变化。
因此,一些科学家对于增强局部的兴奋性神经活动,能否触发像血氧水平变化这样的复杂信号一直持怀疑态度。不过在2010年5月,我们实验室结合光遗传学和fMRI技术证实,局部的兴奋性神经元放电足以诱导出能被fMRI检测到的复杂信号。而且,这两种技术的结合,能准确完整地显示具有特定功能的神经回路,这是以前靠电极和药物所无法实现的。从这一点来说,光遗传学有助于验证和完善神经科学与精神病学领域的大量文献资料。
实际上,一些人类疾病研究已经感受到了来自光遗传学的直接影响。在动物实验中,我们用光遗传学技术控制过一种名为下丘泌素细胞(hypocretin cell)的神经元,它所在的区域位于大脑深处,该区域被认为与嗜睡症有关(narcolepsy)。我们在研究中发现,这类神经元的特定电活动具有唤醒效应。如果在临床上,我们能找到一种方法触发这种电活动,也许就能开发出一种嗜睡症疗法。不过最重要的是,这项研究让我们认识到,特定神经元的特定活动能导致复杂行为。
光遗传学还有助于我们弄清楚,多巴胺能神经元(dopaminemaking neuron,即分泌神经递质多巴胺的神经元)如何产生奖赏感和愉悦感。在自由活动的小鼠中,我们小组曾利用光遗传学技术,诱导指定多巴胺能神经元在不同时刻放电。我们发现,某些刺激模式似乎能使小鼠产生受到奖赏的感觉。只要以这类方式刺激它们的多巴胺能神经元,即使在没有任何奖赏或类似暗示的情况下,小鼠仍然愿意花更多的时间呆在受到过刺激的地方。这些信息有助于我们研究,在正常的奖赏过程中,以及抑郁症、药物滥用使愉悦系统发生紊乱时,神经元会怎样活动。
光遗传学还加深了我们对帕金森病的了解。这类疾病的发生,与患者大脑内运动控制神经回路上的信息处理过程发生紊乱有关。从上世纪90年代开始,一种名为大脑深度刺激(deep-brain stimulation)的疗法的问世,在一定程度上缓解了某些患者的病情。这种方法需要在人脑中植入类似于起搏器的装置,它会严格按照预先设定的时间,不断对大脑深处的特定区域(如下丘脑)进行电刺激。
但是,这种技术存在缺陷,治愈帕金森病(实际上还有其他很多疾病)的希望并不大,因为电极会不加区分地刺激它周围的所有细胞,而且什么样的刺激最合适,医学界也不完全清楚。不过,我们最近利用光遗传学研究了帕金森病的动物模型,对病变神经回路的特性和一些干预手段的作用机制有了全新的认识。
比如我们已经发现,只有当大脑深度刺激的作用目标并非细胞本身,而是细胞间的连接点——也就是说,要影响大脑区域间的信号传递时,才有可能取得最佳疗效。我们和加利福尼亚大学旧金山分校的同事阿纳托尔·克赖泽尔(Anatol Kreitzer)合作,根据神经元功能在大脑的运动回路中找到两条信号传导途径:一条可以减缓动作,另一条则可加快动作,激活它们也许就能消除帕金森病的症状。
我们还学会了如何通过刺激新皮层小白蛋白神经元(neocortical parvalbumin neuron)来调节大脑内频率为每秒40个周期的伽马振荡(也成γ波,一种脑电波)。在此之前,科学家就已知道精神分裂症患者拥有异常的小白蛋白神经元,而且这类患者与自闭症患者一样,伽马振荡也不正常,但对于这两种异常到底有怎样的因果关系,科学家却是一头雾水。通过光遗传学研究,我们发现小白蛋白神经元可以增强伽马振荡,而伽马振荡又会增强大脑皮层神经回路中的信号传递。
我发现我的精神分裂症患者在信息处理上有明显障碍,喜欢小题大做,疑神疑鬼,甚至出现幻觉(参见《环球科学》2010年第10期《大脑中的自画像》)。他们的“内部通报机制”也出现故障,无法获知哪些想法是自己产生的(幻听这种令人毛骨悚然的现象可能也是由信息处理障碍导致的)。自闭症患者恰好相反,他们不会把各种信息联系起来,信息处理过程受到极大的限制:过分关注细节,往往只纠结于事物的某个局部(参见《环球科学》2006年第12期《自闭症:碎镜之困》)。信息处理障碍可能使患者难以和他人沟通,严重削弱了社交能力。因此,对伽马振荡进行更深入的研究,可能有助于阐明这些复杂疾病的深层机制。
作为一名医生,我觉得这是一项令人兴奋的研究,因为我们正在用工程学原理和定量技术,来对付破坏性十足、致病机制让人难以捉摸、难以治疗的精神疾病。因此,光遗传学技术会把精神病学带上一条新的道路,科学家将用网络-工程学手段来解决问题:大脑的复杂功能(及其产生的行为)将被看作是神经系统的各种特性,而这些特性,归根结底是各种神经元和神经回路的电化学性质发生动态变化的一种表现。这种研究思路将从根本上改变我们对电兴奋性组织如何影响健康和疾病的看法。从今天取得的这些成果,回溯至当初人们惊讶于一种奇怪的细菌蛋白(细菌视紫红质)竟会以某种方式对光作出反应,我们可以看到这中间确实是一段谁也没有料到的漫漫长路。
创新来自“意外”
只有深入那些我们不太熟悉、几乎从未涉足的自然领域,才能催生一些真正有创新性的想法。
在神经科学学会的会议和其他一些大型会议上,我偶尔会听到有同行建议,对于一些重大而紧要的课题,不应该让科学家分散在多个方向上进行探索,而应该投入几万名科学家,集中力量每次解决一个问题(比如治疗阿兹海默病),这样做的效率可能会更高一些。但是,研究方向和目标越单一,反而更可能拖慢整个研究进程。更重要的是,如果这样做了,我们的科学之旅将完全没有机会深入到那些我们不太熟悉、几乎从未涉足的自然领域,而只有这些领域,才能催生一些真正有创新性的想法。
光遗传学的例子告诉我们,不管多古老、多脆弱、多罕见的生命体,甚至是死水上的藻类和不毛之地撒哈拉盐湖里的细菌,对于我们认识自身和现代世界都至关重要。这项技术背后的故事也强调了保护罕见生态位(environmental niche,一个物种所处的环境以及其本身生活习性的总称)的意义所在,也让我们认识到支持真正的基础研究有多么重要。我们应该牢记的是,谁也不知道漫漫科学路会把我们带向何方,也不会知道未来我们需要什么样的工具来照亮前行之路。
图片
P49
本文作者:
卡尔·戴瑟罗斯是美国斯坦福大学的生物工程学副教授、精神病学及行为科学副教授。由于在微生物视蛋白和光遗传学方面的开创性研究, 他获得了2010年的中曾根奖(International Nakasone Award)。
本文译者:
冯泽君,
光遗传学
长期以来,神经科学家一直苦于无法以足够的精度来研究大脑的运作机制。出人意料的是,转机竟出现在一些微生物的遗传学基础研究中——这些微生物必须要依赖一种名为视蛋白的光敏蛋白才能存活。
现在,通过向大脑细胞转入视蛋白基因,科学家能利用光束控制这些细胞,使它们发放电脉冲。这种技术叫做“光遗传学”,让科学家得以在自由活动的动物上,以极高的精度针对大脑中的指定细胞进行实验,这是电极技术和其他传统方案无法做到的。
尽管这种技术才刚刚起步,但在某些精神疾病生理机制的研究中,它已帮助科学家取得了一些可能具有重要价值的成果。
P50
利用光遗传学技术,科学家可以让指定细胞在指定时间发生指定电活动。
P51
1 微生物研究
2 感光蛋白的“卑微出身”
3 一些藻类和其他微生物必须依赖视蛋白才能生存,这些蛋白能对可见光作出反应,它们实际上是细胞膜上的一种离子通道。受到光照时,这些蛋白通道会允许带电离子跨膜流动,让细胞从环境中获取能量。不同视蛋白的光敏感性和作用方式也有所不同。视蛋白基因是光遗传学技术的基础,现在科学家正是利用这种技术来控制特定神经元的活动模式。
4 微生物
5 莱茵衣藻是一种单细胞、可移动的藻类生物,它们有一对鞭毛,能在淡水中游动。
6 团藻和莱茵衣藻的亲缘关系很近,这种藻类通常由数百个细胞聚集在一起,形成一个球形集落。
7 盐碱古菌(Natronomonas pharaonis)是一种原始细菌(archaebacterium),只能在盐分极高的水域中存活。
8 生存环境
9 世界各地的土壤和淡水水域
10 池塘、湖泊、水塘和水坑
11 埃及和肯尼亚的高盐碱湖
12 离子通道
13 波长:470纳米(nm)
14钠离子
15钠离子
16氯离子
17 ChR2通道在蓝光刺激下开放,允许钠离子通过。
18 VChR1通道对特定波长的绿光或黄光作出反应。
19 NpHR通道在黄光刺激下开启,允许氯离子通过。
20 对不同光线的反应强度
21 波长(nm)
22 制图:布莱恩·克里斯蒂(Bryan Christie)
P52~53
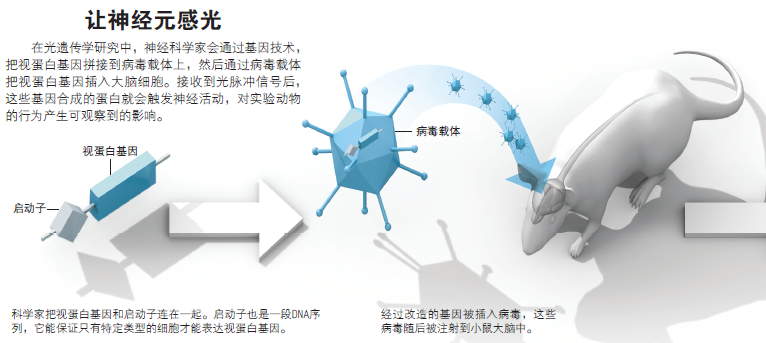
1操作过程
2 让神经元感光
3 在光遗传学研究中,神经科学家会通过基因技术,把视蛋白基因拼接到病毒载体上,然后通过病毒载体把视蛋白基因插入大脑细胞。接收到光脉冲信号后,这些基因合成的蛋白就会触发神经活动,对实验动物的行为产生可观察到的影响。
4 视蛋白基因
5 启动子
6 病毒载体
7 科学家把视蛋白基因和启动子连在一起。启动子也是一段DNA序列,它能保证只有特定类型的细胞才能表达视蛋白基因。
8 经过修饰的基因被插入病毒,这些病毒随后被注射到小鼠大脑中。
9 神经元
10光纤
11 会对光作出反应的神经元
12 病毒会感染很多神经元,但是由于启动子的存在,只有一种神经元才会合成视蛋白。
13 插入动物脑内的光纤可以发送光脉冲,控制特定神经元的活动。
P54
1 分子库
2 不断增多的光敏蛋白基因
3 通过改造已知视蛋白基因以及在自然界中寻找新的光敏蛋白,科学家在不断地完善和强化光遗传学技术。拥有理想特性的视蛋白(单独或几种蛋白联合使用)能让科学家以前所未有的方式进行研究,帮助他们破解一个个生物学谜题。下表列举了几种具有重要价值的视蛋白及其功能。
名称 | 微生物来源 | 感光波长 | 用途 |
超快视紫红质通道蛋白-2(ChR2)突变体 | 莱茵衣藻 | 470纳米(能达到最佳激发效果的波长) | 以毫秒级精确度快速开启或终止神经元放电,最高频率可达200赫兹 |
双功能视蛋白(超慢ChR2突变体) | 莱茵衣藻 | 开启波长:470;关闭波长:546纳米(仅能使部分通道关闭) | 使神经元进入或终止兴奋状态。由于感光能力强,尤其适合用于需要穿透大量组织的实验(如哺乳动物脑组织) |
视紫红质通道蛋白VChR1 | 团藻 | 535纳米和589纳米 | 诱发神经元放电。VChR1对黄光有反应,而ChR2对蓝光有反应,同时使用可以分别操控同一区域内不同类型的神经元 |
OptoXRs | 由视紫红质和G蛋白偶联受体合成 | 500纳米 | 快速控制特定类型靶细胞的生化信号通路(而非离子通道)。可用于自由活动的动物 |
请 登录 发表评论