从微小的细菌到海洋巨无霸蓝鲸,从依赖阳光的植物到地下数百米以矿物质为食的内岩生微生物(endoliths),地球上生物物种之多,令人惊叹。但我们知道的所有生命形式在本质上是相同的:都以核酸(即DNA和RNA)及蛋白质为基础,复制或繁殖时通常遵循“中心法则”(central dogma,DNA转录为mRNA,mRNA充当合成蛋白质的模板,最后生成的蛋白质又作为组织中的重要结构分子和酶,在细胞中发挥重要的功能)。
合成与已知生命完全不同的人造生命,一直是科学家们的梦想,因为这样就可以知道,合成新的生命形式到底能否实现,以及哪些组件才是生命体必不可少的(这是人类探索生命本质及生命起源的一部分)。要实现这一目标,科学家就得用一种前所未有的方式,将一些能自我组织、代谢(能源的利用)、生长、复制和进化的分子组合起来。
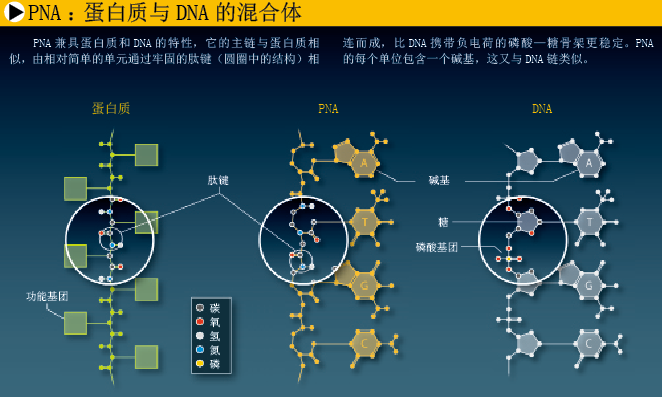
肽核酸(peptide nucleic acid,PNA)是科学家颇为关注的一种分子,它能像DNA和RNA一样储存信息, “骨架”却类似于蛋白质,比真正核酸的“糖—磷酸骨架”简单、结实。15年前,我们研制PNA时,注重的是它的实际用途,并没有想过利用它来合成前所未有的生命形式。当时,我们想要设计一种药物,能作用于特定基因,抑制或增强它们的活性。从概念上看,这种药物类似于反义药物(antisense compound)——能与特定RNA结合的短链DNA或RNA分子,可干扰疾病相关蛋白的合成。
但PNA的独特性质,赋予了它反义RNA和DNA都不具备的优势:既能与DNA结合又能与RNA结合,且结合能力更强,在充满酶的细胞环境中更稳定。很多研究显示,在分子生物学实验及细胞培养过程中,PNA很适合用于调节基因的表达。科学家已开始在动物实验中使用PNA,希望将它转变成一种可从血液进入人体细胞的药物。
这种奇妙的分子不仅引起医药界的极大兴趣,更促使人们进一步思索地球生命是如何起源的。一些科学家提出,在蛋白质、DNA和RNA出现之前,PNA或一种类似分子可能是早期生命的基础。因此,忙着合成人造生命的科学家们可能不是在创造新的生命形式,而是在重建地球生命最原始的祖先。
识别双链DNA
PNA的故事开始于上世纪90年代初。为了制造比反义RNA作用范围更广的药物,我和同事迈克尔·埃格霍尔姆(Michael Egholm)、罗尔夫·H·博格(Rolf H. Berg)、奥勒·布哈德(Ole Buchardt)想要研制一种小分子,可以识别具有特定碱基序列的双链DNA。这不是一个简单任务,给我们制造麻烦的正是众所周知的DNA双螺旋结构。
胸腺嘧啶(T)、腺嘌呤(A)、胞嘧啶(C)和鸟嘌呤(G)这4种碱基是DNA分子中的信息存储单元[在RNA分子中,胸腺嘧啶则是被分子结构类似的尿嘧啶(U)取代] ,它们通过氢键相连,形成DNA双螺旋中的阶梯。碱基配对遵循“沃森—克里克碱基配对原则”,即C与G配对,A与T配对(两条单链DNA上的碱基恰好可以配对,叫做碱基互补)。如果一种化合物能与具有特定碱基序列的双螺旋DNA结合,从理论上说,它就能与任何具有这段序列的基因发生反应(不管这段序列位于基因的哪条链上)。
如果化合物只是与单链DNA或RNA结合,分子识别任务就相对简单,因为两条序列互补的核酸链通过标准的碱基配对就能相互结合。我们只要知道某个基因的序列(可以从基因库中查询),剩下的工作就很容易完成:合成与基因序列互补的分子。
然而,对于双链DNA,识别任务就没有那么容易了,因为两条链上的碱基已经完成配对,无法再与其他分子通过氢键结合了。不过,细胞中存在很多基因调控蛋白,它们可以识别双链DNA的序列,从而调控基因表达。由此可见,识别双链DNA序列并非无法完成的任务,如果我们能找到具有这种功能的分子,它就可能成为调控基因表达的药物。
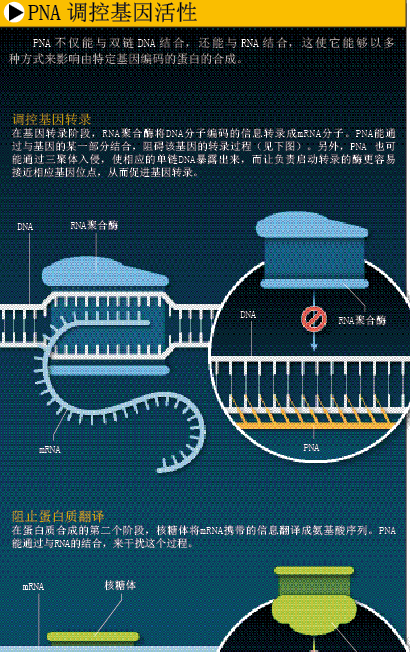
基因表达分为两个阶段。首先是转录:一种特殊的酶以双链DNA中一条链为模板,合成相应的单链信使RNA(mRNA)。完成转录后,mRNA将被翻译成蛋白质——完成这一任务的是核糖体(ribosome)。核糖体由RNA和蛋白质构成,它能根据mRNA中的遗传信息,把一堆原材料(氨基酸)组装成蛋白质。反义药物正是通过与mRNA结合来阻碍翻译过程。这些药物通常是一些经过化学修饰的短小RNA 或DNA分子,它们的序列经过专门设计,能识别特定mRNA。反义药物与mRNA的结合会激活某些酶,使它们分解mRNA,或者直接影响mRNA的功能。
在转录阶段,细胞会利用转录因子(一类蛋白质分子)来识别双链DNA中的特定序列,以便调控基因表达。当生物体不需要某类蛋白质时,转录因子会阻断RNA聚合酶(合成mRNA的关键酶),阻止DNA转录成mRNA,从而抑制基因的表达。但在适当的时候,它们又会协助RNA聚合酶与相应的DNA序列结合,启动转录,激活基因表达。
虽然通过转录因子,我们了解到某些蛋白质能从DNA双螺旋外部识别基因序列,但在20世纪90年代,科学家不可能仅依照一段序列,就设计出能识别这段序列的蛋白分子。基因调控蛋白能识别特定DNA序列,不仅因为拥有合适的整体构型,而且分子表面的化学组成也利于它们与DNA大沟中的碱基结合(在 DNA双螺旋表面,存在一大一小两条“沟壑”,基因调控蛋白一般与大沟中的碱基结合)。但是,蛋白质的表面结构取决于氨基酸链的折叠方式,而科学家很难精确模拟这个折叠过程。
后来,一种具有“锌指结构”的蛋白引起了科学家的注意:30个氨基酸包裹着一个锌原子,形成了一个特殊的手指状结构。这种结构中的部分氨基酸能嵌入DNA 的大沟,与其中的碱基结合。研究者已研制出一些人造锌指蛋白,但从目前的状况来看,即便设计一段只与较短DNA序列结合的氨基酸链,也很困难。
1957年的一项发现也为我们提供了思路。当时,任职于美国国家卫生研究院的加里·费尔森菲尔德(Gary Felsenfeld)、亚历山大·里奇(Alexander Rich)和戴维·戴维斯(David Davies)共同研制出一种具有三螺旋结构的分子。在这种分子中,一条核苷酸链能以三碱基配对的方式,与双链核苷酸分子的大沟结合,形成三螺旋结构 (见右图)。因此,在三螺旋结构中的每一个位置,都具有由三个碱基结合成三联体。T与T—A结合(即T—A=T,其中“=”表示三碱基配对),或C与G—C结合(C—G=C)。第三条链必须是同型嘧啶链(homopyrimidine,即整条链的碱基完全由T或C组成)才能形成三螺旋结构,这是因为三碱基配对要求双螺旋链中含有A或G。
1987年,法国巴黎国家自然历史博物馆的克劳德·伊莲(Claude Hélène)和美国加州理工学院的彼得·德尔文(Peter Dervan)分别研究证实,三螺旋结构的确可用于设计能识别、并按三碱基互补原则与双链DNA序列结合的寡聚核苷酸(长度约为15个核苷酸的DNA链)。
入侵DNA
受到三螺旋结构的启发,我们开始合成能与双螺旋DNA结合,且在结构和功能上不受限制的分子。具体来讲,我们想要合成的分子,不仅能与G、A、T、C四种碱基结合,还是中性的。通常情况下,核苷酸的分子骨架含有磷酸基团,在溶液中会带负电,如果在三螺旋的形成过程中,三条链的分子骨架都带负电,就会削弱第三条链与其他两条的结合力。
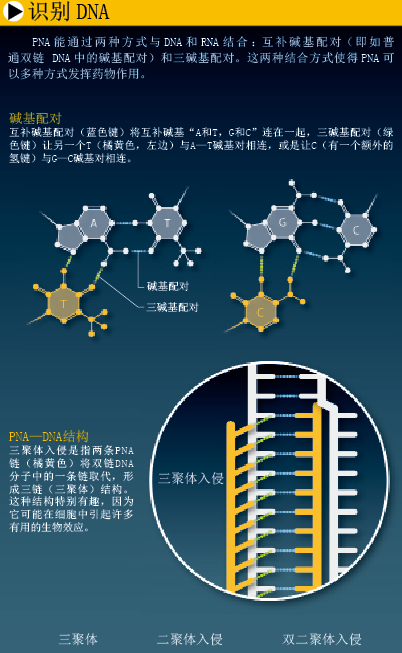
由于酰胺化合物之间的化学键与氨基酸之间的肽键相同,我们决定以酰胺化合物为基础来设计分子骨架。当时,基于肽键的合成技术已比较成熟,合成高稳定性中性分子并不难。我们设计的PNA分子具有一条类似多肽(即氨基酸链)的分子骨架,基本组成单元比DNA和RNA的“糖—磷酸骨架”简单得多。每一个单元都连有一个标准碱基 (T、A、C和G)或经过修饰、有特殊用途的碱基。在PNA分子中,各碱基之间的间隔距离与DNA和RNA类似,这就使PNA链能与DNA、RNA及其他PNA链形成非常稳定的二聚体结构,链与链之间均通过沃森—克里克碱基配对相连。
出乎意料的是,当我们试图用同嘧啶型PNA与双链DNA结合时,PNA并没有结合到DNA 的大沟处,相反,一条PNA链“侵入”了DNA双螺旋结构,取代了其中一条DNA链的位置。紧接着,第二条PNA链又以三碱基配对的方式结合上来,形成“PNA—DNA=PNA”三聚体。同时,被取代的那条DNA链则在三聚体旁边,形成一种叫做P—环的单链结构(与磷酸盐结合的结构域)。
由于三聚体非常稳定性,P—环又能影响重要的生命过程(基因转录、DNA复制、基因修复),这种侵入式结合能引起多种生物效应,例如P—环结构能启动DNA转录。单链环还可以用来诊断遗传疾病:检验样本中的DNA时,必须先对DNA进行多次复制,而环状结构可以作为一个特殊的酶结合位点。
如果DNA序列和PNA碱基的修饰方式不同,还会出现其他结合方式。其中,二聚体侵入最为有趣。我们制备了两条“假互补”PNA链——它们的碱基是互补的,但经过修饰,不能形成PNA—PNA二聚体,但它们与DNA结合的能力并未被削弱,因此,这些PNA可以侵入双链DNA,形成两个PNA—DNA二聚体。相对于三聚体,二聚体侵入的结合方式并不要求目标DNA具有很长一段嘌呤序列(即AG序列),只要其中含有50%以上的A—T碱基对就可以了。而且随着G、C碱基修饰技术的进步,这个限制还有望进一步放宽。
通过这些结合方式,PNA与RNA或DNA结合的效率,甚至高于天然DNA。因此,具有荧光基团的PNA链就成为一种可用于检测特定基因的标记物。基于PNA的荧光原位杂交技术(fluorescence in situ hybridization,即让带有荧光标记的PNA与细胞或组织中的核酸结合),就能显示特定基因序列在染色体中的位置。
药用前景
很多细胞培养和体外研究都证实,PNA链能以多种方式与DNA结合,抑制或激活特定基因的转录、复制或修复。其他研究还证明,在细胞研究和一些小鼠研究中,PNA链具有反义RNA的功能,它能在蛋白质翻译阶段,干扰目标基因的表达(主要是阻断与RNA相关的生命过程)。相对而言,执行RNA干扰任务的DNA或RNA链,还需要一些酶的协助,才能降解目标RNA,干扰相应基因的表达。 由于PNA是外来物质,不太可能得到酶类的协助——细胞中的酶无法识别外来物质,但也正因为如此, PNA在生物体内表现出异常的稳定性,有更多的时间与互补RNA结合,干扰它们的功能。
某些情况下,干扰RNA相关过程能恢复正常蛋白的表达。2007年,英国牛津大学的马修·伍德(Matthew Wood)及其同事就证实了PNA具有这样的功能。他们将PNA注射到患有营养性肌肉萎缩的小鼠体内后,注射部位附近肌肉中的抗肌萎缩蛋白含量开始升高(抗肌萎缩蛋白的缺乏就是导致肌肉萎缩的原因) 。PNA可以阻止抗肌萎缩蛋白基因中的突变片段转录成RNA,从而消除不良突变,同时又保证足够的蛋白质维持正常功能。
不过,PNA和普通核酸面临一个共同的难题:生物利用率很低。不管是PNA还是RNA或DNA,大部分是亲水大分子,而细胞膜又是由疏水性磷脂膜所构成,所以这些大分子很难进入细胞内部发挥作用。尽管PNA十分稳定,却不会长时间地滞留于动物体内。由于具有亲水性,它们会在一段时间后就会随尿液排出。在小鼠体内,PNA总量的一半会在半小时内被排出。因此,PNA药物何时进入临床应用,取决于化学修饰或制药技术的进步,以提高PNA的生物利用率。总的来说,基因药物研究的主要方向就是解决药物在细胞中的传送问题,科学家们认为,这是取得重大医学突破的最后一道难关。
人造生命

PNA综合了核酸与蛋白质两种分子的特点,既能像DNA一样储存信息,又能像酶蛋白一样作为人造细胞中的催化机器。PNA这种双重特性,激起了很多科学家的兴趣,他们想借此创造人造生命。
从很多方面来讲,科学家对RNA的研究远多于PNA。不少天然或合成的RNA分子都具有催化活性(核酶),相比之下,具有催化活性的PNA分子却还未发现。不过,就像蛋白质和RNA一样,PNA也会折叠成一定的形状(即高级结构),而这正是催化功能的基础。因此,我相信研制出具有催化活性的PNA 分子是迟早的事。
通常,科学家都是以组装一系列分子的方式,来合成人造生命。在这类研究中,最先进的手段就是寻找具有催化能力、能自我合成的RNA分子。从理论上讲,具有催化能力的RNA分子可用PNA或类似分子替代。目前,科学家已经发现了以短小核苷酸链为核心的自我催化复制体系,以及能自我复制的多肽。因此,研制一种类似的能自我复制的PNA体系并非不可能。
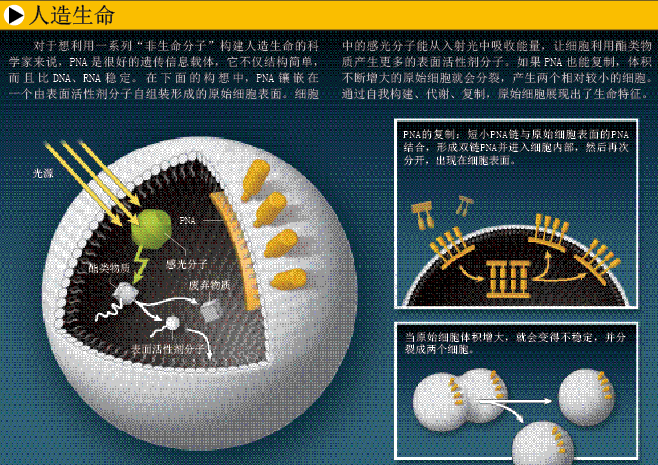
在生命体中,尽管基因复制体系占据核心地位,但它只是一个组成部分。生命体的本质是一个化学反应网络,各个化学反应处于一个相对稳定但又非平衡的状态,允许物质的输入和输出(参见《环球科学》2007年第7期《生命的源头》),因此对于人造生命研究的主要挑战,在于如何将自我复制体系整合到其他催化、代谢体系中,并把所有体系都“搬入”一个物理隔间(如脂质囊泡),形成“原始细胞”(protocell)。
美国洛斯阿拉莫斯国家实验室的斯汀·拉斯姆森(Steen Rasmussen)和阿贡国家实验室的陈辽海(Liaohai Chen)提出了一种基于PNA的简单原始细胞设计方案(见下图):原始细胞是由表面活性剂分子(具有亲水头的脂质分子)自组装形成的球体,内部含有一些感光分子;PNA的多肽骨架上连有各种碱基,并经过进一步化学修饰,转变成了亲脂性分子,镶嵌在原始细胞表面。当受到光照时,感光分子就会吸收能量,用于制造新的表面活性剂分子;外源单链PNA也会与原始细胞表面的PNA结合,形成双链PNA,并进入细胞内部,重新分开,出现在原始细胞表面。随着内容物越来越多,体积增大,原始细胞变得不稳定,开始自然分裂。不过,这一方案仍处于构思阶段,而且科学家们还得解决一个基本问题:双链PNA很稳定,如何才能让它自然分开,形成两条单链?要创造出与现有生命完全不同的人造生命,科学家们还有很长的路要走。
生命起源
合成生命体的重要目的,是为了更好了解原始生命是怎样形成的。如果从微观角度来看现代生命形式,RNA显然比DNA和蛋白质更原始、更重要,它既能承载生物体的遗传信息,也能执行催化功能。由于RNA分子的这些特性,许多科学家都认为,在DNA/RNA/蛋白质世界出现之前,还存在一个PNA世界。
但科学家不清楚的是,在原始环境下,RNA分子(特别是RNA分子骨架中的核糖)到底是如何产生的。即使RNA分子产生了,但由于它的化学性质极不稳定,也很难在没有任何保护的情况下长时间存在,更无法在最初的生命进化中发挥重要作用。因此,PNA作为“RNA前世界”的生命分子就显得很合理了,因为PNA非常稳定,化学组成也很简单,还能承载遗传信息。
50年前,美国科学家斯坦利·L·米勒(Stanley L. Miller)在模拟原始地球环境的情况下,进行了经典的核酸合成实验,并因该实验而名声大噪。2000年,他又在类似的实验中合成出PNA分子。研究人员还发现,PNA可通过“化学复制”,将它携带的序列信息转移给另一个PNA或RNA分子——这个过程对于“PNA世界”以及其后的过渡性“PNA/RNA世界”是至关重要的。当然,我们也必须承认,仅根据少量观察结果,就断定“RNA前世界”依赖于PNA或类似分子似乎有些勉强。而且,我们的假说想要得到证实,先得找到具有催化活性的PNA。
尽管PNA已发现了15年,但对于这种分子,仍有很多问题需要解决:PNA分子能否具有催化活性?什么样的体系才能够将治疗性PNA导入细胞?在实验室条件下,我们能否制造出以PNA为基础的生命形式?我相信在未来15年内,很多问题都能得到圆满的解答。
请 登录 发表评论