免疫系统竟是癌症帮凶
撰文 加里·斯蒂克斯(Gary Stix)
翻译 杜珍辉
审校 李锦军 胡晨
5亿多年前,为了抵抗外界侵袭,我们的祖先进化出了一套防御武器:一些特殊的酶和蛋白质。如果微生物和毒素突破了某种寒武纪动物的外部防线(如外壳),这些早期的免疫系统成员就会相互协作,对非法入侵者展开猛烈攻击——破坏微生物的细胞壁、将化学毒素赶出动物身体或者直接吞噬并消化它们。入侵者被完全消灭后,免疫系统开始修复受损细胞。如果某些细胞伤势过重,免疫系统就会销毁它们。
这种炎症免疫反应对动物健康的重要性不言而喻,因此,即使经历了亿万年的进化,免疫系统的很多功能和特性仍被保留下来。研究发现,就算是果蝇(fruit fly,蝇类的一种,常用的模式生物)这样的低等生物,拥有的很多免疫基因都与人类相同,脊椎动物与非脊椎动物也是如此——在5亿年前,人类和这些动物的祖先是同一种生物。
多年来,先天性免疫系统几乎从未引起免疫学家的重视。他们认为,所谓的先天性免疫系统只是一群生物分子,它们的作用就是歼灭任何穿过动物皮肤或外壳的外来物质。免疫学家把精力集中在更高级的后天适应性免疫系统。这种系统可以针对某一种外来物质,召集相应抗体和其他“武器”来识别它们,并有目的地进行攻击,先天性免疫系统则没有这种针对性的防护举动。
但在过去15年中,先天性免疫系统逐渐进入免疫学家的视野。炎症反应是先天性免疫的标志性特征,它几乎与所有慢性疾病的形成有关:除了类风湿性关节炎和克罗恩病等明显的炎症以外,还包括了糖尿病、抑郁症、心脏病、中风等致命疾病(参见第49页侧栏)。最近几年,研究人员详细评估了炎症反应与癌症之间的相关性。美国麻省理工学院怀特黑德(Whitehead)生物医学研究所的罗伯特·A ·魏因贝格(Robert A .Weinberg)说:“在我们的研究领域,炎症反应与癌症之间的相关性已经是一个焦点问题。”对于这种研究重点的变化,他在自己主编的教科书《癌症生物学(修订版)》中作了重点论述。
癌症的爆发是一个连续过程:一系列遗传变化引起一群细胞过度增殖,向周围组织侵袭,形成真正的恶性肿瘤;一些肿瘤细胞“不安于现状”,转移到更远的组织,长出新的肿瘤。长久以来,我们的了解仅限于此。研究重点的变化就意味着,癌症生物学家和免疫学家已经认识到,在癌症形成过程中,免疫炎症发挥着重要的调节作用。在病变组织真正变成具有侵略性的肿瘤之前,一些具有伤口修复功能的细胞会被转移到病变组织,在这里,它们“被迫”变成恶性细胞的帮凶,加速癌症爆发——正如研究人员描述的那样:遗传损伤是“导火索”,炎症反应则是“火上浇油”。
在《癌症生物学(修订版)》中,魏因贝格认为,肿瘤并不是一个简单的畸变细胞集合体,它还具有一个供养其生长的系统、一个适于肿瘤生长的微环境(含有各种免疫细胞和纵横交错的化学信号传导途径)以及呈网状分布的血管。在人体内,肿瘤被认为是一个“非法组织”,既不参与血液的输送,也不会清除体内毒素,一心为自己“谋取私利”。
这一全新观点暗示,治疗癌症也许并不需要铲除所有癌细胞。消炎抗癌疗法可以防止有癌变趋势的细胞发展为真正的癌细胞,或者阻止癌细胞在体内扩散。采用这种疗法,癌症患者的生存几率应该会有所提高。莉莎·M·库森斯(Lisa M. Coussens)是美国加利福尼亚大学旧金山分校的癌症生物学家,她评论道:“我并不认为非要根治癌症不可,没必要这样做。如果我们能驾驭癌症,安稳地过完一生,就已经是重大的胜利了。”
免疫防御
要理解炎症与癌症之间的关系,首先得弄清两个基本问题:机体如何对入侵者作出反应;当炎症反应持续时间过长,正常的伤口愈合过程怎样加速癌变进程。如果你不小心踩到一颗钉子,一些细菌会乘机从脚底钻入身体,但它们无法在人体内兴风作浪,因为一进入人体,细菌就会受到一群免疫蛋白和细胞的猛烈攻击。参与防御的免疫蛋白除了抗体外,还有30来种补体蛋白。这些蛋白是其他人体防御机制的一个补充,因此得名“补体”。它们可以导致病菌溶解,而病菌一旦溶解,人体内的吞噬细胞就会出动,将病菌的残余部分吞食掉。
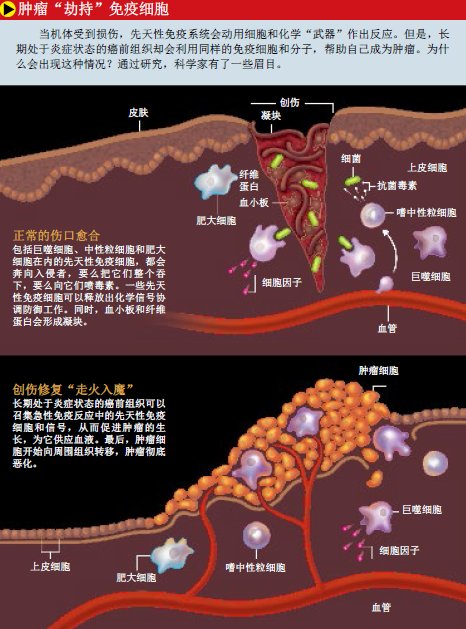
一旦遇到不速之客,巨噬细胞 (macrophage)和嗜中性粒细胞 (neutrophil)就会将它们整个吞下,消化掉。除了上述两种细胞,吞噬细胞还包括自然杀伤细胞(natural killer cell)、肥大细胞(mast cell)和嗜酸性粒细胞(eosinophil)。伤口的愈合除了要消灭入侵病菌,还需要血小板的参与:它们从充斥着血管的内间质层迁移至表皮破损处,使血液凝固。然后,在一些酶的作用下,大量蛋白质形成一个错综复杂的网络,将皮肤细胞固定下来。伤口开始结痂,皮肤又会长回原样,炎症战场也逐渐沉寂下来。不过,炎症反应有时并未真正停止。不仅是皮肤,任何组织都可能因为病原体、毒素或遗传损伤的存在而长期发炎,从而变成心脏病、癌症等疾病的“温床”。
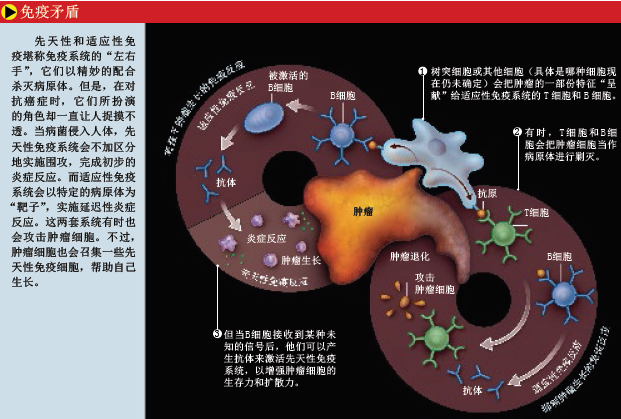
除了第一道防线,脊椎动物还有其他对付病原体的“武器”:适应性免疫应答可以识别入侵者的分子特征,然后有针对性地进行攻击。这项任务的主要执行者是B细胞和T细胞。B细胞制造的抗体分子既可以直接“镇压”病原体,也可以在病原体上打上印记,让其他分子或细胞消灭病原;T细胞可以诱导被感染的细胞自杀,或者分泌特殊的化学物质,指导其他免疫分子的活动。
大量证据显示,慢性炎症与某些肿瘤的恶化有着密切的联系。其实,很早就有研究人员怀疑炎症与癌症存在某种关联性。1863年,德国著名的病理学家鲁道夫·魏尔啸(Rudolf Virchow)在恶性肿瘤中发现了免疫细胞;1978年,意大利米兰大学附属仁爱临床医院(Humanitas Clinical Institute)的阿尔贝托·曼托瓦尼(Alberto Mantovani)在某些肿瘤附近,观察到先天性免疫细胞有聚集的倾向;1986年,美国哈佛医学院的癌症生物学家哈罗德·F·德沃夏克(Harold F. Dvorak)指出,癌症是“无法愈合的伤口”。不过,仍有生物学家坚持认为,免疫系统不仅可以保护机体免受病原体的侵袭,还会剔出有癌变倾向的细胞。到底孰是孰非?仔细观察了癌症周围的微环境后,科学家似乎有了答案。
抗癌还是致癌?
上世纪90年代末,英国伦敦大学玛丽女王癌症研究院的弗朗西丝·鲍尔克威尔(Frances Balkwill)研究了人体内的一种蛋白分子。这种分子类似于激素,是一种免疫信号分子,在浓度较高时,可以杀死癌细胞,因此科学家把它叫做肿瘤坏死因子(TNF)。但是,当低浓度的肿瘤坏死因子长期滞留于肿瘤中时,却可能起到截然相反的作用。在一次试验中,鲍尔克威尔敲除了小鼠身上编码肿瘤坏死因子的基因,使它无法合成肿瘤坏死因子。试验结果令人惊讶:小鼠竟变成了癌症“绝缘体”!她回忆道:“这一结果在科学界引发了一场‘地震’,所有把肿瘤坏死因子当作抗癌药物来研究的科学家都傻眼了,原本的抗癌分子一下子变成了癌症加速剂。”
今天,基因敲除技术已经十分成熟,选择性地敲除小鼠的某个基因,就能验证该基因的具体功能。我们可以利用这种方法,研究癌症与炎症之间的相关性。
1999年,库森斯和道格拉斯·哈纳汗(Douglas Hanahan)、泽纳·韦布(Zena Werb)发表文章指出,转基因小鼠的癌基因即使被激活,产生了癌变前组织,只要没有肥大细胞(mast cell,一种先天性免疫细胞),仍不会形成真正的肿瘤。2001年,美国爱因斯坦医学院的杰弗里·W·波拉德(Jeffrey W. Pollard)和同事培育了一些易患乳癌的转基因小鼠,虽然能在小鼠身上发现具有癌变倾向的组织,但只要没有巨噬细胞的协助,这些组织就不会彻底恶化。
新发现并非对传统观点的全盘否定。实际上,免疫系统是一把“双刃剑”。这个系统的细胞和分子网络的复杂程度仅次于大脑,而且存在自相矛盾之处:有时它对癌症亮“绿灯”,但有时它又亮“红灯”。有些先天性免疫细胞,比如自然杀伤细胞,的确可以抑制肿瘤的生长。而其他免疫细胞,在平时都是消灭肿瘤的“正义之师”,只有当微环境处于炎症状态时,才有可能“助纣为虐”。而且,炎症反应并不是在所有器官中都会导致肿瘤的形成。关于炎症与通过血液扩散的癌症之间的关系还有待进一步确定。
神秘的信号
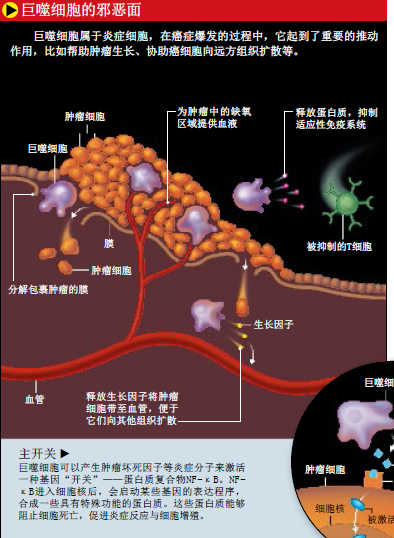
当科学家寻找癌症的帮凶时,常常把注意力集中在巨噬细胞上。在肿瘤的微环境中,这类细胞是白细胞防御体系里很重要的一环。它可以直接杀死肿瘤细胞,或者一发现有不对劲的地方,就立即向T细胞发出警报。但是波拉德等人的研究表明,巨噬细胞在被癌细胞 “洗脑”后,会按照它们的指令行事,变成一座“邪恶工厂”,生产能促使肿瘤形成的细胞因子和生长因子。
在肿瘤内,恶性细胞增殖速度极快,甚至会因为缺氧而死亡。这时候,只要巨噬细胞一靠近肿瘤,恶性细胞就会发出求救信号,诱使它们叛变。缺氧环境再加上肿瘤细胞发出的干扰信号,让巨噬细胞丧失了辨别能力,转而帮助肿瘤细胞渡过难关。癌症生物学家把肿瘤内外的巨噬细胞称为肿瘤相关巨噬细胞。
目前,生物学家已经可以把炎症和癌症的相关性具体到某个信号分子上,这为炎症的致癌作用提供了更为有力的证据。核因子NF-κB是一种存在于细胞内的蛋白复合物,调控着一系列与免疫反应、炎症反应以及细胞生长有关基因的表达。编码这些调控蛋白的基因吸引了全世界科学家的目光。1975年诺贝尔生理学或医学奖得主戴维·巴尔的摩(David Baltimore),以及1993年诺贝尔生理学或医学奖获得者菲利普·夏普(Phillip Sharp)等著名科学家已经在利用NF-κB开发药物,并申请了专利。NF-κB曾经还引发了一场涉及数百万美元的知识产权纠纷。
2004年,以色列耶路撒冷希伯来大学的伊农·本-内里亚(Yinon Ben-Neriah)、埃利·皮卡尔斯基(Eli Pikarsky)等科学家培育了一批基因工程小鼠,这些小鼠易患肝炎,而且很可能恶化为肝癌。但他们发现,如果编码NF-κB的基因被敲除,或者肿瘤坏死因子的活性被抑制,小鼠的肝炎就不会恶化为肝癌。原来,不管采用直接(敲除NF-κB的基因)还是间接(抑制肿瘤坏死因子的活性)的方法,只要阻断了NF-κB的功能,癌变前的肝细胞就会自动死亡。同年,美国加利福尼亚大学圣迭戈分校的迈克尔·卡林(Michael Karin)等人也培育了一些易患结肠炎(可致结肠癌)的小鼠,研究发现,抑制NF-κB活性同样会引起癌变前的结肠细胞自杀。阻断巨噬细胞等炎症细胞间的信号传导途径,也能防止肿瘤的形成。
一些实验数据表明,在很多癌症中,炎症反应会促使癌前组织向恶性肿瘤转变,这是癌症与炎症之间存在相关性的最明显的证据。炎症反应可能还参与了最初的癌变过程,甚至与癌细胞的转移有关。感染幽门螺旋杆菌(Helicobacter pylori)引起的炎症会明显提高胃癌发作的风险,丙型肝炎病毒(hepatitis C virus,HCV)也可导致肝癌。病原体可能会制造自由基,使DNA受到损伤。不过,炎症反应虽有可能一开始就参与癌变过程,但几乎没有研究可以证明,炎症反应会改变DNA,为癌症的爆发埋下伏笔。
炎症反应与癌细胞转移有关的证据则要充分一些。卡林的研究小组培育了一些患有前列腺癌的小鼠,他们发现,促使癌细胞转移的因素是炎症反应,而非癌细胞内的基因突变。2007年4月5日,他们在英国《自然》杂志上发表了实验结果。这项研究表明,前列腺肿瘤周围的炎症细胞会释放一种分子,抑制肿瘤细胞合成一种蛋白质,而这种蛋白质恰好能阻止肿瘤细胞发生转移。卡林认为,这一系列分子事件也许能解释一些奇怪的现象,比如为前列腺组织做活体检查时,切割肿瘤竟然会促进肿瘤细胞转移。如果他的说法是正确的,切割时产生的炎症反应就是肿瘤细胞转移的真正原因。同样,在今年春季,波拉德的研究小组在《癌症研究》杂志上报道了他们的研究结果。他们实验小鼠身上发现,巨噬细胞会“陪着”癌细胞经过血管向其他组织迁移,而且在此过程中,前者会不断向后者发送信号。
炎症反应如何引发癌症?为了得到答案,科学家越来越关注先天性免疫系统。但同时我们也不应该忽视适应性免疫系统。与先天性免疫一样,依靠T细胞和B细胞分泌的抗体对抗病原体的适应性免疫,也可能具有抑制和促进肿瘤形成的双重功效。几十年来,科学家设计的免疫疗法虽然提高了T细胞对癌症的抵抗能力,但从来只能得到令人失望的结果。
一张即将诞生的研究图谱也许会让人们看清整个事件的真相:先天性和适应性免疫细胞之间有着千丝万缕的联系,它们可能都是促使癌症爆发的幕后黑手!研究癌症疫苗的科学家在设计用药方式时(前提是已经证明了疫苗的有效性),就需要考虑两大类免疫细胞之间的相互作用。一项研究显示,卵巢肿瘤会分泌一种信号分子,用于引诱调节性T细胞(这类细胞是适应性免疫细胞中的一种,能抑制其他T细胞的活动,参见《环球科学》2006年第11期《免疫系统的维和部队》一文)。
与此同时,库森斯和她在美国加利福尼亚大学旧金山分校的同事们发现,如果从易患皮肤癌的基因工程小鼠身上,移除负责分泌抗体的B细胞,就可抑制组织变化和血管生成——这是肿瘤恶化的必要条件。在正常情况下,抗体的功能都是维护健康,通过血液循环在全身巡逻,一旦发现病毒和细菌,就立即打上“敌人”的烙印,以便先天性免疫细胞吞噬和清除它们。然而,由于受到癌前组织发出的信号的干扰,抗体会诱导先天性免疫系统帮助肿瘤生长。不过,这一过程是如何发生的还不清楚。
转移抗癌目标
化疗是最常用的癌症疗法,但很难取得理想的效果。原因在于,人们把癌症简单地看作一团变异细胞,而不是一个复杂的器官。波拉德解释说:“研究人员已经能培养和转化肿瘤细胞,并移植到动物体内。它们会长成较小型球状组织,虽然有点像肿瘤,但还称不上复杂。自然形成的肿瘤是一种极为复杂的组织。”
目前,两种主要的抗癌方法——药物治疗和放射治疗,都是以杀死癌细胞为目标。而新型疗法则以延缓炎症反应为目标,为现有抗癌药物提供有效的辅助作用。如果没有巨噬细胞和其他先天性免疫细胞的“搅和”,癌前组织就能得到控制,不会恶化为肿瘤。这样一来,癌症就变成了慢性疾病,就像类风湿性关节炎一样。美国得克萨斯大学安德森癌症中心负责人、抗癌类消炎药研究专家雷蒙德·迪布瓦(Raymond DuBois)说:“请大家不要忘记一个事实:几乎没有人是因为癌症的原发病灶而过世的,真正致命的,是癌细胞的转移。”
化学疗法有着严重的缺陷:只会一味“屠杀”癌细胞,很多时候还会殃及正常细胞。相比之下,治疗慢性炎症药物的应用前景更为诱人。如果癌症高危病人每天服用这类消炎药物,可能会起到很好的预防作用。流行病学和临床研究表明,在一定程度上,阿司匹林等非甾体类消炎药(NSAIDs)可抑制某些肿瘤的形成。科学家接下来的研究重点是,开发能更有针对性地阻断前列腺素合成途径的药物。尤其是抑制前列腺素E2合成的药物,也许能控制炎症反应和肿瘤生长。而且与伟克适(Vioxx)和早期非甾体类药物不同,这类药物不会对心血管和胃肠道造成损害。(参见《环球科学》2007年第2期《镇痛药的安全漏洞》一文)。同时,研究人员也在考察广泛用于降低胆固醇的他汀类药物的消炎作用。
现在,已经有一些这样的药物上市了,比如可抑制血管内皮生长因子(具有促血管生成的作用)合成的阿瓦斯丁(Avastin)。不过肿瘤学家对此并不认同,他们认为在肿瘤微环境中,促使血管生成的“另有他人"。科学家开发的其他消炎药物也可能在抗癌领域派上用场——借鉴治疗艾滋病的“鸡尾酒疗法”,将数种药物混合在一起给病人服用。
肿瘤坏死因子抑制剂已经正式被批准用于类风湿关节炎、克罗恩病等疾病的治疗。研究人员正在进行临床实验,验证这种药物是否具有治疗癌症的功效。利妥昔单抗(Rituxan)是一种单克隆抗体,可抑制类风湿关节炎和B细胞淋巴瘤患者体内的B细胞活性,也可能抑制促进实体瘤形成的炎症反应。其他一些细胞因子和相关分子也是潜在的考察目标,比如NF-κB。
通过抑制NF-κB的活性,非甾体类药物、酞胺哌啶酮以及某种姜黄成分(参见《环球科学》2007年第3期《咖喱医生》一文)也有一定的抗癌作用。不过,在大型制药实验室,科学家都在研究具有高度选择性的抑制因子,它们大都以调控NF-κB活性的酶为攻击目标。
抗癌“木马计”
英格兰谢菲尔德大学的科学家设计了一种极具创新性的抗癌疗法。由于缺乏血液供给,传统药物很难到达肿瘤组织的低氧区域,但巨噬细胞“喜欢”聚集在肿瘤的缺氧区周围,克莱尔·刘易斯(Claire Lewis)与同事利用这一生物学特性,设计了一种药物输送方案。他们把巨噬细胞当作“特洛伊木马”,在里面装载大量的特殊病毒,送到指定区域。巨噬细胞一旦到达目的地,就会将成千上万的病毒释放出来,感染癌细胞。癌细胞内的某种蛋白会激活病毒上的一个基因,再由这个基因合成一种毒素,杀死癌细胞。刘易斯解释说:“与传统的巨噬细胞不同,这种经过基因改造过的巨噬细胞载体不会促进肿瘤的形成。当它到达某个位置,就会按照我们的意图办事。”
目前,我们对消炎抗癌策略的认识还处于比较模糊的阶段。免疫细胞可以形成一道天然屏障,保护机体免受病原体的侵害,如果要改变它们的特性,就要面对一定的风险。迪布瓦指出:“这是个很复杂的问题。如果你关闭免疫系统,病菌就会乘虚而入,就跟艾滋病一样。”如果在治疗其他炎症疾病过程中使用肿瘤坏死因子抑制剂,其他疾病(如肺结核等传染病,甚至淋巴癌)就可能乘机发难。而且,抑制NF-κB的活性有时会导致组织损伤、异常增生,这样反而会促进肿瘤生成。
不过,上述问题不会阻止新一代抗癌类消炎药物的诞生。慢性疾病以及相关炎症状况是人口老化的象征。波拉德说:“我们的身体内多少都有些炎症,”根除突变细胞常常费力不讨好,与其这样,我们还不如“浇灭”肿瘤周围的“炎火”,把癌症变成普通的慢性疾病。
请 登录 发表评论